北五味子多糖提取工艺优化及其对LPS刺激巨噬细胞线粒体膜电位的保护作用
2020-10-23许梦然王迦琦高婧雯葛俊宏
许梦然,王迦琦,高婧雯,葛俊宏,申 野,李 坦,孙 新,*
(1.北华大学医学院,吉林吉林132013;2.吉林省分子老年医学重点实验室,吉林吉林132013;3.北华大学药学院,吉林吉林 132013)
北五味子是中华传统中药,为木兰科,五味子属植物,呈不规则的球形或扁球形,直径5~8 mm,传统中医认为北五味子较南五味子为佳[1],其主要分布于东北三省[2],含有木脂素、多糖、色素、有机酸、氨基酸等多种成分[3-6],多糖是北五味子的主要生物活性成分,药理作用广泛,在保肝、抗氧化、抗衰老、增强免疫等方面都有一定的疗效[7-9]。
研究表明,线粒体膜电位的改变与细胞的氧化应激反应密切相关[10-11]。线粒体是细胞“能量工厂”[12],每时每刻为机体提供能量,线粒体内膜作为细胞有氧呼吸重要场所之一,其在呼吸链电子传递过程中会产生超氧阴离子等活性氧自由基(reactive oxygen species,ROS),若其产生过量会导致线粒体功能障碍进而造成细胞损伤、凋亡或死亡[13],ROS是诱导细胞线粒体膜电位发生改变的关键介质[14]。脂多糖(LPS)是革兰阴性菌外膜主要成分,LPS在体内可以通过细胞信号转导途径激活多种免疫细胞,被广泛用于构建细胞氧化损伤模型或炎症模型[15-17]。
现有文献中,关于北五味子多糖提取方法大多为酶解提取法、超声波辅助法、水提醇沉法,其中酶解法是通过生物酶破坏植物细胞壁结构,促进其生物成分溶出,但此方法对生物酶专一性要求较高,且提取出的多糖粘稠不易干燥[18-19];超声波辅助法是利用超声波的“空穴作用”,破坏植物细胞的细胞壁及细胞膜,此法易引起多糖活性成分减少且发生改变[20]。水提醇沉法是通过不同时间、温度、料液比及次数作为变量将植物中多糖成分浸提出来,操作简单安全,且不易破坏细胞生物活性成分,是多糖提取中常用的提取方法[19]。
近年来有关北五味子多糖的药理作用研究日益增多,如北五味子多糖能够通过抑制谷丙转移酶、谷草转氨酶的表达发挥对小鼠肝脏的保护作用,也可以促进小鼠巨噬细胞的吞噬能力,调节NO分泌水平等[21-22],但有关北五味子多糖对线粒体膜电位的保护作用研究较少。因此本文在水提醇沉法基础上采用四因素三水平正交分析方法提取北五味子多糖,使用LPS构建小鼠巨噬细胞(RAW264.7细胞)损伤模型,探讨北五味子多糖对线粒体膜电位的保护作用,为北五味子的综合研发提供理论基础。
1 材料和方法
1.1 材料与仪器
北五味子 选自长白山脉野生五味子;RAW264.7细胞 北华大学生命科学中心;胎牛血清、DMEM细胞培养液 美国Gibco公司;维生素E聚乙二醇琥珀酸酯(水溶性VE,VE-TPGS)、脂多糖(LPS) 美国Sigma公司;无水乙醇、葡萄糖标准品、Bradford蛋白检测试剂盒、FRAP总抗氧化能力检测试剂盒、细胞活性氧检测试剂盒、JC-1线粒体膜电位检测试剂盒 中国碧云天。
Infinite M200 PRO酶标仪 美国Beckman公司;TH4-200倒置荧光显微镜 日本Olympus公司;MCO-18AICUVL-PC二氧化碳培养箱 日本Panasonic公司。
1.2 实验方法
1.2.1 北五味子多糖提取及纯化 称取洗净干燥的北五味子粉碎后过40目筛,选择一定的提取温度、提取时间、提取次数、提取料液比,通过水提醇沉提取北五味子多糖,热水浸提后,将多糖溶液浓缩至500 mL,3000 r/min离心除去糖溶液中北五味子残渣,使用分液漏斗缓慢加入约4倍体积无水乙醇至乙醇浓度达到70%,醇沉过夜后,2000 r/min离心,弃去上清,沉淀经无水乙醇洗脱放入铁盘平铺均匀后真空干燥,得到北五味子粗多糖[23]。将粗多糖干燥后称量,以5%比例溶于水进行反复冻融初步去除蛋白:糖溶液冻于-80 ℃冰箱内过夜,次日取出至完全融化,12000 r/min高速离心6 min后,弃去蛋白沉淀后再将上清冻于-80 ℃冰箱,重复此步骤,反复冻融直至无蛋白沉淀析出即可;使用氯仿、正丁醇以4∶1配制Sevag溶液[24],Seavg溶液与糖溶液以2∶1的比例混合,使用振荡器剧烈振荡1 h,4000 r/min离心15 min,上层溶液为糖溶液,中间层为蛋白质层,下层溶液为有机试剂,回收糖溶液,重复此操作直至中间层无蛋白析出;最后将糖溶液装于3500 Da的透析袋中,流水透析24 h,去除糖溶液中葡萄糖、无机盐等小分子杂质,冻干得到北五味子多糖。根据以下公式计算北五味子多糖得率:

式中,m北五味子多糖为纯化后的北五味子多糖的质量,m北五味子为北五味子原材料的质量。
1.2.2 单因素实验 根据1.2.1北五味子多糖提取过程进行大量预实验后,排除对多糖得率影响较小的提取因素,最终选定提取料液比1∶30 g/mL、提取温度90 ℃、提取时间3 h和提取次数2次进行单因素实验,研究4个因素对北五味子多糖得率的影响。
1.2.2.1 提取料液比对北五味子多糖得率的影响 在提取温度为90 ℃,提取时间为3 h,提取次数为2次的条件下,设定提取料液比在1∶10、1∶20、1∶30、1∶40、1∶50、1∶60 g/mL,考察不同提取料液比对北五味子多糖得率的影响。
1.2.2.2 提取温度对北五味子多糖得率的影响 在提取料液比为1∶30 g/mL,提取时间为3 h,提取次数为2次的条件下,设定提取温度在50、60、70、80、90、100 ℃,考察不同提取温度对北五味子多糖得率的影响。
“还怕!一百个男人还不够哩!”不知谁,她的声音没有人接受,空洞地在屋中走了一周,最后声音消灭在白月的窗纸上。
1.2.2.3 提取时间对北五味子多糖得率的影响 在提取料液比为1∶30 g/mL提取温度为90 ℃,提取次数为2次的条件下,设定提取时间在1.0、1.5、2.0、2.5、3.0、3.5 h,考察不同提取时间对北五味子多糖得率的影响。
1.2.2.4 提取次数对北五味子多糖得率的影响 在提取料液比为1∶30 g/mL,提取温度为90 ℃,提取时间为3 h的条件下,设定提取次数为1、2、3、4次,考察不同提取次数对北五味子多糖得率的影响。
1.2.3 四因素三水平L9(34)法确定提取北五味子多糖提取工艺 单因素实验初步确定提取参数变量范围后,使用四因素三水平正交分析评估四项因素、四因素间的效应及相互作用对北五味子多糖得率的影响。该设计中4个独立变量共有9种组合,参数变量水平设置见表1。
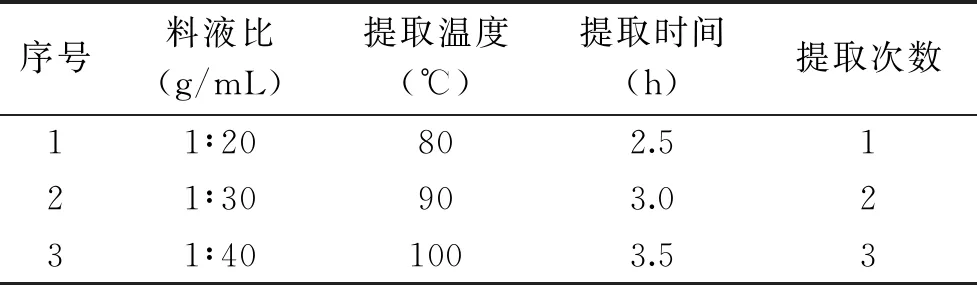
表1 实验因素水平
1.2.4 多糖含量测定 利用苯酚硫酸法测定北五味子多糖总糖及葡萄糖含量[25-27]。取干燥葡萄糖配制浓度为100 μg/mL的葡萄糖标准液,精密量取葡萄糖标准液0、0.1、0.2、0.4、0.6、0.8、1.0 mL于干净试管内,分别加入去离子水至1 mL,配成浓度为0、10、20、40、60、80、100 μg/mL的葡萄糖溶液,北五味子多糖配制成为100 μg/mL糖溶液,加入5%三氯乙酸、15%三氯乙酸不断研磨,离心取上清后加入2 mL 6 mol/L的盐酸,96 ℃水浴2 h,流水冷却后加入2 mL 6 mol/L氢氧化钠摇匀,标记为样品一,未处理的100 μg/mL北五味子多糖溶液为样品二,将样品一、样品二及不同浓度葡糖糖溶液依次加入6%苯酚0.5 mL,浓硫酸2.5 mL,剧烈振荡,置于沸水中加热10 min,室温静置30 min,490 nm处检测吸光度值。以光密度为纵坐标(Y),不同葡萄糖浓度为横坐标(X),绘制葡萄糖标准曲线,分别将样品一所得吸光度、样品二所得吸光度带入标准曲线,所得X值与北五味子多糖浓度的比值即为北五味子多糖总糖含量及北五味子多糖葡萄糖含量。
1.2.5 北五味子多糖的DPPH自由基清除率测定 取无水乙醇及DPPH粉末配制2×10-4mol/L的DPPH工作液,将北五味子多糖、VE-TPGS均稀释为不同浓度(25、50、100、200、400、800、1600 μg/mL),实验组分别于96孔板中加入200 μL不同浓度北五味子多糖、VE-TPGS,再加入200 μL DPPH工作液;实验对照组分别于96孔板中加入200 μL不同浓度北五味子多糖、VE-TPGS,再加入200 μL 蒸馏水;空白组中分别于96孔板中加入200 μL DPPH工作液,再加入200 μL 蒸馏水,按照以下公式进行计算清除率[28]:
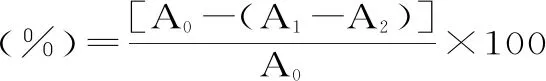
式中,A1为不同浓度北五味子多糖及VE-TPGS加DPPH测得的吸光度;A2为不同浓度北五味子多糖及VE-TPGS加蒸馏水测得的吸光度;A0为蒸馏水加DPPH测得的吸光度值。
1.2.6 北五味子多糖的羟自由基清除率测定 首先依次配制浓度均为6 mmol/L的FeSO4和水杨酸及过氧化氢溶液,将北五味子多糖、VE-TPGS均稀释为不同浓度(25、50、100、200、400、800、1600 μg/mL),实验组于96孔板中每孔加入50 μL不同浓度北五味子多糖或VE-TPGS,再加入50 μL FeSO4、水杨酸及过氧化氢;实验对照组于96孔板中每孔加入50 μL不同浓度北五味子多糖或VE-TPGS,再加入50 μL FeSO4、蒸馏水及过氧化氢;空白组组于96孔板中每孔加入50 μL蒸馏水,再加入50 μL FeSO4、水杨酸及过氧化氢,按照以下公式进行计算清除率[29]:
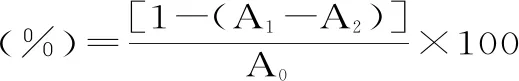
1.2.7 北五味子多糖的总抗氧化能力检测 利用FRAP总抗氧化能力检测试剂盒对北五味子多糖的总抗氧化能力进行检测,抗氧化物可以还原Ferric-tripyridyltriazine(Fe3+-TPTZ)产生蓝色的Fe2+-TPTZ,通过测定其在593 nm吸光度值计算样品中的总抗氧化能力。将FRAP标准品稀释至不同浓度(0.15、0.3、0.6、0.9、1.2、1.5 mmol/mg),北五味子多糖、VE-TPGS均稀释为不同浓度(25、50、100、200、400、800、1600 μg/mL),配制FRAP工作液,将工作液与样品溶液在 96孔板中混合均匀,测其吸光度,根据FRAP标准品吸光度绘制标准曲线,将不同浓度北五味子多糖及VE-TPGS吸光度值带入标准曲线,得到总抗氧化能力[30]。
1.2.8 细胞活性氧检测 利用ROS检测试剂盒对LPS诱导巨噬细胞产生的活性氧进行检测,DCFH-DA荧光探针本身没有荧光,在进入细胞内后,细胞酯酶将其水解生成DCFH,活性氧可以氧化DCFH生成有荧光的DCF,并利用其检测活性氧水平。将含有10% FBS的1640培养液的RAW264.7(6×104个细胞/孔)细胞铺在6孔板中过夜,设置空白组、模型组、北五味子多糖组(100、200 μg/mL)、空白对照组在等体积培养液中培养;模型组使用LPS(1 μg/mL)处理24 h,其余组先使用不同浓度多糖预处理24 h后,再加入LPS(1 μg/mL)处理24 h,置于37 ℃、5% CO2的培养箱中培养。然后吸去上清液,用无血清培养基配制10 μmol/mL的DCFH-DA荧光探针,将其加入到 6孔板中,覆盖细胞表面,37 ℃细胞培养箱孵育20 min,用无血清培养基冲洗细胞 3次,荧光显微镜下进行观察荧光染色情况,使用Image J图像处理软件对荧光图片进行分析,计算得到各组细胞染色的荧光强度,探索北五味子多糖对ROS产生的影响作用。
1.2.9 细胞线粒体膜电位检测 利用线粒体膜电位检测试剂盒对LPS诱导巨噬细胞后线粒体膜电位变化进行测定,JC-1是一种可广泛用于检测线粒体膜电位的荧光探针。在线粒体膜电位较高时,JC-1聚集在线粒体的基质中,产生红色荧光,线粒体膜电位下降,红色荧光减少,可根据荧光判断细胞线粒体膜电位的变化,细胞培养方法同1.2.8。培养后细胞吸去上清液,PBS洗涤细胞,在6孔板中加入1 mL细胞培养基及1 mL JC-1染色工作液,充分混匀后37 ℃细胞培养箱孵育20 min,弃去上清,每孔加入1 mL JC-1染色缓冲液洗涤细胞3次,最后弃去上清每孔加入2 mL细胞培养基,荧光显微镜下进行观察,使用Image J图像处理软件对荧光图片进行分析,计算得到各组细胞染色的荧光强度,探索北五味子多糖对线粒体膜电位的保护作用。
1.3 数据处理
所有实验重复三次,数据表示为Mean±SD。正交统计分析结果通过SPSS19.0软件进行分析,其余结果均使用GraphPad Prism Version 6(One-way ANOVA)进行分析,并且在P<0.05差异有统计学意义。
2 结果与分析
2.1 单因素实验结果
2.1.1 不同提取料液比对多糖得率的影响 以不同料液比为单因素变量,分析其对多糖得率的影响,如图1所示,料液比在1∶10~1∶30范围内时,多糖得率呈明显的上升趋势,随着料液比的增加,多糖得率开始下降,可能由于料液比过小,溶液黏度大,不利于活性成分扩散,得率较低,而料液比过大,会影响溶剂间热传递,不利于多糖提取[31]。料液比为1∶20、1∶30、1∶40时多糖得率明显较高,在料液比为1∶30时,多糖得率可达到7.32%±0.11%,故选此三点进行正交试验。
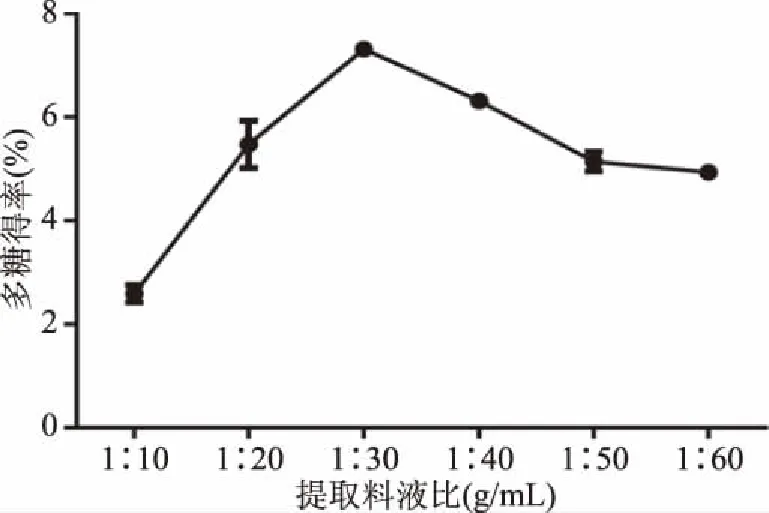
图1 不同料液比对多糖得率的影响
2.1.2 不同提取温度对多糖得率的影响 以不同温度为单因素变量,分析其对多糖得率的影响,如图2 所示,温度在50~90 ℃时,多糖得率呈明显的上升趋势,随着温度的进一步增加,多糖得率开始下降,可能由于温度较低时,多糖分子移动速度较慢,得率较低,而提取温度过高会影响多糖的稳定性,也会导致得率下降[32]。温度为80、90、100 ℃时多糖得率较高,提取温度为90 ℃时,多糖得率为7.81%±0.14%,故选此三点进行正交试验。
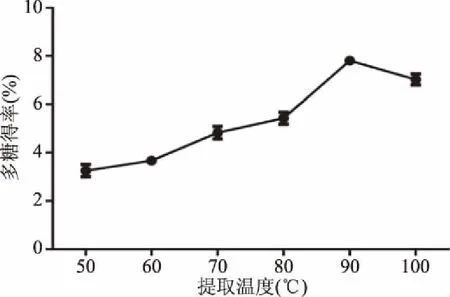
图2 不同提取温度对多糖得率的影响
2.1.3 不同提取时间对多糖得率的影响 以不同时间(1.0、1.5、2.0、2.5、3.0、3.5 h)为单因素变量,分析其对多糖得率的影响,如图3 所示,提取时间在1.0~3.0 h时,多糖得率呈明显的上升趋势,随着时间的延长,多糖得率开始下降,研究表明,在一定时间多糖得率会随时间的延长而升高,超出该时间范围,多糖会因水解过度而导致得率下降[33]。提取时间为2.5、3.0、3.5 h时多糖得率较高,提取温度为3.0 h时,多糖得率为6.27%±0.06%,故选此三点进行正交试验。
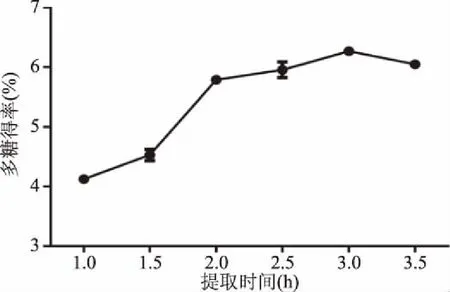
图3 不同提取时间对多糖得率的影响
2.1.4 不同提取次数对多糖得率的影响 以不同提取次数(1、2、3、4次)为单因素变量,分析其对多糖得率的影响,如图4所示,提取次数在1~2次时,多糖得率呈明显的上升趋势,提取次数过少导致多糖提取不充分,随着提取次数的增多,多糖得率趋于平衡,未发生明显变化,增加提取次数对多糖的得率已无明显影响。提取次数为2次时,多糖得率为6.81%±0.25%,由于提取次数为4次时,对多糖得率无明显影响,故选择提取次数为1、2、3次时进行正交试验。
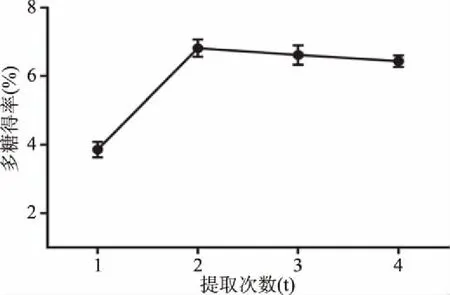
图4 不同提取次数对多糖得率的影响
2.2 四因素三水平正交分析法得到北五味子多糖的提取方案
根据图1~图4得到结果进行正交试验,如表2~表3所示,方差分析中F值和P值用于检验模型的显著性,其中,料液比、提取次数对多糖得率有显著影响(P<0.05),而提取温度、提取时间对多糖得率影响不显著(P>0.05),根据R值、方差平方和及F值可知,对多糖得率影响最大的因素为提取的料液比,其次为提取次数,而提取温度,提取时间对多糖得率的影响较小,北五味子多糖提取条件为A3B2C2D3,即料液比1∶40,提取温度90 ℃,提取时间3.0 h,提取次数为3次,在此条件下,经过验证实验,北五味子多糖得率可达到10.72%。
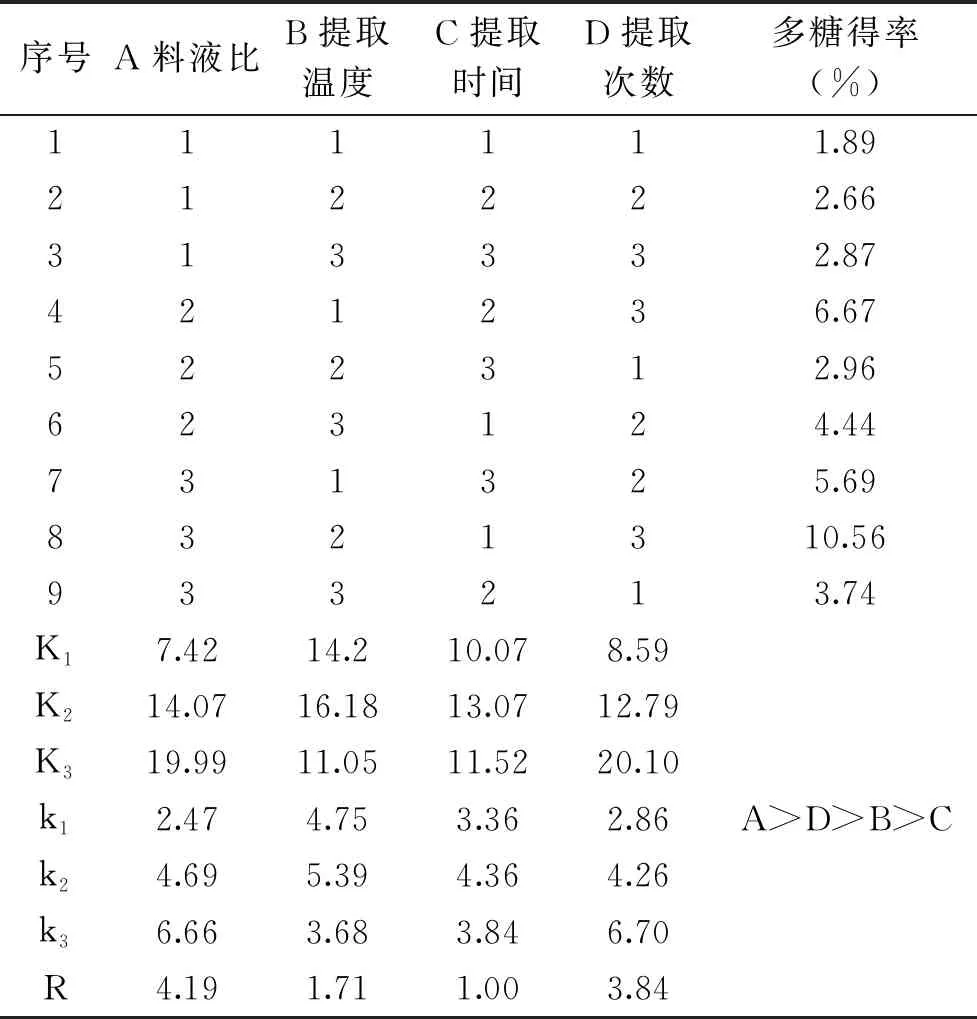
表2 正交实验结果
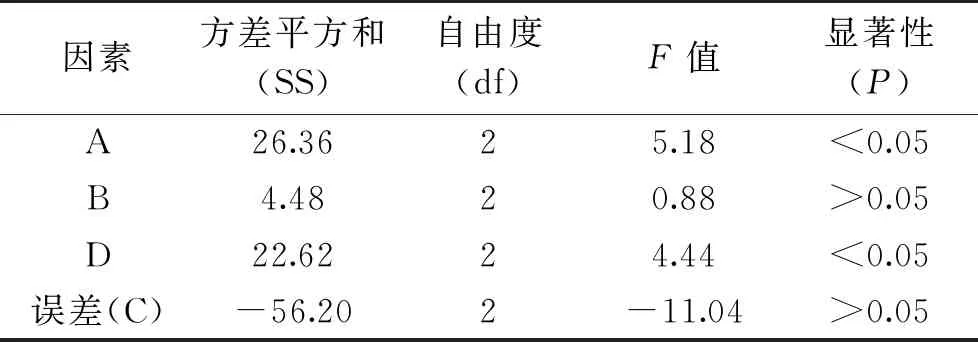
表3 北五味子多糖得率的方差分析
2.3 北五味子多糖的总糖及葡萄糖含量检测
利用葡萄糖标准品稀释成不同浓度得到葡萄糖标准曲线如图5所示,得到线性回归方程y=0.0073x-0.0359,R2=0.9988,北五味子多糖C=100 μg/mL时,样品一吸光度值为0.58±0.01,根据公式可得,提取的北五味子多糖的总糖含量为84.28%±2.03%,样品二吸光度值为0.19±0.01,根据公式可得,北五味子多糖葡萄糖含量为30.26%±1.12%。
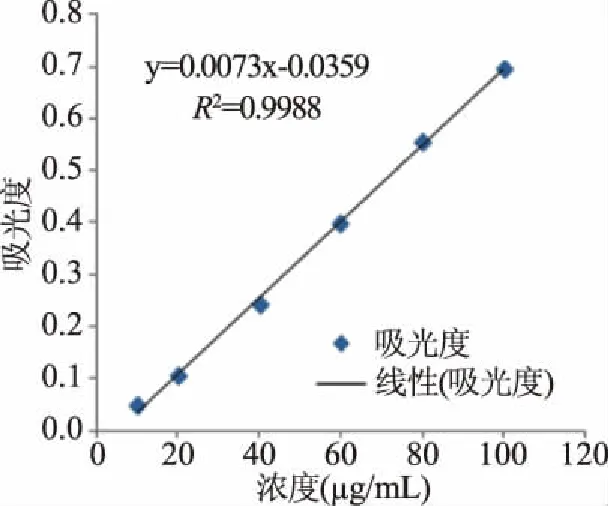
图5 葡萄糖标准曲线
2.4 北五味子多糖的体外抗氧化能力检测
如图6A所示,北五味子多糖与VE-TPGS在25~1600 μg/mL时对DPPH自由基的清除率成剂量依赖式增加,北五味子多糖的DPPH自由基清除率为9.78%±2.18%~71.92%±1.01%;VE-TPGS的DPPH自由基清除率为9.34%±1.37%~59.24%±1.31%,北五味子多糖及VE-TPGS清除DPPH自由基的IC50值分别为602.52、1388 μg/mL,结果表明北五味子多糖DPPH自由基清除能力显著优于VE-TPGS(P<0.05)。
如图6B所示,北五味子多糖在25~1600 μg/mL时对羟自由基的清除率成剂量依赖式增加,北五味子多糖的羟自由基清除率为40.16%±1.01%~83.06%±0.21%;VE-TPGS的羟自由基清除率为47.79%±0.89%~50.03%±1.59%,北五味子多糖及VE-TPGS清除羟自由基的IC50值分别为34.24、34.05 μg/mL,结果表明北五味子多糖与VE-TPGS相比,具有更强的羟自由基清除能力(P<0.05)。
如图6C~6D所示,FRAP标准曲线为y=0.4924x+1.1366,R2=0.9996,将不同浓度北五味子多糖吸光度值带入标准曲线后可知,北五味子多糖在25~1600 μg/mL时的总抗氧化能力成剂量依赖式增加,北五味子多糖的总抗氧化能力为(0.14±0.01)~(0.28±0.01) mmol/mg;VE-TPGS的总抗氧化能力为(0.04±0.02)~(0.16±0.00) mmol/mg。结果表明北五味子多糖的总抗氧化能力优于及VE-TPGS(P<0.05)。
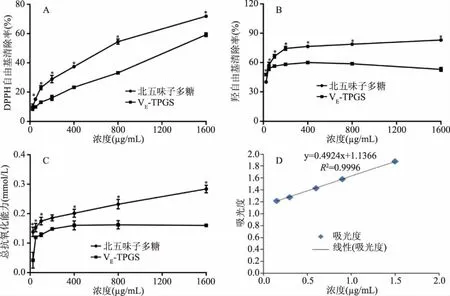
图6 北五味子多糖抗氧化能力检测
2.5 北五味子多糖对LPS诱导RAW264.7细胞产生ROS的抑制作用
如图7所示,7A~7D为别为对照组、模型组、不同浓度多糖组(100、200 μg/mL)细胞的ROS荧光染色情况,7E为ROS染色的荧光强度分析,与图A对照组相比,图B LPS模型组中荧光染色细胞增多,荧光强度明显上调(P<0.001),表明LPS刺激巨噬细胞后,ROS水平升高,而图7C~7D北五味子多糖处理组与LPS模型组相比,荧光染色细胞呈剂量依赖式减少,荧光强度下调(P<0.001),表明北五味子多糖能够有效抑制LPS刺激巨噬细胞后ROS的表达水平。
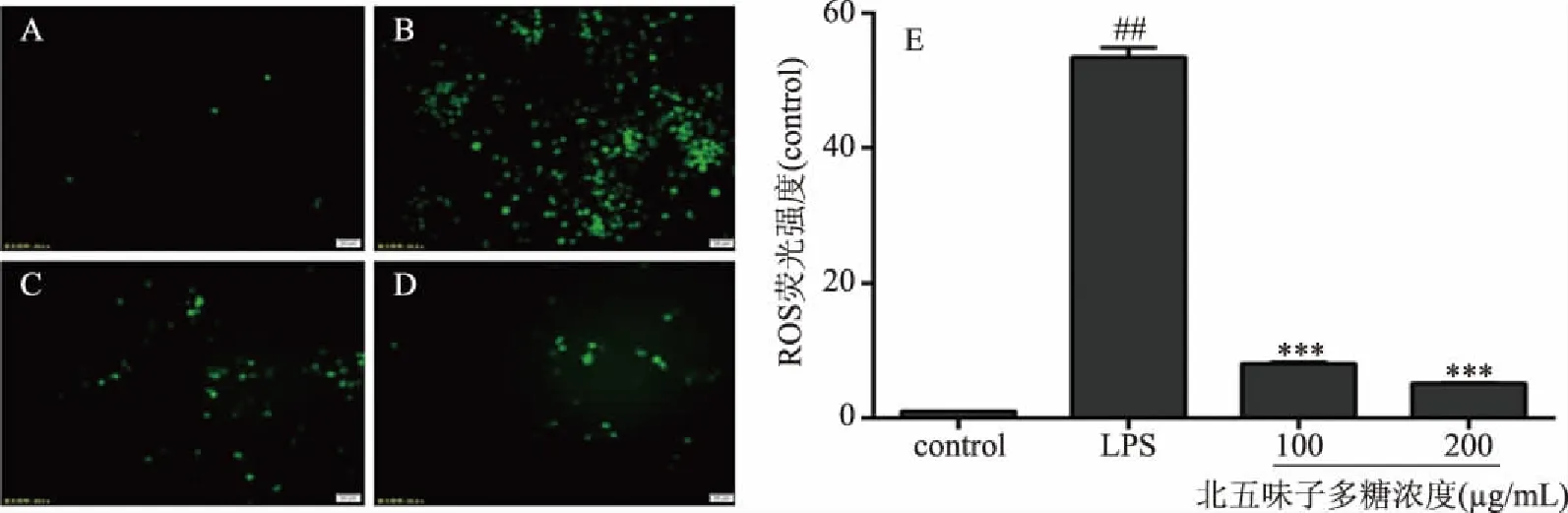
图7 北五味子多糖对LPS诱导RAW264.7细胞中ROS含量的影响(n=3)
2.6 北五味子多糖对LPS诱导RAW264.7细胞后线粒体膜电位的保护作用
如图8所示,8A~8D分别为对照组、模型组、不同浓度多糖组(100、200 μg/mL)细胞的线粒体膜电位荧光染色情况,8E为线粒体膜电位染色荧光强度分析,图A对照组中荧光染色细胞较多,线粒体膜电位偏高,LPS模型组与对照组相比荧光染色细胞减少,荧光强度下降(P<0.001),表明LPS刺激巨噬细胞后,细胞线粒体膜电位下降,而图8C~8D北五味子多糖处理组与LPS模型组相比,荧光染色细胞呈剂量依赖式增多,荧光强度上调(P<0.01),表明北五味子多糖能够有效保护LPS刺激巨噬细胞的线粒体膜电位。
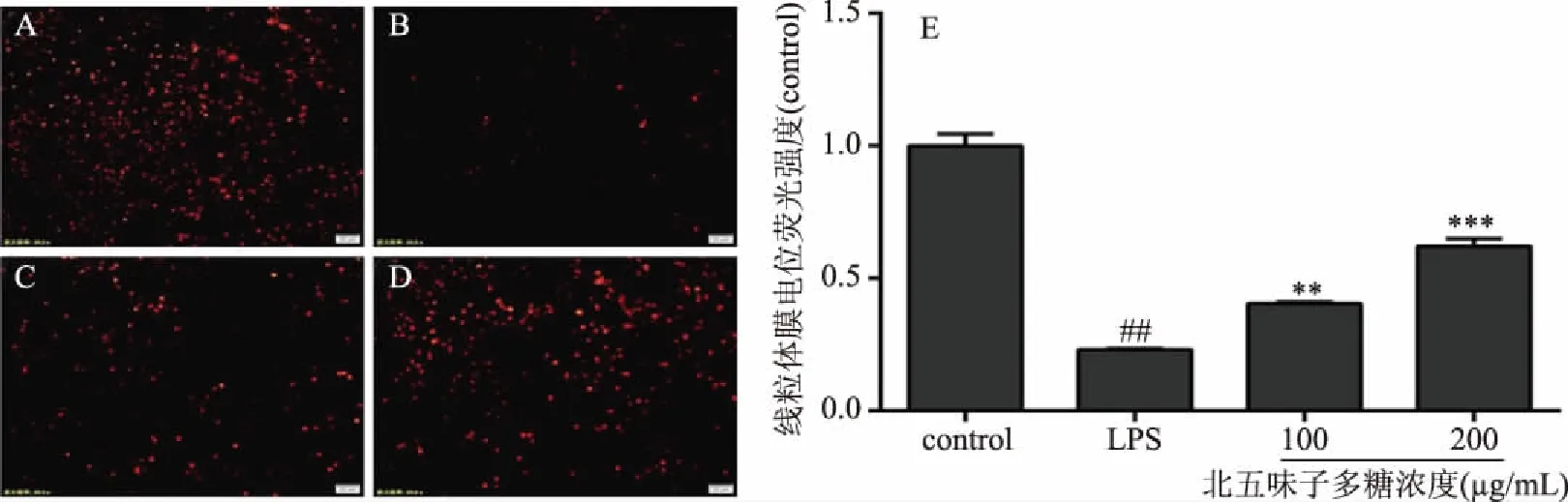
图8 北五味子多糖对LPS诱导RAW264.7细胞线粒体膜电位的影响(n=3)
3 讨论
本研究在热水浸提法基础上通过四因素三水平正交分析方法对北五味子多糖进行提取,分析了不同提取料液比、提取次数、提取温度、提取时间对北五味子多糖得率的影响,确定了北五味子多糖的提取方案为料液比1∶40,提取温度90 ℃,提取时间3.0 h,提取次数为3次,所提取的北五味子多糖的总糖含量为84.28%±2.03%、葡萄糖含量为30.26%±1.12%。
氧化应激是指机体受到刺激时,抗氧化系统与氧化系统无法平衡,导致组织损伤,与多种疾病密切相关[34-35]。自由基生成过多,可破坏细胞DNA与蛋白质,导致机体抗氧化酶活性减低[36-37],引发衰老,而衰老细胞蛋白错误折叠,亦可促进氧化应激发生[38]。王珊珊等[39]发现,北五味子多糖具有较强的抗氧化活性,本研究中北五味子多糖清除DPPH自由基的IC50值为602.52 μg/mL,清除羟自由基的IC50值为34.24 μg/mL,总抗氧化能力(0.14±0.01)~(0.28±0.01) mmol/mg,均呈剂量依赖性增加且明显优于VE-TPGS(清除DPPH自由基的IC50值为1388 μg/mL;清除羟自由基的IC50值为34.05 μg/mL;总抗氧化能力:(0.04±0.02)~(0.16±0.001) mmol/mg)(P<0.05)。
ROS可通过破坏DNA稳定性诱导氧化应激反应继而导致多种疾病的发生[40-41],抑制ROS的生成也是评价体外抗氧化能力的重要标准[42]。线粒体是生命活动的调控中心,它不仅是 ROS的主要来源,也是ROS作用的主要靶点[43]。LPS的合成及转运是一个复杂的过程,它在调节免疫系统的同时可进一步诱导ROS生成[44],继而导致线粒体功能紊乱,线粒体膜电位下降。因此,本研究通过对LPS刺激巨噬细胞后ROS及线粒体膜电位检测,研究北五味子多糖对ROS的清除作用及对线粒体膜电位的保护作用。结果表明,与对照组相比,LPS刺激巨噬细胞后,ROS水平升高,荧光强度上升(P<0.001);线粒体膜电位下降,荧光强度减低(P<0.001),在加入北五味子多糖处理后,ROS含量显著降低,荧光强度减低(P<0.001);线粒体膜电位升高,荧光强度上升(P<0.01)。本研究表明:北五味子多糖减少由LPS诱导的巨噬细胞中ROS水平,进一步证实其具有较强的抗氧化活性,并能够抑制线粒体膜电位下降,进而稳定线粒体膜电位。
4 结论
多糖作为北五味子的主要活性成分,具有毒副作用小,药理作用广泛等优点,在本研究中明确北五味子多糖具有较强体外抗氧化活性,在细胞实验中能够通过抑制LPS诱导巨噬细胞后产生的ROS进而保护线粒体膜电位。在未来研究中,将进一步对北五味子多糖是否能够通过其他路径保护线粒体膜电位,维持细胞正常生理功能进行探讨,为长白山特色药物北五味子研发利用提供理论依据。
