重症成人斯蒂尔病一例
2020-10-22李文娟黄祥奇周宇麒
李文娟?黄祥奇?周宇麒
【摘要】成人斯蒂爾病(AOSD)是一种累及多系统、临床表现复杂多样且缺乏特异性诊断指标的临床综合征,极易被误诊或漏诊。其病因和发病机制尚未明确,有较多学者认为与感染、遗传和免疫异常有关,近年来认为AOSD属于“自身炎症反应综合征”。目前尚无统一诊断标准,我国推荐应用较多的是日本Yamaguchi标准。AOSD治疗上以NSAID和(或)糖皮质激素及改善病情抗风湿药为主,生物制剂也有一定效果。该文报道1例重症AOSD患者,以反复发热为首发症状,积极抗感染治疗无效,病情逐渐进展,后出现关节症状、水肿、休克、心力衰竭、急性呼吸窘迫、肺部感染、严重贫血等表现,最后临床确诊,经过糖皮质激素及改善病情抗风湿药、升压、抗心力衰竭、抗感染、连续肾脏替代疗法、呼吸机辅助呼吸及相关对症支持处理后病情好转出院,随访1年余患者健康存活。该例提示,应提高对重症AOSD患者的认识,减少误诊或漏诊,提高诊治致命性AOSD的能力。
【关键词】成人斯蒂尔病,重症;改善病情抗风湿药;糖皮质激素
Severe adult-onset Stills disease: a case report Li Wenjuan, Huang Xiangqi, Zhou Yuqi. Department of Pulmonary and Critical Care Medicine, the Third Affiliated Hospitalof Sun Yat-sen University, Guangzhou 510630, China
Corresponding author, Zhou Yuqi, E-mail: zzyyqqcj7605@ 163. com
【Abstract】Adult-onset Stills disease (AOSD) is a clinical syndrome involving complex and diverse clinical manifestations of multiple systems and lacks of specific diagnostic indicators, which can be easily misdiagnosed. The etiology and pathogenesis of AOSD are still unclear. Many scholars believe that AOSD is related to infection, heredity and immune abnormality. In recent years, AOSD has been considered as an autoimmune inflammatory response syndrome. Currently, there is no unified diagnostic standard, and the Yamaguchi standard is recommended to be applied in China. Non-steroidal anti-inflammatory drug (NSAID) and/or glucocorticoids and even disease-modifying anti-rheumatic drugs (DMARD) are mainly utilized to treat AOSD. Biological agents can yield certain efficacy. In this article, we reported one case of severe AOSD presenting with recurrent fever as initial symptoms, who was untreated after antibiotic therapy and developed progressive symptoms, such as joint symptoms, edema, shock, heart failure, acute respiratory distress syndrome, pulmonary infection and severe anemia. Eventually, the clinical diagnosis was confirmed. Through corticosteroids and anti-rheumatic medicine/DMARDs, blood pressure treatment, heart failure management, anti-infection, CRRT, assisted ventilation and other supportive treatment, the patient was discharged and remained physically stable and healthy during follow-up for more than a year. This case prompts that we should deepen the understanding of severe AOSD, reduce the risk of misdiagnosis or missing diagnosis, and improve the diagnosis and treatment of this fatal condition.
【Key words】Adult-onset Stills disease, severe;Disease-modifying anti-rheumatic drugs;
Corticosteroids
四、诊治经过
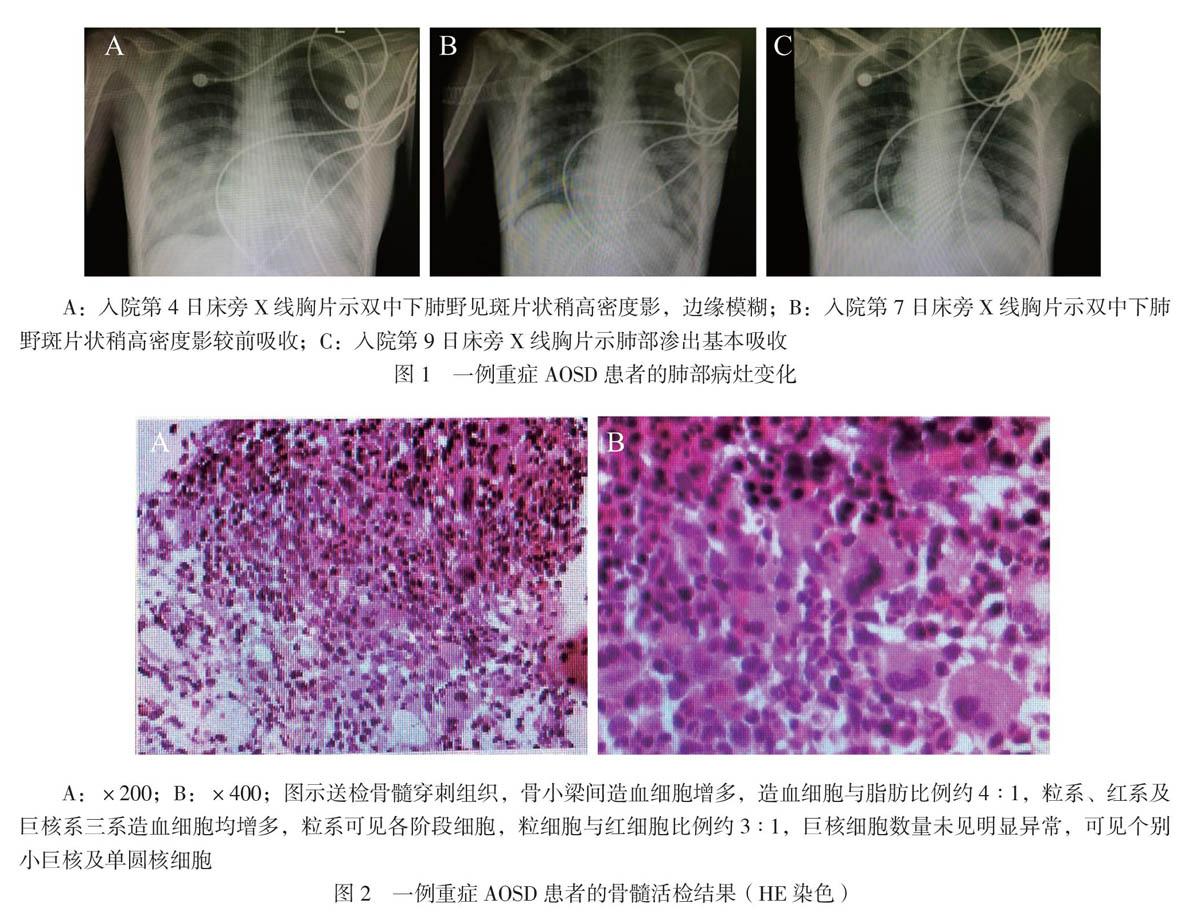
患者入我院后未再发热,入院后继续予甲泼尼龙口服24 mg/d、去甲肾上腺素升压、蛋白扩容、护肝、护胃、鼻导管吸氧等对症支持治疗。入院第3日08:00查血常规:血红蛋白 68 g/L,红细胞 2.75×1012/L,白细胞7.76×109/L,中性粒细胞0.735,血小板 159×109/L,予输注同型红细胞2 U,21:30患者开始出现咳嗽,经皮血氧饱和度(SpO2)逐渐下降至0.88,查动脉血气:pH 7.46,PaO2 47 mm Hg,PaCO2 34 mmHg,剩余碱 0.5 mmol/L,HCO3- 24.2 mmol/L,乳酸 8.1 mmol/L,予加用面罩吸氧后SpO2可维持在0.90以上。入院第4日02:08患者咳嗽加剧,咳出少量粉红色分泌物,伴有呼吸困难及胸闷不适,查氨基末端脑钠肽前体(NT-proBNP)7300 ng/L,动脉血气:pH 7.12,PaO2 39 mm Hg,PaCO2 72 mm Hg,剩余碱-6.3 mmol/L,HCO3- 23.4 mmol/L,乳酸 10.2 mmol/L。血常规:白细胞 12.85×109/L,中性粒细胞0.731,红细胞2.79×1012/L,血小板186×109/L,血红蛋白73 g/L。心电图较入院时未见明显变化,心梗3项未见异常。床旁X线胸片示双中下肺野有斑片状稍高密度影,边缘模糊,见图1A。考虑为急性左侧心力衰竭、ARDS及混合性失代偿期酸中毒,立即行床旁气管插管接呼吸机辅助通气及股静脉置管行床旁连续肾脏替代疗法(CRRT)、强心、抗心力衰竭、改善心肌代谢、营养心肌、镇静镇痛等治疗。入院第4日上午实验室检查结果回报抗心磷脂抗体 15.9 RU/ml。T-SPOT:A抗原 23个,B抗原14个。风湿2项、抗可溶性抗原(ENA)谱、SLE 3项、血管炎4项、抗磷脂抗体综合征3项、PPD试验、肥达+外-斐试验、全血找疟原虫、肝吸虫计数、粪便找阿米巴滋养体及疟原虫、EB病毒(EBV)+巨细胞病毒(CMV)DNA测定、G6PD +地中海贫血、溶血性贫血、维生素B12及叶酸测定、3点血浆皮质醇测定均未见异常。床旁双侧颈部、腋窝及腹股沟淋巴结彩超未见异常血供及肿瘤倾向。骨髓细胞学形态:增生性贫血伴反应性组织细胞增多骨髓象 [G/E = 3.85/1,铁染色外铁(+)]。骨髓活检:符合增生活跃骨髓象,见图2。考虑为AOSD合并休克、心力衰竭、ARD、中-重度贫血、混合性失代偿期酸中毒;予甲泼尼龙160 mg/d,连用3 d。入院第7日激素开始减量至100 mg,复查血常规:血红蛋白77 g/L,红细胞 2.04×1012/L,白细胞 12.01×109/L,中性粒细胞 0.808,血小板 131×109/L。床旁X线胸片:双中下肺野斑片状稍高密度影较前吸收,见图1B,考虑患者存在肺部感染,予抗感染(卡泊芬净+美罗培南)治疗。入院后第9日患者血压、血氧稳定、乳酸降至正常范围、肝功能恢复正常、肺部渗出基本吸收,见图1C,停用去甲肾上腺素、护肝药、床边CRRT及呼吸机治疗,并改用头孢哌酮钠舒巴坦钠抗感染治疗。入院后第10日,甲泼尼龙剂量减至80 mg/d,并加用吗替麦考酚酯0.5 g每日2次治疗。入院后第11日复查血常规白细胞及中性粒百分比恢复至正常范围,甲泼尼龙减量至60 mg/d,吗替麦考酚酯剂量增至0.75 g每日2次,加用羟氯喹200 mg每日2次治疗,降级用头孢硫脒抗感染,入院后第16日查正电子发射断层显像/计算机断层显像(PET/CT):全身未见实质性恶性肿瘤影响改变;脾大,氟代脱氧葡萄糖(FDG)代谢弥漫性轻度增高,提示脾功能亢进;全身骨髓FDG代谢弥漫性轻度增高;甲状腺左侧叶结节影,代谢未见增高,考虑为良性病变,腺瘤待排;双侧蝶窦、筛窦及上颌窦炎症。心脏彩超示心包微量积液,其余未见异常。提示肿大的淋巴结及肝脏经治疗后恢复正常、心功能恢复正常,表明治疗有效果,甲潑尼龙继续减量至40 mg/d,维持1周未见病情复发,期间多次查血常规,白细胞及中性粒细胞、血小板均正常,血红蛋白逐渐升高至105 g/L,血清铁蛋白降至343 μg/L。入院后第24日,患者改口服甲泼尼龙32 mg/d,带药出院治疗,随后定期在我院门诊随访,激素继续缓慢减量至口服8 mg/d甲泼尼龙及改善病情抗风湿药(DMARD)维持治疗。随访1年余,患者病情未再复发,监测血常规、肝功能及血清铁蛋白均正常。
讨论
AOSD是一种病因和发病机制不明的炎症性多系统疾病,多认为与感染、遗传和免疫异常有关,但这并不能完全解释该病[1-2]。近年观点认为,AOSD属于“自身炎症反应综合征”,与自身炎症反应综合征存在类似发病机制可能[1, 3]。自身炎症反应综合征以发热为主要临床特征,可累及全身多个器官,白细胞、ESR、CRP、血清铁蛋白等指标增高,NSAID、激素治疗有效[4]。
本例患者临床表现以反复发热为主要症状,后逐渐累及血液系统(贫血、血小板降低)、结缔组织(膝关节肿痛)、胸腹部多个器官(肝、脾、心脏、肺脏)。患者的既往史、个人史及家族史无特殊。实验室检查提示白细胞、ESR、CRP、血清铁蛋白指标增高,亦未检测到病原体或异常滴度的自身抗体或T淋巴细胞比例失调,抗感染治疗好转后易复发或无效,经过激素治疗后症状及异常指标有回落。该患者症状、体征、实验室检查及有效药物与自身炎症反应综合征极为相似,故考虑AOSD与自身炎症反应综合征存在类似发病机制可能。
AOSD尚无统一诊断标准,迄今国际上也提出多套不同诊断标准,目前常用的主要有4种诊断标准[5]。王臻等[6]通过对4种诊断标准进行临床比较分析,结果显示日本Yamaguchi标准的灵敏度、准确度最高且具有良好特异度,推荐用于临床诊断。目前我国对AOSD诊断应用较多的也是日本Yamaguchi标准:①主要条件为发热(持续1周以上体温≥39℃)、关节痛(持续2周以上)、白细胞≥15×109/L(包括中性粒细胞≥0.80)、典型皮疹;②次要条件为咽痛、淋巴结和(或)脾大、肝功能异常、抗核抗体和RF阴性[7]。满足上述至少5项条件,其中至少含2项主要条件,并须排除感染性疾病、恶性肿瘤、其他风湿性疾病方可诊断。另外,国外研究提示血清铁蛋白升高对AOSD诊断有着重大意义,且升高程度与疾病活动性相关[8]。有研究提出符合日本Yamaguchi标准且血清铁蛋白≥1250 μg/L,对诊断AOSD具有更高的特异度[9]。
本例特征:①青年女性,慢性病程急性起病,以发热、关节肿痛、白细胞增多为主要表现,反复抗感染治疗无效;②反复发热1年余,体温≥39℃;③双膝关节肿痛1月余;④淋巴结和脾脏肿大;⑤肝脏肿大及肝功能异常;⑥抗核抗体和RF阴性,血清铁蛋白>1650 μg/L;⑦排除感染性疾病、恶性肿瘤、其他风湿性疾病;⑧后期累及心脏、肺及血液系统,出现休克、心力衰竭、ARDS、肺部感染、中-重度贫血及混合性失代偿期酸中毒多种严重并发症。该患者外院血常规结果及转至我院后多次查血常规未见白细胞≥15×109/L,考虑与患者资料不全及多次转诊反复用药尤其是使用激素有关,虽然患者无皮疹和咽痛,但根据现有诊断条件已符合日本Yamaguchi标准,可诊断为AOSD。
AOSD目前仍是一个排他性诊断,需要与临床表现为发热、皮疹、关节痛/关节炎相关的疾病相鉴别,常见的主要有感染性疾病、恶性肿瘤及风湿免疫性疾病三大类疾病。此外,AOSD还需注意与嗜血细胞综合征(HPS)/巨噬细胞活化综合征(MAS)鉴别,AOSD与HPS/MAS临床表现有很多重叠之处且AOSD本身又可继发HPS/MAS,给鉴别诊断带来一定困难。早期诊断可以减少疾病进一步加重的可能,根据HPS/MAS的诊断,AOSD继发MAS的早期特征在于MAS多伴全血细胞减少并常伴低纤维蛋白原血症、高甘油三酯血症[8, 10]。AOSD继发HPS/MAS的发病率高达12%,且可继发于AOSD的任何病程,因此AOSD患者在病程中出现全血细胞减少,且合并低纤维蛋白原血症、高甘油三酯血症时,须考虑到继发HPS/MAS的可能,及时完善相关检查,尽早明确诊断。
目前AOSD尚无统一的治疗方案,临床治疗药物有NSAID、激素、DMARD及生物制剂[1-2]。NSAID为AOSD初始治疗药物,用于病情轻微患者或与其他药物合用。激素是主要治疗药物,绝大多数患者需要使用激素,对单用NSAID无效或症状控制欠佳者可加用泼尼松0.5 ~ 1.0 mg/(kg·d),待症状控制、病情稳定后可递减剂量,然后以最小有效剂量维持;病情严重者如顽固性发热、重要脏器损害、严重血管炎、ESR极快、常规NSAID联合治疗半年以上效果差,常需用大剂量激素[泼尼松≥1.0 mg/(kg·d)],也可用甲泼尼龙冲击治疗,通常500 ~ 1000 mg/d,连用3 d,必要时1 ~ 3周后可重复使用,间隔期和冲击后继续口服泼尼松。DMARD是维持治疗药物,常首选甲氨蝶呤,在激素仍不能控制发热或激素减量即复发者或关节炎表现明显者,应尽早加用此类药物加强控制病情或在病情控制平稳后加用此类药物,可减少激素用量,减轻激素的不良反应。生物制剂是新型治疗药物,主要用于难治、复发、重症和高度活动患者。AOSD患者存在不受控制的活化T淋巴细胞和巨噬细胞产生的高水平促炎因子,TNF-α抑制剂(如英夫利昔单抗、依那西普、阿达木单抗)、IL-1(如阿那白滞素、康纳单抗、利纳西普)、IL-6抑制剂(托珠单抗)等生物制剂正是针对此机制发挥作用[11]。但是生物制剂费用昂贵,大多数患者难以负担。尽管目前对AOSD有不少药物临床研究报告,但多数为病例报告或小样本回顾性分析,本病的治疗仍然是经验性的。未来仍需要进一步研究该疾病的机制和临床治疗效果,需要前瞻性的临床对照试验结果验证。
本例重症AOSD患者起始单纯抗生素治疗无效,病情反复发作,激素治疗好转后减量过程中再次复发且病情加重,同时出现呼吸血液多个系统严重并发症,后经过大剂量激素连续治疗后症状缓解明显,受损脏器功能恢复良好,在激素逐渐减量过程中及时加用DMARD维持治疗,考虑患者有生育要求、药物安全性及经济原因,DMARD予选用羟氯喹及吗替麦考酚酯。最后患者好转出院,门诊随访1年余病情未再复发。
AOSD一般预后良好,但重症AOSD患者由于罕见且受合并症干扰,病情更加复杂化,给诊疗造成更大困难[2]。结合该例患者诊疗情况,现对AOSD重症患者的成功救治经验总结如下:①早期明确诊断、早期治疗是关键,这对于预防AOSD合并症的发生有着非常重大的意义;②早期发现和尽早积极治疗合并症是基础,这对于改善患者预后有着举足轻重的地位;③个体化治疗方案的选择是根本,需全面评估患者情况,综合分析治疗药物及其不良反应,最大程度降低治疗的不良反应;④本病易复发,应长期随访,定期复查相关指标,密切观察病情变化。
综上所述,对于不明原因的发热伴或不伴关节痛、皮疹、咽痛、肝脾及淋巴结肿大,炎性指标白细胞及中性粒细胞、血清铁蛋白升高而抗生素治疗无效者,需警惕AOSD可能,盡早完善相关检查,做好鉴别诊断,认真综合分析病情,做到早期诊断和早期治疗,避免合并症发生;对于发生合并症者需及早发现及治疗合并症,同时注意患者全方位管理,以提高重症患者生存率。
参 考 文 献
[1] 中华医学会风湿病学分会. 成人斯蒂尔病诊断及治疗指南. 中华风湿病学杂志,2010,14(7):487-489.
[2] Gerfaud-Valentin M, Jamilloux Y, Iwaz J, Sève P. Adult-onset Stills disease. Autoimmun Rev, 2014, 13(7):708-722.
[3] Lopalco G, Cantarini L, Vitale A, Iannone F, Anelli MG, Andreozzi L, Lapadula G, Galeazzi M, Rigante D. Interleukin-1 as a common denominator from autoinflammatory to autoimmune disorders: premises, perils, and perspectives. Mediators Inflamm, 2015, 2015:194864.
[4] 顾史洋, 姜林娣, 陈慧勇, 刘澎. 成人Still病发病机制、诊断标志物及鉴别诊断.内科理论与实践, 2015, 10(1):60-63.
[5] Kadavath S, Efthimiou P. Adult-onset Stills disease-pathogenesis, clinical manifestations, and new treatment options. Ann Med, 2015, 47(1):6-14.
[6] 王臻,姜林娣. 4种成人Still病诊断标准的临床验证. 复旦学报(医学版),2010,37(5):552-554.
[7] Yamaguchi M, Ohta A, Tsunematsu T, Kasukawa R, Mizus-hima Y, Kashiwagi H, Kashiwazaki S, Tanimoto K, Matsumoto Y, Ota T. Preliminary criteria for classification of adult Stills disease. J Rheumatol, 1992, 19(3):424-430.
[8] Gerfaud-Valentin M, Maucort-Boulch D, Hot A, Iwaz J, Ninet J, Durieu I, Broussolle C, Sève P. Adult-onset still disease: manifestations, treatment, outcome, and prognostic factors in 57 patients. Medicine(Baltimore), 2014, 93(2):91-99.
[9] Moore C Jr, Ormseth M, Fuchs H. Causes and significance of markedly elevated serum ferritin levels in an academic medical center. J Clin Rheumatol, 2013, 19(6):324-328.
[10] Gerfaud-Valentin M, Sève P, Hot A, Broussolle C, Jamilloux Y. Pathophysiology, subtypes, and treatments of adult-onset Stills disease: an update. Rev Med Interne, 2015, 36(5):319-327.
[11] 張浩浩,武圣超,张仲博,李沛.成人斯蒂尔病药物治疗的研究进展.中医临床研究,2018,10(25):145-148.
(收稿日期:2020-02-26)
(本文编辑:林燕薇)
