WNT10B在肺鳞癌组织中表达升高
2020-10-22顾艺荀徐兴祥闵凌峰陈彦亮王霄霖
路 琳,顾艺荀,徐兴祥,闵凌峰,陈彦亮,王霄霖,陈 勇*
(苏北人民医院 1.肿瘤科;3.呼吸与重症内科; 4.胸外科, 江苏 扬州 225001;2.大连医科大学, 辽宁 大连 116044)
肺癌是全世界范围内发病率和病死率最高的恶性肿瘤[1],肺癌组织学类型中肺鳞癌约占全部肺癌的30%。由于肺鳞癌的基因型更复杂、EGFR突变率低[2-3],靶向治疗并没有为肺鳞癌患者带来治疗疗效上的突破[4]。WNT信号传导途径是由配体蛋白WNT和膜蛋白受体结合激发的一组多下游通道的信号传导途径,对肿瘤细胞的增殖分化、侵袭和凋亡起着重要作用。目前已经发现多种WNT蛋白,本研究通过检测肺鳞癌患者肿瘤组织标本中WNT10B的表达状况,分析WNT10B与临床病理特征之间的关系,分析WNT10B的表达与肺鳞癌患者预后的联系。
1 材料与方法
1.1 材料
1.1.1 标本来源:肺鳞癌标本组织芯片(HLug-Squ150Sur-01)(上海芯超生物科技有限公司肺癌组织芯片库),包含75例肺鳞癌组织及与之配对的癌旁正常肺组织,组织芯片的每个点都经过病理诊断,手术时间为2004年7月至2007年11月,随访截至2012-07-31。所有患者术前均未接受放化疗或其他抗肿瘤治疗,所有临床病理资料及随访数据均来自上海芯超生物科技有限公司。患者中男70例,女5例。年龄36~78岁,中位年龄64岁,其中<70岁48例,≥70岁26例,无法判断1例。T1期17例,T2期39例,T3期12例,T4期6例,无法判断1例。有淋巴结转移30例,无转移40例,无法判断5例。无远处转移73例,有转移2例。组织学分级为Ⅰ级13例,Ⅱ级40例,Ⅲ级22例。根据UICC第7版TNM 分期标准,Ⅰ期27例,Ⅱ~Ⅳ期46例,无法分期2例。
1.1.2 试剂:小鼠抗人WNT10B 单克隆抗体(5A7)(Abcam公司),羊抗鼠HRP二抗及二氨基联苯胺(DAB)试剂盒(北京中杉金桥生物技术有限公司)。
1.2 免疫组化染色检测蛋白表达
采用二步法进行免疫组化染色,严格按照试剂操作说明进行,组织芯片先经脱蜡水化,经乙二胺四乙酸(EDTA)抗原修复液修复,一抗孵育(WNT10B鼠抗人单克隆抗体,1∶5 000稀释),4 ℃过夜,加羊抗鼠HRP二抗,37 ℃孵育1 h, DAB显色,苏木精复染,梯度乙醇脱水后封片。WNT10B蛋白阳性染色为细胞质呈黄色至棕黄色。在双盲情况下,由两名病理科医师对每个标本进行染色结果判断及评分:细胞质内出现淡黄色至棕褐色颗粒状物视为阳性,未出现视为阴性。阳性染色强度计分:无阳性染色,弱阳性(+);黄褐色,阳性(++);深棕褐色,强阳性(+++)。阴性及弱阳性表达纳入低表达组;阳性及强阳性表达纳入高表达组。
1.3 统计学分析
采用SPSS 13.0统计软件进行相关统计分析。计数资料的比较采用χ2检验。Kaplan-Meier 生存分析和log-rank检验以及Cox比例风险模型分析WNT10B蛋白表达与肺鳞癌预后的相关性。
2 结果
2.1 WNT10B在肺鳞癌组织中的表达
整个组织芯片有5例癌组织脱片无法评价,癌旁有1例组织脱片无法评价,WNT10B主要表达于肺鳞癌细胞质中,WNT10B在癌旁正常肺组织中低表达(图1,2)。WNT10B在肺鳞癌组织的表达明显高于癌旁正常肺组织(P<0.05)(表1)。

表1 肺鳞癌与癌旁组织中WNT10B蛋白的表达Table 1 Expression of WNT10B protein in lung squamous cell carcinoma and adjacent tissues
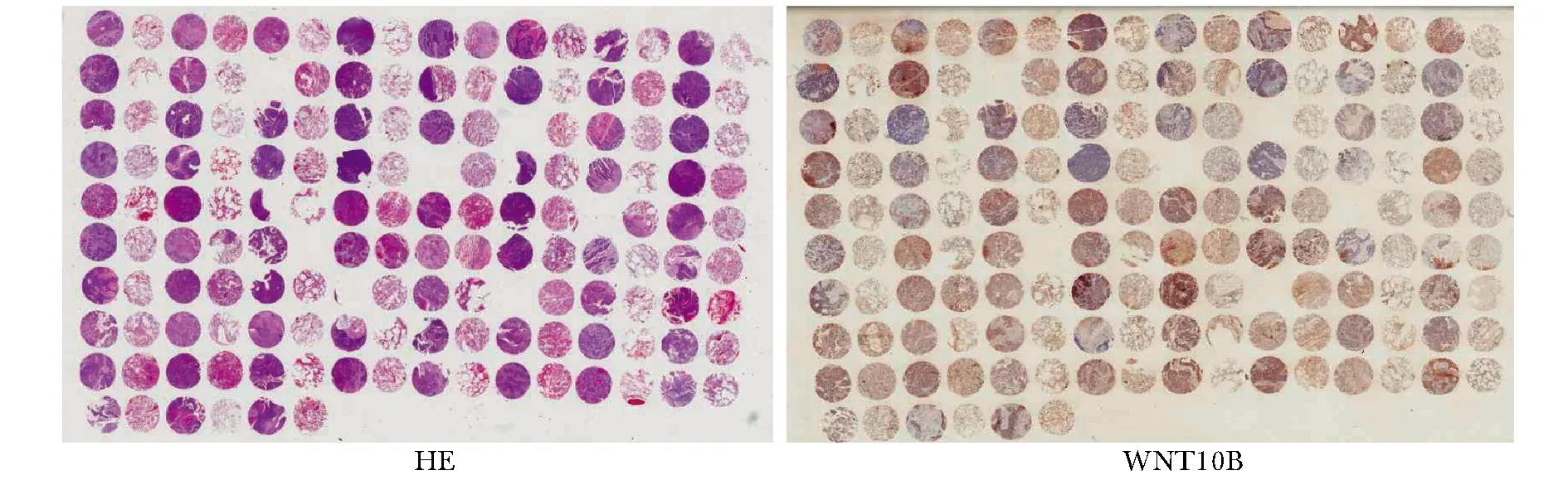
图1 肺鳞癌组织芯片的HE及WNT10B免疫组化染色结果Fig 1 HE staining and WNT10B immunohistochemical staining of lung squamous cell carcinoma tissue chips

from top to bottom were 0,+,++,+++图2 肺鳞癌及癌旁正常组织中WNT10B的表达Fig 2 Expression of WNT10B in adjacent normal tissues and lung squamous cell carcinoma (×200)
2.2 WNT10B表达与肺鳞癌患者临床病理特征关系
T3~T4期肿瘤的WNT10B表达显著高于T1~T2期肿瘤 (P<0.05);WNT10B的表达与肿瘤组织的分化程度显著相关,分化越差,WNT10B表达越高 (P<0.05)(表2)。

表2 WNT10B表达与肺鳞癌患者临床病理特征之间的关系Table 2 Relationship between WNT10B expression and clinicopathological characteristics of patients with lung squamous cell carcinoma
2.3 WNT10B表达与肺鳞癌患者预后之间的关系
癌组织中WNT10B低表达者预后显著优于WNT10B 高表达者(P<0.05)(图3)。性别、淋巴结转移和WNT10B的表达是肺鳞癌的独立预后影响因素(表3)。
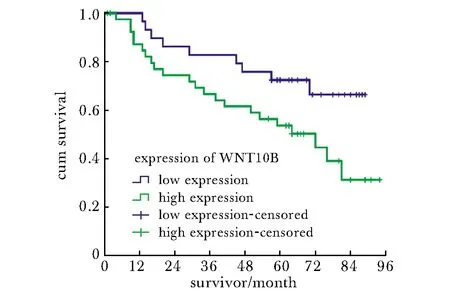
图3 不同表达WNT10B水平肺鳞癌患者的生存曲线Table 3 Survival curves of patients with lung squamous cell carcinoma with different expression of WNT10B
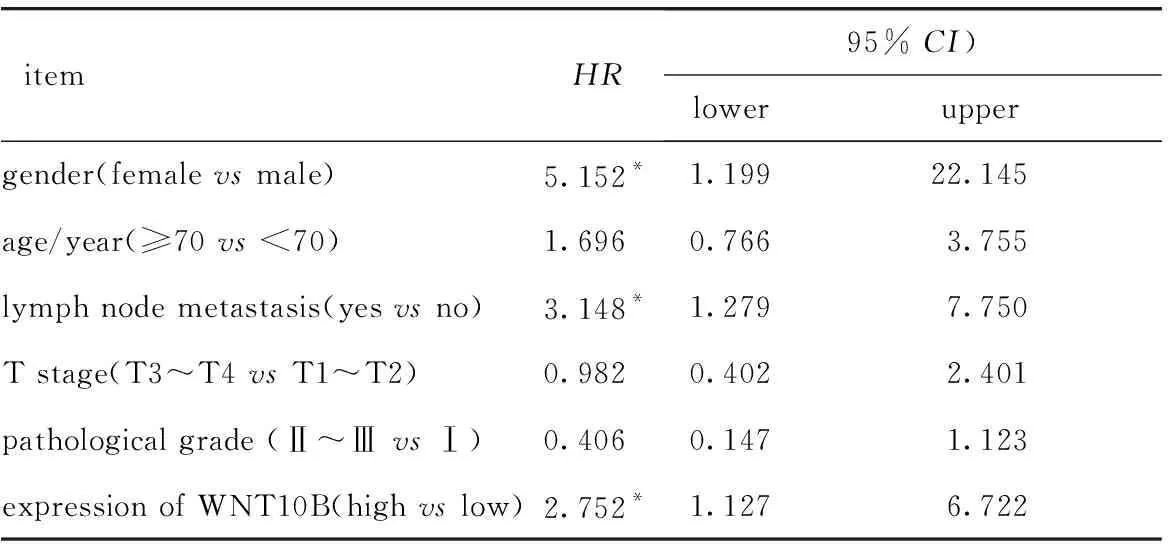
表3 Cox比例风险模型分析结肺鳞癌预后相关因素Table 3 Cox proportional hazard model analyzes prognostic factors of lung squamous cell carcinoma
3 讨论
WNT/β-catenin信号通路在生物体的发育中起重要作用[5],而异常激活与肿瘤的发生发展紧密相关[6]。WNT家族至少包括19种WNT蛋白,其中WNT10B在多种肿瘤的发生发展过程中发挥着重要作用[7-11]。在胃癌中,抑制细胞WNT10B的表达导致了胃癌细胞的增殖侵袭能力下降[7]。在胰腺癌中,降低细胞WNT10B的表达能够抑制胰腺癌细胞BxPC-3的侵袭和转移[8]。在结直肠癌组织中WNT10B低表达,WNT10B低表达患者的预后优于WNT10B高表达患者[11]。在子宫内膜癌中,癌组织WNT10B的表达较正常组织高,但是随着组织学分化越来越差,WNT10B的阳性表达率逐渐降低,并且WNT10B高表达组患者的预后好于低表达组[12]。本研究运用肺鳞癌组织芯片分析 WNT10B在肺鳞癌组织和癌旁组织的表达情况,结果表明WNT10B在肺鳞癌组织中高表达,而在癌旁组织中低表达,这一结果与既往研究结果一致[7-8]。通过临床资料分析发现,WNT10B高表达者T分期越晚,分化程度越差。既往研究显示WNT10B还参与肿瘤的淋巴结转移[7, 11],但本研究未发现WNT10B的表达与淋巴结转移有关,可能与病例数少以及部分数据缺失有关。通过随访观察,发现WNT10B表达和性别均是独立的预后影响因素,但由于本组患者中仅有5例女性患者,所有本研究有关性别的结果还需要大样本数据的进一步的验证。本研究缺少肺部非肿瘤疾病的标本,同时未进行半定量分析,这些将会继续予以改进。
综上所述, WNT10B在肺鳞癌组织中表达增高,并与临床病理因素及预后密切相关,WNT10B有望成为肺鳞癌的一个新的肿瘤标志物和预后指标。同时,WNT10B在肺鳞癌中发生发展的具体机制还有待进一步研究。
