腹腔穿刺引流对早期重症急性胰腺炎大鼠肝脏TLR4表达的影响
2020-10-22陈振宇黄启林孙红玉刘立业
陈振宇,黄启林,孙红玉,刘立业,文 艺
(西部战区总医院 全军普通外科中心, 四川 成都 610083)
重症急性胰腺炎(severe acute pancreatitis, SAP)是以胰腺及胰周组织广泛坏死为主要特征,病情变化十分迅速的腹部急病,而早期出现的致命性全身炎性反应所造成的多器官功能障碍是患者死亡的主要病理基础[1]。其中,胰腺炎相关的肝损伤(pancreatitis-associated liver injury, PALI)是SAP早期病程中最常见的胰外器官损伤,而继发的肝功能损害甚至失代偿是影响患者预后导致病死率增高的主要原因之一[2]。已证实,早期腹腔穿刺引流(abdominal paracentesis drainage, APD)是治疗SAP及其并发症的有效方法,前期的系列研究表明APD能明显降低SAP的重症化倾向,减轻全身炎性反应程度,对重要脏器起到保护作用,显著改善患者预后,然而其具体的保护机制仍亟待进一步研究[3]。研究发现,Toll样受体4(Toll-like receptor 4, TLR4)及其下游信号通路的激活会造成炎性反应的级联放大效应,是PALI发生的重要机制。本研究拟采用逆行胰胆管注射牛磺胆酸钠的方法建立SAP大鼠模型,观察早期实施APD对肝脏TLR4表达的影响,并对其可能机制和意义进行初步探索。
1 材料与方法
1.1 实验动物和试剂
1.1.1 实验动物:SPF级8~9周龄雄性SD大鼠30只,体质量190~210g[成都达硕动物科技有限公司提供,许可证号:SCXK(川)2004]。
1.1.2 试剂及试剂盒:90%纯度牛磺胆酸钠(Sigma-Aldrich公司);TNF-α、IL-1β和HMGB1酶联免疫吸附检测试剂盒(上海江莱生物科技有限公司);一步法实时定量荧光PCR试剂盒(TaKaRa公司);Trizol、全蛋白提取试剂盒和BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司);兔抗大鼠TLR4多克隆抗体(GeneTex公司);兔抗大鼠NF κB p65和p-p65单克隆抗体(Abcam公司);小鼠抗大鼠GAPDH单克隆抗体、山羊抗兔和抗小鼠二抗(Proteintech公司)。
1.2 方法
1.2.1 动物的分组和处理:将SD大鼠随机分为假手术(sham)组、SAP组(用微量输液泵向胆胰管输入5%牛磺胆酸钠溶液,剂量为0.1 mL/100 g,输注速率为12 mL/h,压力维持时间10 min,后腹腔注射少量抗生素关腹)和SAP+APD组(在成功制备SAP后,于右下腹接入引流管并固定于腹壁,外套金属弹簧圈,引流管外接负压吸引球,使用大鼠固定装置限制其活动),每组10只,24 h后取材检测。
1.2.2 大鼠血清消化酶及肝功能相关指标的检测:全自动生化分析仪检测大鼠血清淀粉酶、脂肪酶、胆汁酸、总胆红素、丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)。
1.2.3 大鼠血清炎性因子的检测:ELISA检测大鼠TNF-α、IL-1β和HMGB1的水平,严格按照说明书操作,最后用酶标仪测定各孔450 nm处的吸光度值。
1.2.4 大鼠胰腺及肝脏组织病理改变的检测:苏木精/伊红染色观察肝脏和胰腺的病理学改变,胰腺病理评分参照参考文献[4],肝脏病理评分的方法参照参考文献[5]。
1.2.5 实时荧光定量PCR检测肝脏组织Toll样受体4(TLR4)mRNA表达: Trizol法分离和纯化RNA,严格按照说明书的步骤操作。用分光光度仪检测总RNA 的含量和纯度,A260/A280比值在1.8~2.1的RNA 样本符合实验要求。后按照一步法RT-qPCR 试剂要求配制25 μL的反应体系进行目标序列扩增,最后用Bio-Rad CFX软件分析TLR4的mRNA的水平变化。各引物委托上海生物工程有限公司合成(表1)。

表1 PCR引物序列及反应条件Table 1 Sequences and conditions of primers in used in PCR
1.2.6 Western blot检测肝脏组织TLR4、p65蛋白表达和p65磷酸化水平:组织匀浆离心后取上清,BCA法检测其蛋白浓度,严格按照说明书操作,后与蛋白上样缓冲液按1∶4比例混匀后煮沸变性。配置SDS-PAGE胶,每个样本取50 μg总蛋白,电泳分离蛋白后转移至PVDF纤维膜上,室温封闭1 h,后分别加入兔抗TLR4多克隆抗体(1∶500)、兔抗p65单克隆抗体(1∶2 000)、兔抗p-p65单克隆抗体(1∶1 000),4 ℃杂交过夜。次日,洗膜后室温孵育二抗(1∶5 000)1 h,再次洗膜后滴加ECL化学发光液,应用UVP BioSpectrum 410 成像系统曝光并分析目标条带吸光度值。
1.3 统计学分析
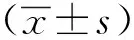
2 结果
2.1 各组大鼠胰腺组织HE染色和血清淀粉酶、脂肪酶检测结果
与sham组相比,SAP组胰腺组织水肿,腺小叶结构紊乱,出现大片边界不清的溶解坏死灶,炎性细胞浸润明显,病理评分明显升高(P<0.05);SAP+APD组胰腺病理改变较SAP组明显减轻,胰腺小叶大体结构清晰,仅出现散在的点状坏死灶,病理评分显著降低(P<0.05)。同时,SAP组大鼠血清淀粉酶和脂肪酶活性较sham组明显升高,而SAP+APD组上述指标较SAP组明显降低(P<0.05)(图1,表2)。

Arrows show necrotic pancreatic tissue图1 各组大鼠胰腺组织HE染色Fig 1 Pancreatic tissue of rats in each group by HE staining

表2 APD对胰腺病理评分、血清淀粉酶和脂肪酶活性的影响Table 2 Effect of APD on pancreatic pathological score, serum amylase and lipase n=6)
2.2 各组大鼠血清炎性介质的检测结果
SAP大鼠血清炎性介质TNF-α、IL-1β和HMGB1水平较sham组明显升高(P<0.05)。APD治疗后,SAP大鼠上述指标的血清水平明显降低(P<0.05)(表3)。

表3 APD对血清TNF-α、IL-1β和HMGB1水平的影响Table 3 Effect of APD on serum levels of TNF-α, IL-1β
2.3 各组大鼠肝脏HE染色及肝功能指标的检测结果
与sham组相比,SAP大鼠肝脏组织肿胀明显,肝窦间隙变窄,部分区域可见肝细胞排列紊乱,细胞边界不清,胞质内出现空泡,胞核固缩,病理评分明显升高(P<0.05)。肝功能指标如血清AST、ALT、总胆红素和胆汁酸水平也明显升高(P<0.05)。APD治疗后,SAP大鼠肝脏病理损伤明显减轻,病理评分和血清肝功能指标的水平均显著降低(P<0.05)(图2,表4)。

Arrows show hepatocytes with lightly stained cytoplasm图2 各组大鼠肝脏组织HE染色Fig 2 Liver tissue of rats in each group by HE staining

表4 APD血清肝功能相关指标的影响Table 4 Effect of APD on serum indexes related to liver n=6)
2.4 各组大鼠肝脏TLR4 mRNA和蛋白表达的检测结果
与sham组相比,SAP组大鼠肝脏组织TLR4 的mRNA和蛋白表达均明显升高(P<0.05)。而SAP+APD组大鼠肝脏组织TLR4的表达较SAP组明显降低(P<0.05)(图3)。

A.mRNA expression of TLR4 was detected using RT-qPCR; B.protein expression of TLR4 indicated by Western blot; C.densitometry analysis of TLR4; *P<0.05 compared with sham group;#P<0.05 compared with SAP group图3 RT-qPCR检测肝脏组织TLR4 mRNA的表达,Western blot 检测其蛋白表达Fig 3 Expression of TLR4 mRNA in liver tissues was measured by RT-qPCR, the protein expression was detected
2.5 各组大鼠肝脏p65、TNF-α和IL-1β的检测结果
SAP大鼠肝脏组织p65的蛋白表达和磷酸化水平较sham组明显升高,同时TNF-α和IL-1β的表达也显著升高(P<0.05)。而APD治疗后能显著降低SAP大鼠肝脏p65的蛋白表达和磷酸化水平,以及TNF-α和IL-1β的表达(P<0.05)(图4,表5)。

A.protein expression and phosphorylation levels of p65 indicated by Western blot assay; B.analysis of densitometry ratio between p65 and p-p65; *P<0.05 compared with sham group; #P<0.05 compared with SAP group图4 Western blot 检测肝脏组织p65蛋白表达和磷酸化水平Fig 4 Expression and phosphorylation levels of p65 protein in liver tissues were detected by Western blot

表5 APD对肝脏组织TNF-α、IL-1β表达的影响Table 5 Effect of APD on TNF-α and IL-1β expression
3 讨论
据报道,超过80%的重症急性胰腺炎(severe acute pancreatitis, SAP)患者可出现短时间或持续的肝功能异常,而胰腺炎相关肝损伤(pancreatitis-associated liver injury, PALI)的发生与SAP早期炎性反应失控密切相关[6]。因此,及时有效的降低全身炎性介质水平,有望减轻PALI的严重程度。
在SAP早期,腹腔内可出现程度不等的胰腺炎相关性腹水(pancreatitis-associated ascitic fluid, PAAF),其在SAP重症化中的作用已逐渐被人们所认识[7]。然而目前国内外关于急性胰腺炎的治疗指南均未对PAAF提出具体的处理意见,针对此,前期的研究表明通过腹腔穿刺引流(abdominal paracentesis drainage, APD)及时去除PAAF是SAP治疗中的重要环节[3]。已证实,APD能明显减轻全身炎性反应程度,发挥重要脏器的保护作用(有效性);其次,APD并不会增加患者腹腔感染的发生率(安全性)[8]。本研究中,APD能明显减轻SAP大鼠胰腺组织的坏死程度,降低循环中多种炎性介质的水平。而伴随炎性反应程度的减轻,治疗组大鼠肝脏的病理损伤有明显改善。与之对应,反映肝功能的血清指标如AST、ALT、总胆红素和胆汁酸水平在治疗组也明显降低,表明APD具有显著的肝功能保护作用。
Toll样受体4(Toll-like receptor 4, TLR4)是模式识别受体家族成员之一,在诱导机体炎性反应中发挥着重要作用[9]。TLR4的激活不仅参与了SAP炎性反应的级联放大,在PALI中同样扮演着重要角色[10]。TLR4的表达在SAP大鼠肝脏中明显升高[11],而敲除TLR4后能明显抑制下游NF-κB炎性信号通路的激活,减轻PALI的程度[12]。以上表明TLR4及其下游信号通路的激活是PALI发生的重要机制。本研究中,治疗组大鼠肝脏TLR4/NF-κB信号通路重要蛋白以及TNF-α、IL-1β的表达均显著低于SAP组,表明APD能通过抑制TLR4/NF-κB轴的激活减少促炎细胞因子的合成和释放,发挥肝脏保护作用。而TLR4信号通路的激活需要与其特异性的配体结合,其中高迁移率族蛋白B1(high mobility group box-1 protein, HMGB1)是TLR4最重要的天然配体[13]。SAP时,HMGB1主要来源于腹腔,可通过腹膜重吸收等途径进入循环,与胰外器官功能障碍的发生密切相关[14]。本研究发现,通过实施APD能有效降低循环中的HMGB1水平,推测其可能与APD抑制肝脏TLR4的激活有关。然而两者是否有直接的效应关系,尚需进一步研究。
综上,早期实施APD引流出PAAF能显著减少SAP大鼠肝脏TLR4的表达,进而有效抑制下游NF-κB炎性信号通路的激活及促炎细胞因子的合成和释放,发挥肝功能保护作用。
