两种天然防腐剂对单增李斯特氏菌抑菌机制的研究
2020-10-22王双童张志毅李迎秋
王双童,张志毅,李迎秋*
(1.齐鲁工业大学(山东科学院),食品科学与工程学院,济南 250353;2.山东农业大学 食品科学与工程学院,山东 泰安 271018)
微生物污染一直是食品生产储存过程中所面临的重要问题,由致病菌污染引起的食品安全问题也与日俱增[1]。防腐剂作为具有抑制或杀灭腐败菌的添加剂,被广泛运用在食品加工行业。随着人们对安全、绿色食品的追求,化学防腐剂诸如山梨酸钾、苯甲酸钠等逐渐被天然防腐剂代替[2]。大豆球蛋白碱性抗菌肽(SBAP)是从大豆豆粕中提取的一种碱性阳离子多肽,已被证实具有广谱的抗菌活性,对哺乳动物细胞几乎不产生毒性[3,4]。乳酸链球菌素又称乳链菌肽(Nisin),是由乳酸链球菌(Lactococcuslactisssp.lactis)分泌的一种多肽抗菌素类物质,其对人体无毒害作用,可以被水解成氨基酸,目前已经作为天然食品防腐添加剂应用在多种食品的加工中[5]。
单核细胞增生李斯特氏菌被世界卫生组织定义为四大食源性病原菌之一[6],单增李斯特氏菌食源性疾病虽然仅占总体的0.1%,但所引起的疾病具有20%~30%的高致死率[7]。单增李斯特氏菌可以生长于大部分的食物如:肉、蛋、奶、蔬果等中,并且具有较强的耐冷性,在4 ℃的环境中仍可生长繁殖[8],造成严重的食品污染及安全问题。本实验对大豆球蛋白碱性抗菌肽和乳酸链球菌素对单增李斯特氏菌的抑菌作用进行了研究,了解两种防腐剂的作用机制,以期后续将两者进行复配使用,提高抗菌效果,降低单一使用量,更好应用在食品防腐中。
1 材料与方法
1.1 材料与试剂
大豆球蛋白碱性抗菌肽:由实验室富集所得;乳酸链球菌素:购于浙江银象生物工程有限公司;脑心浸液肉汤培养基(BHI培养基,用于李斯特氏菌培养)、李斯特氏菌ATCC 19115:齐鲁工业大学菌种保藏中心;其余试剂均为分析纯。
1.2 菌悬液的配制
将细菌接种于BHI琼脂斜面培养基,置于37 ℃下培养24 h;然后挑取细菌菌落接种于BHI液体培养基,在37 ℃条件下恒温振荡培养过夜,平板计数测定菌体浓度,将培养液稀释成菌体浓度为107CFU/mL的菌悬液。
1.3 抗菌剂的配制
大豆球蛋白碱性抗菌肽、乳酸链球菌素用pH 7的无菌磷酸盐缓冲液(PBS)配制成质量浓度为20 mg/mL的溶液,于4 ℃保存备用。
1.4 最小抑菌浓度(MIC)的测定
通过试管稀释法检测两种抗菌剂对单增李斯特氏菌的抗菌活力。取16根试管,分成两组并编号1~8,其中2~7号为实验组,在试管中加入BHI液体培养基和大豆球蛋白碱性多肽、乳酸链球菌素母液至两种抗菌剂的终浓度为0.1,0.2,0.3,0.4,0.5,0.6 mg/mL,1号管加无菌水代替抗菌剂作为阳性对照,8号管用液体培养基代替菌液作为阴性对照。移取单增李斯特氏菌菌液100 μL加入1~7号管中,于37 ℃振荡培养24 h,肉眼难以检测微生物生长的最低浓度即为最小抑菌浓度。
1.5 核酸及蛋白泄露分析
单增李斯特氏菌培养至对数期,分别取30 mL菌液至5个离心管中,离心收集菌体,并用无菌生理盐水洗涤2次,加入抗菌剂及无菌生理盐水至30 mL,使得大豆球蛋白碱性抗菌肽的浓度为0,0.2,0.4 mg/mL;乳酸链球菌素的浓度为0,0.5,1 mg/mL,随后在37 ℃培养,分别在0.5,1,1.5,2,3,4 h时取3 mL菌液,离心后检测上清液在260,280 nm处的吸光度。
1.6 扫描电镜分析
单增李斯特氏菌培养至对数期,取8 mL菌液,加入抗菌剂及无菌生理盐水补足至10 mL,使大豆球蛋白碱性抗菌肽和乳酸链球菌素的浓度为2倍最小抑菌浓度,37 ℃培养4 h。用无菌生理盐水在6500 r/min下离心洗涤3次,所得到的菌体沉淀用2.5%的戊二醛溶液固定过夜。随后用酒精(30%、50%、70%、80%、90%、100%)进行梯度脱水。吸取适量脱水后的菌体,进行真空干燥,最后通过扫描电镜观察。
2 实验结果
2.1 大豆球蛋白碱性抗菌肽和乳酸链球菌素对单增李斯特氏菌的最小抑菌浓度
大豆球蛋白碱性抗菌肽和乳酸链球菌素对单增李斯特氏菌的最小抑菌浓度见表1,单增李斯特氏菌的生长情况见图1。

表1 大豆球蛋白碱性抗菌肽和乳酸链球菌素对单增李斯特氏菌的最小抑菌浓度Table 1 The minimal inhibitory concentration (MIC) of soy globulin basic antimicrobial peptide and nisin against Listeria monocytogenes
由表1和图1可知,大豆球蛋白碱性抗菌肽对单增李斯特氏菌的最小抑菌浓度为0.2 mg/mL,乳酸链球菌素对单增李斯特氏菌的最小抑菌浓度为0.5 mg/mL。两种抗菌剂均对单增李斯特氏菌生长表现出抑制作用,而大豆球蛋白碱性抗菌肽的最小抑菌浓度小于乳酸链球菌素的最小抑菌浓度,表明大豆球蛋白碱性抗菌肽对单增李斯特氏菌的抑制作用强于乳酸链球菌素。
2.2 核酸蛋白泄露
单增李斯特氏菌核酸蛋白泄露结果见图2。
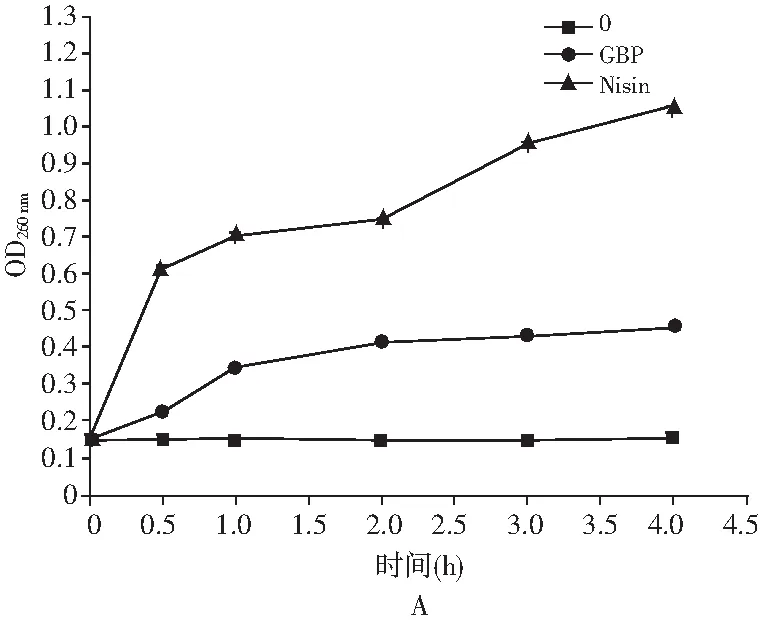

图2 大豆球蛋白碱性抗菌肽/乳酸链球菌素处理后单增李斯特氏菌核酸、蛋白泄露情况Fig.2 The leakage situations of nucleic acids and proteins of Listeria monocytogenes after soy globulin basic antimicrobial peptide/nisin treatment
核酸和蛋白在波长为260 nm和280 nm处有最大吸收峰,通过检测经两种抗菌剂处理后菌液上清液在两个波长处的吸光值可以判定单增李斯特氏菌的核酸和蛋白泄露情况。实验结果表明,两种抑菌剂的处理都引起了OD值的上升,但大豆球蛋白碱性抗菌肽处理组在2 h后的OD值趋于稳定,而乳酸链球菌素处理组的OD值则随着处理时间的积累不断增强,且在相同处理时长下,乳酸链球菌素处理组的OD值高于大豆球蛋白碱性抗菌肽处理组。实验结果表明,两种抗菌剂均对单增李斯特氏菌的细胞膜造成破坏,致使胞内核酸和蛋白的泄露,同时乳酸链球菌素对细胞膜的破坏能力强于大豆球蛋白碱性抗菌肽。
2.3 扫描电镜结果
扫描电镜实验结果见图3。

图3 单增李斯特氏菌扫描电镜实验结果Fig.3 The SEM results of Listeria monocytogenes
由未处理组的图像可以看出,单增李斯特氏菌是一种杆菌,菌体表面光滑且大小均匀,具有完整的形态。大豆球蛋白碱性抗菌肽处理的单增李斯特氏菌表面变得粗糙,且菌体发生轻微的皱缩,但细胞依旧可以维持一定的形态。而经过乳酸链球菌素处理的细胞,则可以看出严重的破坏现象,细胞黏连,无法维持正常的形态。
3 结论
实验结果表明,大豆球蛋白碱性抗菌肽对单增李斯特氏菌的最小抑菌浓度为0.2 mg/mL,乳酸链球菌素对单增李斯特氏菌的最小抑菌浓度为0.5 mg/mL。大豆球蛋白碱性抗菌肽和乳酸链球菌素均对单增李斯特氏菌具有良好的抑制作用,但大豆球蛋白碱性抗菌肽的抑制效果更强。此外,两种抗菌剂处理后都造成了细菌胞内核酸和蛋白的泄露,由乳酸链球菌素引起的核酸和蛋白泄露比大豆球蛋白碱性抗菌肽处理导致的更加严重。乳酸链球菌素可能对膜造成了更多的破坏。而扫描电镜实验结果进一步证实了这一结果,可以看出大豆球蛋白碱性抗菌肽处理仅造成了单增李斯特氏菌的皱缩,细胞仍具有较为完整的形态,表明大豆球蛋白碱性抗菌肽并没有对单增李斯特氏菌胞膜产生较强的破坏能力;而乳酸链球菌素处理导致细胞坍缩且出现黏连,细胞破坏严重,且无完整形态,表明乳酸链球菌素处理对细胞的胞膜造成了严重的破坏。
乳酸链球菌素对单增李斯特氏菌的抑制作用更多是通过对其胞膜的破坏。而大豆球蛋白碱性抗菌肽在低于乳酸链球菌素的浓度下就可以抑制单增李斯特氏菌,且并未对细胞形态产生较大破坏,表明大豆球蛋白碱性抗菌肽存在其他的作用方式,可能对单增李斯特氏菌胞内物质造成影响。先前的研究表明,Nisin与纳他霉素复配能提高对食源菌的抑制能力[9]。而Nisin对单增李斯特氏菌胞膜的破坏可能有助于大豆球蛋白碱性抗菌肽对胞内物质的作用,两种防腐剂具有在食品中复配使用的可能性,提高抗菌能力的同时降低了成本。
