托珠单抗相关肝损伤的文献分析
2020-10-21郝梦琳闫峻峰
郝梦琳,闫峻峰,2,边 原
0 引言
托珠单抗(Tocilizumab,缩写:TCZ,商品名:Roactemra)是一种中和人源化单克隆抗体,对抗人白细胞介素-6(IL-6)受体,能结合可溶性IL-6R和跨膜IL-6R,抑制IL-6与受体的结合,从而阻断IL-6通过这2个受体的信号传导。2008年开始,TCZ分别在日本、美国和欧洲相继上市,2013年3月在中国获批上市,现用于治疗对改善病情的抗风湿药物(DMARDs)治疗应答不足的中到重度活动性类风湿关节炎的成年患者,常规与甲氨蝶呤(MTX)或其他DMARDs联用。相较于现有的DMARDs,TCZ具有用药间隔时间长,病情缓解显著等优点;与其治疗相关的最常见的不良反应事件是细菌和病毒感染、胃肠道症状、高胆固醇血症、中性粒细胞减少以及输液反应[1],肝脏损害方面仅有能引起肝酶升高的报道。然而,最近英国药品和健康产品管理局(Medicines and Healthcare products Regulatory Agency,MHRA)发出警告:TCZ可能存在导致罕见的严重肝损伤风险,甚至出现需要进行移植的病例[2]。其对肝脏的影响可能与阻断IL-6有关,因为IL-6-TAK-STAT3途径是肝再生的重要信号,IL-6通过与受体结合,激活JAK/STAT3通路以促进肝细胞增殖[3-4]。相反,抑制IL-6与其受体的结合,阻断JAK/STAT3信号通路,通过促进肝细胞凋亡和抑制肝再生来诱导严重的肝损伤[5]。这一警告的发出,立即引起了广泛的关注。本文通过检索国内外数据库,对TCZ使用后肝脏相关的临床试验结果及个案报道进行回顾性分析,探讨其一般发生规律及特点,为更合理的临床用药提供参考。
1 资料与方法
1.1 资料来源 以托珠单抗(Tocilizumab)、肝损伤(Hepatic injury)、肝炎(Hepatitis)等为关键词,检索中文数据库中国学术期刊全文数据库(China National Knowledge Infrastructure,CNKI)、万方数据库、维普中文科技期刊数据库(VIP),外文数据库PubMed、Web of Science、Science Direct、Scifinder等,收集关于TCZ使用后肝脏相关临床试验和案例报道,并逐篇查阅原文。纳入标准:①年龄≥18岁;②使用TCZ进行单药或联合治疗;③满足预先设定的治疗结局,例如好转、肝炎、肝功能衰竭、肝脏相关死亡等。排除综述、Meta分析,重复、病例信息不全的临床报道。从每项研究中提取每个关键和重要结果,将确属于TCZ的肝脏相关临床试验和病例报道纳入本文。
1.2 统计方法 按照设定的表格,采用Excel统计临床试验和案例报道的文献年份、研究者信息、受试者总人数、合并基础疾病及与用药情况、出现有关肝脏用药结局等有效信息,并通过SAS 9.4统计软件对提取出的信息进行统计和描述性分析。
2 结果
通过检索CNKI、万方、VIP、PubMed、Web of Science、Science Direct、Scifinder等数据库,共获得195篇文献。严格按照纳排标准筛选后,纳入TCZ相关肝损伤临床试验和病例报道的文献共20篇,均为英文文献,其中临床试验3篇,病例报道17篇。
2.1 临床试验 尽管对直接治疗肝炎病毒的药物研究已经取得了进展,但这种传染病仍然在世界范围内十分流行,并且在伴有类风湿性关节炎(RA)的情况下,由于疾病的自身免疫性,给疾病的治疗带来了不小的挑战。研究表明,使用抗肿瘤坏死因子(TNF)-α治疗RA同时,合并肝炎病毒感染患者的药物似乎是安全的[6]。然而,用利妥昔单抗进行B细胞靶向治疗可能导致肝炎病毒血症,导致体外微RNA的下降[7]。因此,由于对RA患者的作用机制不同,其药物主要分为生物改性抗风湿性药物(bDMARDs)和靶向合成抗风湿性药物(tsMARDs),不同的药物对肝炎病毒的复制或再激活风险的反应可能不同。TCZ作为非TNF-α类的IL-6抑制剂,同属于tsMARDs,其关于肝炎病毒的复制以及再激活的影响有以下临床研究。见表1。

表1 TCZ相关肝炎病毒的复制以及再激活影响的临床试验
纳入研究的3个临床试验中,一篇文献描述研究RA合并HCV分别使用了TCZ,阿巴西普[一种融合蛋白结合细胞毒性T淋巴细胞相关抗原4(CTLA-4)]以及托法替尼[一种Janus激酶(JAK)抑制剂]3种药物后是否引起丙型肝炎病毒的复制。其中8例使用TCZ后,AST、丙型肝炎病毒载量治疗前后变化相似。表明TCZ的使用并不会对患者体内的转氨酶和病毒水平产生影响。另外2篇均是研究TCZ在治疗RA患者过程中是否存在乙型肝炎病毒的再激发风险。结果显示:在接受TCZ治疗的RA中,伴有慢性HBV感染的患者存在HBV再激活的发生风险;未感染HBV的患者,也容易发生HBV病毒的激活;而已治愈的HBV感染患者则被证明是安全的。因此,临床使用TCZ治疗RA,对于已治愈的HBV感染人群来讲,由于其体内还存有抗-HBs抗体,故HBV病毒再激活的可能性较低;而未感染HBV的人群体内没有抗-HBs抗体、慢性HBV感染人群体内病毒载量本身偏高,故后两者易引发HBV病毒的再激活。
2.2 病例报道 根据收集已报道的有关TCZ使用后出现肝脏相关的病例报道,从患者的基本信息、合并基础疾病以及用药结局等方面全面了解TCZ使用后对肝脏的影响情况。
2.2.1 患者基本情况 ①性别与年龄:17篇病例报道中,共计患者17例,其中男5例(29.4%),女12例(70.6%),男女比例为0.42∶1。患者年龄18~71岁,平均年龄为(68.1±14.5)岁。②患者合并基础疾病:17例病例报道中,7例只患有RA,6例RA合并肝炎病毒感染,1例成人起病still疾病(AOSD),1例AOSD合并肝炎病毒感染,1例AOSD合并肝炎病毒感染及淀粉样蛋白A变性(AAA),1例系统性红斑狼疮(SLE)。见表2。
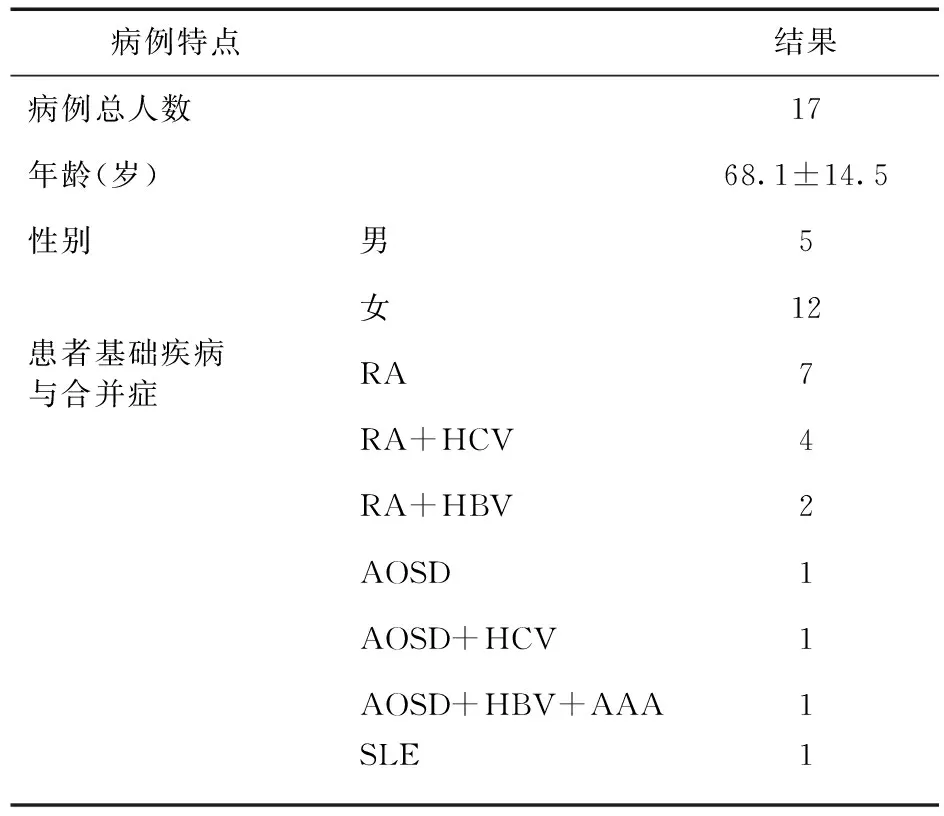
表2 患者基本情况与合并基础疾病(例)
2.2.2 用药情况 ①用药剂量及途径:17例病例中,9例患者用药剂量约为每4周1次,静脉输注8 mg/kg,1例每周162 mg,输注方式为皮下注射,1例每月400 mg静脉滴注,3例患者用量有所调整,2例未说明用药剂量,1例未提供用药情况。②合并用药:纳入的病例中,患者主要基础疾病及合并症为RA、肝炎、AOSD以及SLE(见表3)。临床使用TCZ时,合并用药有甲氨蝶呤、泼尼松龙、拉米夫定、恩替卡韦、环孢素A以改善病情。其中,说明书及指南推荐TCZ与甲氨蝶呤联合治疗相关的自身免疫性疾病;而波尼松龙作为糖皮质激素类药物也与环孢素A同样具有免疫抑制的作用;由于多个病例中患者合并有肝炎,故使用拉米夫定、恩替卡韦这些抗病毒药物。见表3。
2.2.3 用药结局 据报道,TCZ能在一定程度上缓解RA、AOSD等疾病的病情,但与TCZ治疗相关的不良反应事件也时常发生。通过对17例用药后肝脏相关结局的研究(见表4)可知,9例使用TCZ后基础疾病的病情显著缓解,转氨酶维持正常,血清病毒载量稳定,没有肝炎再激活现象。而剩余的8例则出现了不同程度的肝损伤,轻者转氨酶迅速升高,血清病毒载量升高(1例),重者则发生死亡(1例)。主要为病毒性相关肝炎或肝功能衰竭(4例),以及急性肝损伤(1例)和严重肝炎(1例)。
3 讨论
目前,TCZ主要应用于包括MTX在内的DMARDs无法控制的疾病活动时,使用剂量为4~8 mg/kg每4周,能显著缓解病情。可以与MTX或其地DMARDs联用,还能与环孢素A、糖皮质激素类药物合用增强免疫抑制作用。
然而,TCZ使用下肝功能损害的表现并不一致。有研究报道,尽管在开始使用TCZ后,患者病情显著缓解,血清氨基转移酶水平增加并达到峰值,但迅速恢复至正常范围内[23],且没有发生与治疗相关的其他不良事件,这表明TCZ在自身免疫性疾病患者中的使用是安全的。然而,Komura等[14]提出,任何生物制剂,包括TCZ,应主要被视为自身免疫性疾病患者的禁忌证,这是因为IL-6是多种免疫性疾病发病机制的关键体液介质,影响各种免疫细胞,包括T细胞和B细胞。因此,TCZ降低IL-6水平会损害对感染的免疫反应,从而产生免疫抑制状态。所以,根据以上研究结果,一旦使用TCZ,由于其会引起肝酶水平的改变,必须特别注意有关肝炎急性加重的实验室数据,包括肝功能指标:AST<40 U/L,ALT<40 U/L以及HBV血清标志物:HBsAg,抗-HBs,HBV抗原e(HBeAg)及其抗体(抗-HBe),抗HBV核心抗原抗体(抗-HBc)。以及有无出现任何的肝炎症状,如肝细胞局灶性出血性坏死、大泡性脂肪变性、窦固纤维化以及细胞浸润等[23]。
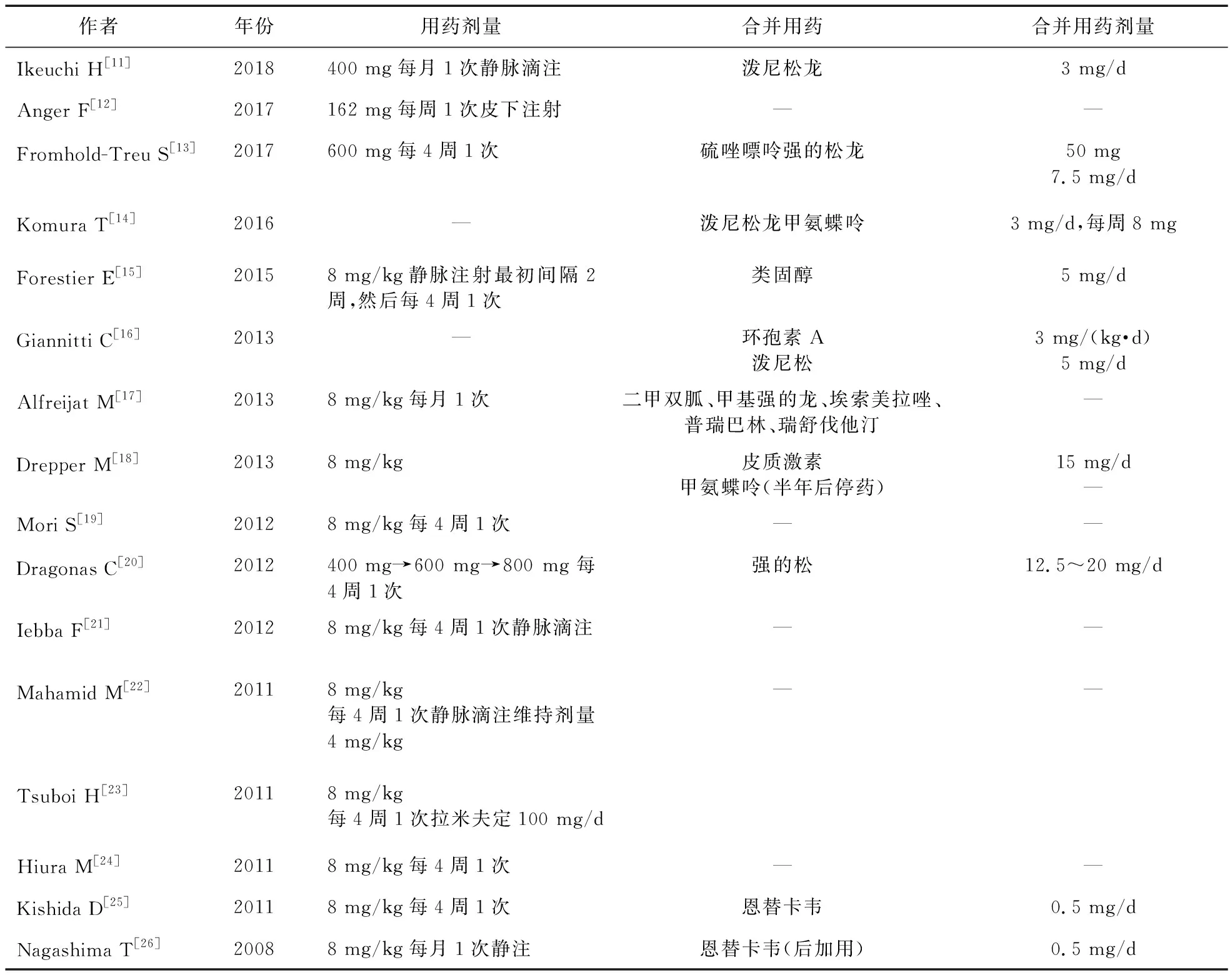
表3 TCZ使用剂量及其合并用药
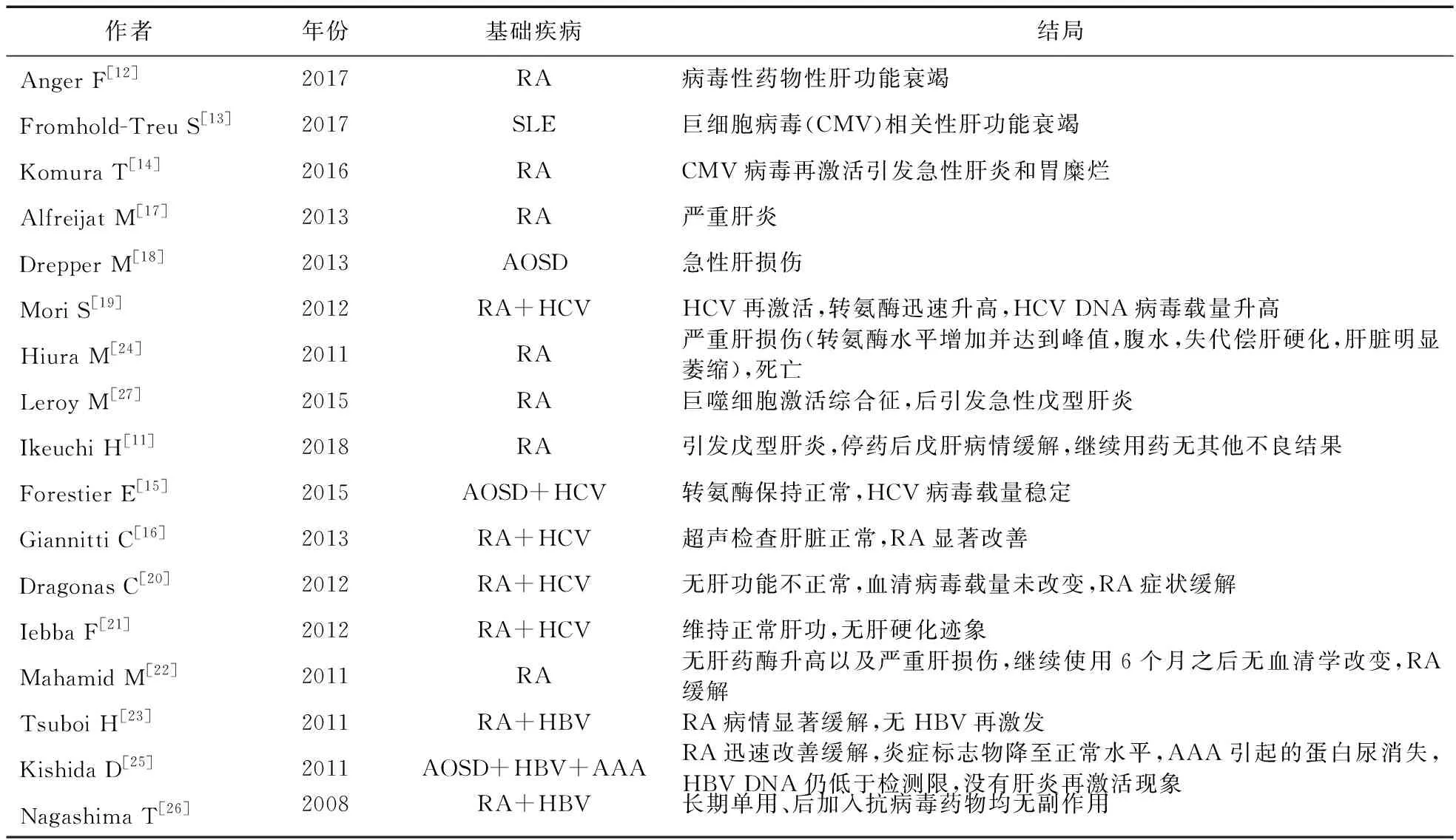
表4 托珠单抗的用药结局
由于细菌或病毒感染是其使用后最常见的不良反应,根据以上病例,可优先选择联合给予抗菌或抗病毒药物进行预防以稳定病情。值得注意的是,美国胃肠病学协会在2015年对抗病毒预防的推荐做出了新的改变:对能引起肝炎慢性感染的药物进行了分类:高危组:β细胞消耗剂(如利妥昔单抗和奥法木单抗)、蒽环类衍生物、皮质激素治疗4周;中危组:TNF-α抑制剂(依那西普,阿达木单抗,塞妥珠单抗,英夫利昔单抗)、其他细胞因子抑制剂和整合素抑制剂(阿巴西普,乌司奴单抗,那他珠单抗,维多珠单抗)、酪氨酸激酶抑制剂(伊马替尼,尼罗替尼)、蒽环类衍生物:阿霉素和表柔比星;低危组:传统的免疫抑制剂(硫唑嘌呤,6-巯基嘌呤,甲氨蝶呤)、关节内皮质类固醇、皮质激素治疗1周。
建议对患有慢性感染且使用高危或中等风险免疫抑制药物的患者进行抗病毒预防;但建议不要对接受免疫抑制药物治疗且HBV风险低的患者进行常规抗病毒预防[28-29]。对于DMARDs,利妥昔单抗是一种高风险药物,预计在>10%的病例中会导致病毒再激活;肿瘤坏死因子和阿巴西普都是中度风险的药物,预计会导致病毒再激活>1%但<10%的病例;MTX属于低风险组,预计在<1%的病例中导致病毒再激活。然而,由于缺乏有关其对病毒再激活影响的数据,其他DMARD(包括TCZ)仍然未分类。因此,应在TCZ治疗前筛查相关病毒感染,如果有慢性感染的患者,应考虑进行抗病毒预防[10]。
近期的研究表明,TCZ还可能诱导高胆红素血症,从而增加患者治疗期间不良事件的风险。其原因可能是因为尿苷二磷酸葡萄糖醛酸转移酶(UGT1A1)的遗传变异,导致胆红素升高[30]。同时,TCZ具有抑制UGT1A1介导的葡萄糖醛酸化的潜力,不仅可能抑制胆红素的代谢,而且还可能抑制药物的UGT1A1依赖性解毒的能力[31]。应紧密关注治疗期间高胆红素血症相关临床症状如黄疸的发生。
综上所述,随着TCZ在临床的应用越来越广泛,更多的不良反应也被报道出来。药物上市后的临床观察和案例报道为药物的不良反应积累了重要的数据,同时也为临床医生处理提供了参考。
