人参、枳椇子复合饮料加工工艺研究
2020-10-21文连奎
张 冰 ,文连奎 ,单 巍
(1.康美新开河(吉林)药业有限公司,通化143200;2.吉林农业大学,长春130118)
人参(Panax ginseng C.A.Mey)是五加科多年生草本植物人参的根,古代人参的雅称为地精、黄参、神草,被人们称为“百草之王”,是闻名中外的“东北三宝”之首,具有大补元气、复脉固脱、生津安神等功效[1]。人参含有的主要成分位为人参皂甙、多糖类、氨基酸、维生素、蛋白质、多肽、有机酸以及微量元素等。人参皂甙是人参的主要活性成分,具有增强人体抵抗能力,调节人体代谢活动以及大脑中枢神经等作用[2-3]。人参具有大补元气、调节人体代谢、中枢神经系统、强心、减缓疲劳等功效。人参作为我国传统中药,目前已经被列为新资源食品,人参食品必将成为我国人参产业新的增长点[4-8]。
枳椇子(H.dulcis)为鼠李科枳椇属植物的果实,又称拐枣,肉质果柄是其食药用部分,果柄呈凹字形,肉质膨大,熟透时呈红褐色,光滑,甜香可口。果实呈球形,含有三粒红褐色种子[9-10]。枳椇子果梗肥大呈扭曲状,肉质红褐色,具有沁人心脾的香味,果实含丰富的葡萄糖、蛋白质、维生素、苹果酸钙、矿物质及黄酮类化合物等活性物质,具有营养保健功能。枳椇子既是食品,也是药品。主要分布于我国陕西、江西、安徽、以及南方各省,枳椇子含有葡萄糖和苹果酸钾,经霜后甜,味道甘美,可生食或酿酒,果实入药,为清凉利尿药,并能解酒,是亟待开发的食品资源[11-16]。
本研究通过超声波提取技术的工艺参数,提取得人参、拐枣营养物质及有效成分,利用人参拐枣提取物,配制一种人参拐枣饮品,研究其配方及澄清稳定性,为开发人参拐枣产品提供理论依据。超声波在提取溶剂中产生的机械作用和空化效应不但可有效的打碎物料的细胞壁,使有效成分呈游离状态溶入溶剂中,并且可以加速提取溶剂分子的运动,使溶剂和物料中的有效成分快速接触融合。超声波提取以提取效率高、提取温度低、提取杂质少、提取时间短、成本低、适应性广,操作简单等特有的优势被研究者应用于各种动植物有效成分的提取试验,该技术是顶替传统提取工艺方法实现节能高效、低碳环保提取的新技术手段[17-22]。
1 材料与方法
1.1 材料与仪器
1.1.1 试验材料与试剂
1.1.1.1 试验材料
人参:产于吉林省集安市,为5年生,生晒人参符合标准:GB/T 19506-2009;枳椇子:购于安徽亳州 采用部分为肉质果柄干品;白砂糖:符合GB317.1白砂糖卫生标准要求;柠檬酸:符合GB/T 8269-2006柠檬酸卫生标准要求;水:符合生活应用水GB5749要求。
1.1.1.2 试验试剂
人参皂苷Re对照品:含量92.7%,中国药品生物制品检定研究院提供;乙醚、甲醇、正丁醇、浓硫酸(比重1.84~1.86)、无水乙醇、香草醛均为分析纯;8%香草醛乙醇液,称取香草醛0.8g,加无水乙醇10ml摇匀即得(临用前现配制);72%硫酸溶液:量取浓硫酸72%,缓缓注入适量水中,冷却至室温,加水稀释至100ml,摇匀备用。
1.1.2 试验仪器
超声波清洗机,SY-600济宁盛源超声电子有限公司;微型植物试样粉碎机,FZ102北京中兴伟业仪器有限公司;超纯水机FBZ1002-UP-P,青岛富勒姆科技有限公司;型高速离心机 LGIO一2.4A,北京瑞邦兴业科技有限公司;电子天平ME204 PL303,梅特勒-托利多(上海)有限公司;微型高速万能试样粉碎机FW80,北京市永光明医疗仪器厂;紫外分光光度计UV2300,北京格瑞恩科技有限公司;盐度计RHS-28,杭州亿大科技实业有限公司;立式压力蒸汽灭菌锅YXQ-LS-50SⅡ,诸城市金日鑫包装机械有限公司;灌装机GZSD-36苏州威世达电测有限公司;手持糖度计WYT-32,福建泉州化学仪器厂。
1.2 试验方法
1.2.1 工艺流程
1.2.1.1 人参提取工艺流程
将5年生生晒人参原料粉碎后,加入溶剂纯化水中,充分混合原料,在容器中搅拌混合一天左右,然后采用超声波辅助技术对浸提混合物进行处理,提取液过滤后得到人参皂苷营养液。
1.2.1.2 枳椇子提取工艺流程
将拐枣原料干燥烘干之后低温灭菌消毒,然后进行粉碎,之后加入纯化水充分混合原料,在工艺容器中搅拌混合两天左右,再采用超声波技术对浸提混合物进行处理,过滤除杂质就能得到拐枣多糖营养液。
1.2.1.3 复合饮料加工工艺流程
将人参提取液、枳椇子提取液按照合适的比例混合,添加适量的食用糖和酸进行调味,然后对复合饮品做澄清处理,稳定性测试和分析,最后对成品的口感质量进行评判反馈调配比例。
1.2.2 人参提取试验设计
生晒人参粉碎后浸提有效成分,采用纯化水为溶剂,超声波辅助提取。对浸提温度 (℃)、浸提时间(min)、料液比、超声波功率(W)4个因素分别进行单因素实验,采用紫外线分光光度法测人参提取液吸光度(即提取液人参总皂苷含量)比较得出最佳提取条件。
1.2.2.1 单因素试验设计
提取时间对吸光度值影响:精密称量4g生晒参粉5份,分别置5只锥形瓶中,浸提溶剂固液比为1∶25,即100ml纯化水,超声功率200W、浸提温度为80℃、浸提时间浸提时间分别为 20、40、60、80、100min,分别得5份提取液,将提取液用300目绢布滤过后静置冷却至室温,得5份提取液,提取液分别用纯化水定容至200ml容量瓶中,待用,分别测吸光度。
提取温度对吸光度值影响:精密称量4g生晒参粉5份,分别置5只锥形瓶中,浸提溶剂固液比为1∶25,即100ml纯化水,超声功率200W、浸提温度分别为50、60、70、80、90℃浸提时间浸提时间为 60min, 分别得5份提取液,将提取液用300目绢布滤过后静置冷却至室温,得5份提取液,提取液分别用纯化水定容至200ml容量瓶中,待用,分别测吸光度。
提取料液比对吸光度值影响:精密称量4g生晒参粉5份,分别置5只锥形瓶中,浸提溶剂分别为1∶15、1∶20、1∶25、1∶30 和 1∶35,即 60、80、100、120、140ml纯化水,超声功率200W、浸提温度80℃、浸提时间60min,分别得5份提取液,将提取液用300绢布滤过后静置冷却至室,得5份提取液,提取液分别用纯化水定容至200ml容量瓶中,待用,分别测其吸光度。
提取超声功率比对吸光度值影响:精密称量4g生晒参粉5份,分别置5只锥形瓶中,浸提溶剂固液比为1∶25,即100ml纯化水,超声功率分别为40、120、200、280和 360W、浸提温度为 80℃、浸提时间浸提时间为60min,分别得5份提取液,将提取液用300目绢布滤过后静置冷却至室温,得5份提取液,提取液分别用纯化水定容至200ml容量瓶中,待用,分别测吸光度。
在单因素试验基础上,每因素选三水平进行正交试验,以人参总皂苷含量为评价指标确定最优化参数。
1.2.3 枳椇子提取试验设计
生晒拐枣粉碎后浸提有效成分,采用超声波技术、纯化水浸提,对浸提温度(℃)、浸提时间(min)、料液比、超声波功率(W)4个因素进行单因素实验,采用紫外线分光光度法结合葸酮一硫酸比色法测定其多糖含量,测拐枣提取液吸光度(即提取液拐枣中活性多糖含量)比较得出最佳提取条件。
提取时间对吸光度值影响:精密称量10g拐枣干粉5份,分别置5只锥形瓶中,浸提溶剂固液比为1∶10,即100ml纯化水,超声功率200W、浸提温度为70℃,浸提时间分别为 20、40、60、80、100min,分别得 5 份提取液,将提取液用300目绢布滤过后静置冷却至室温,得5份提取液,定容至100ml,测吸光度。
提取温度对吸光度值影响:精密称量10g拐枣干粉5份,分别置5只锥形瓶中,浸提溶剂固液比为1∶10,即100ml纯化水,超声功率200W、浸提温度分别为50、60、70、80、90℃,浸提时间为 60min,分别得 5 份提取液,将提取液用300目绢布滤过后静置冷却至室温,得5份提取液,定容至100ml,测吸光度。
提取料液比对吸光度值影响:精密称量10g拐枣干粉5份,分别置5个锥形瓶中,分别加入原料质量4、7、10、12 和 15 倍的纯化水,超声功率 200W、浸提温度分别为70℃,浸提时间为60min,静置冷却至室温,离心分离得上清液,定容至100ml,测吸光度。
提取超声功率比对吸光度值影响:精密称量10g拐枣干粉5份,分别置5个锥形瓶中,加入原料质量10倍的纯化水,超声功率分别为 40、120、200、280、360W浸提温度为70℃,浸提时间分别为60min,静置冷却至室温,离心分离得上清液,定容至100ml,测吸光度。
在单因素试验基础上,各因素进行三水平正交试验,以生晒拐枣粉中还原性多糖的含量为评价指标确定最优化参数。
1.2.4 人参拐枣提取液澄清试验设计
1.2.4.1 人参提取液澄清试验设计
壳聚糖澄清试验:取人参提取液50ml,壳聚糖先用水溶解,配制成2%溶液,分别向混合液中加入壳聚糖0.04%、0.05%、0.06%、0.07%、0.08%,搅拌均匀,静置6h,取上清液测定透光率。
明胶单宁澄清法:取人参提取液50ml,使用纯化水将样品配制成2%溶液,明胶用量为0.1%左右,丹宁用量分别为 0.02%、0.03%、0.04%、0.05%、0.06%。不断搅拌下徐徐加入到样品中,混合均匀后在室温10℃下静置6h。
皂土澄清法:取人参提取液50ml,使用纯化水将样品配制成2%溶液,分别向混合液中加入皂土0.04%、0.05%、0.06%、0.07%、0.08%,搅拌均匀,静置6h,取上清液测定透光率。
1.2.4.2 枳椇子提取液澄清试验设计
壳聚糖澄清试验:取拐枣提取液50ml,壳聚糖先用水溶解,配制成2%的水溶液,分别向混合液中加入壳聚糖0.06%、0.07%、0.08%、0.09%、0.10%, 搅拌均匀,静置6h,取上清液测定透光率。
明胶单宁澄清法:取拐枣提取液50ml,使用纯化水将样品配制成2%溶液,明胶用量为0.1%左右,丹宁用量约为 0.01%、0.02%、0.03%、0.04%、0.05%。 不断搅拌下徐徐加入到样品中,混合均匀后在室温10℃下静置6h。
皂土澄清法:取拐枣提取液50ml,使用纯化水将样品配制成2%溶液,分别向混合液中加入皂土0.08%、0.09%、0.10%、0.11%、0.12%,搅拌均匀,静置6h,取上清液测定透光率。
1.2.5 人参枳椇子复合饮料配方试验设计
采用人参提取液加量、枳椇子提取液加量、蔗糖添加量、柠檬酸四因素,各因素进行三水平正交试验,试验因素表如下:
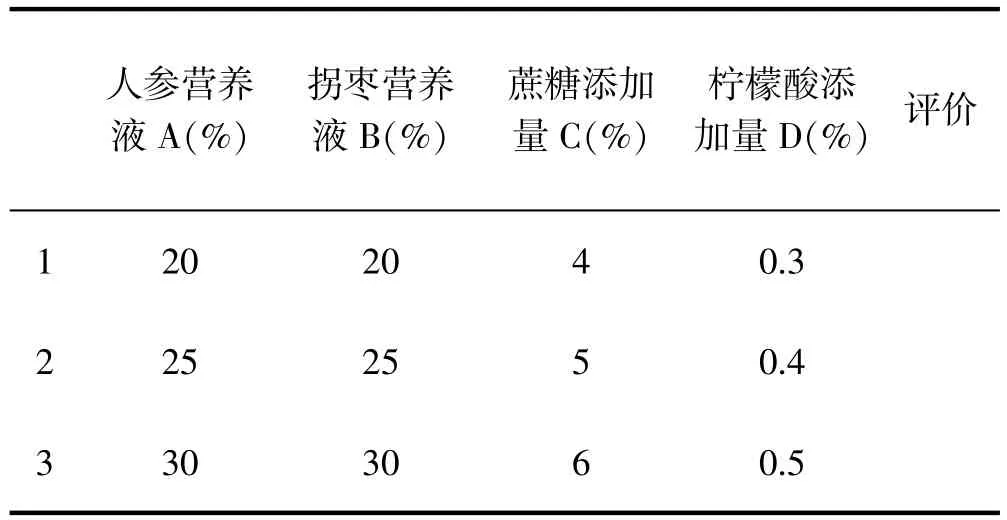
表2-1 正交试验设计Tab.2-1 Orthogonal experimental design
1.3 分析测定方法
1.3.1 人参皂苷测定方法
人参总皂苷的含量测定方法:人参总皂苷的含量测定参照NY318-1997人参制品。
人参总皂苷的含量测定原理:人参皂苷在正丁醇中分配系数比在水中大,故用乙醚脱脂后,用水饱和正丁醇萃取纯化皂苷。人参皂苷与硫酸-香草醛显色,在544nm波长下有最大吸收峰,在一定浓度下符合朗布-比尔定律。
分别精密量取5份提取液2ml,置100ml烧杯中,用纯化水40ml溶解后,定量转入250ml分液漏斗中,再用20ml纯化水分2次冲洗烧杯,合并入分液漏斗中,加乙醚分别为30ml、30ml、20ml分3次振摇萃取,弃去乙醚液。再用饱和正丁醇分别为30ml、25ml、20ml分3次振摇萃取,合并正丁醇液,用纯化水1倍量振摇,待分层后,弃去水层。取正丁醇层于蒸发皿中,在沸水浴上蒸干,残渣用甲醇溶解后,转移至1000ml容量瓶中,用甲醇稀释至刻度,摇匀备用。
测定:分别精密量取上述5份样品溶液50l,置具塞刻度试管中,蒸干后,加入8%香草醛试液1.0ml,72%硫酸试液10ml,充分振摇混匀后,置60℃恒温水浴锅上加热10min,立即用冰水冷却10min,摇匀。以试剂作空白,用分光光度计于544nm波长处分别测定吸光度。
1.3.2 拐枣多糖测定方法
拐枣中活性多糖的含量测定原理:拐枣中多糖含量的测定方法用蒽酮一硫酸比色法。用蒽酮一硫酸比色法测定拐枣中活性多糖(非淀粉多糖)时多糖类在硫酸的作用下,先水解成单糖分子,并迅速脱水生成糖醛衍生物,然后和蒽酮合成有色化合物,用比色法测定其含量。
称取已干燥的拐枣果粉20g(平行3份),置索氏提取器中。 加入石油醚 250ml沸程(30~60℃),60℃回流提取2h脱脂,抽滤,滤渣挥干溶剂后,加入80%乙醇9O℃回流提取2次,每次1.5h,离心去滤渣,挥干溶剂,滤渣加蒸馏水200ml沸水浴回流提取1h,离心,取上清液,滤渣再加蒸馏水200ml沸水浴再提1次,合并上清液,真空浓缩。上清液用4∶1的氯仿—正丁醇溶液搅拌萃取、静置、分出氯仿层,除去蛋白质。过滤,滤液中加入乙醇,使乙醇浓度达80%,再放置4℃冰箱中过夜。离心分离,沉淀依次用无水乙醇、丙酮、乙醚各洗两次,真空干燥至恒重,即得精制拐枣活性多糖,称重计算得率后备用。
测定:精确称取过60目筛的拐枣果粉0.5g(平行3份),分别置于三角瓶中。加80%乙醇30ml,80℃水浴回流提取1h,趁热过滤,残渣用热乙醇洗涤(8ml×3),残渣连同滤纸置三角瓶中,加入40ml蒸馏水,于100℃水浴,提取1h,趁热过滤,残渣用热水洗涤(8ml×3),洗液并人滤液中,置冷后定容于100ml容量瓶中摇匀备用。以试剂作空白,用分光光度计于568nm波长处分别测定吸光度。
1.3.3 吸光度值测定方法
本文根据国标GB/T 8313,样品中皂苷质能与亚铁离子形成紫蓝色络合物,准确吸取试液1ml,注人25ml的容量瓶中,加水4ml和酒石酸亚铁溶液5ml,充分混合,再加pH7.5磷酸盐缓冲液至刻度,用10mm比色杯,在波长540nm处,以试剂空白溶液作参比,测定吸光度。
1.3.4 其他理化指标测定
总糖:斐林试剂滴定法。
总酸:氢氧化钠滴定法。
1.3.5 人参枳椇子复合饮料感官评分标准
包括色泽、香气、滋味、状态四项,每项给出满分的要求及分值,具体评分标准见表2-2:

表2-2 人参枳椇子复合饮料感官评分标准Tab.2-2 Bentonite clarification process measurement results
以上四种标准的评价从好到坏评分依次为10-1分。
2 结果与分析
2.1 人参提取结果与分析
2.1.1 浸提时间单因素试验
采用不同时间对人参进行提取,在其他条件相同情况下,浸提时间为80min时提取营养素的含量最高。在相同条件下,随着浸提时间的增加,提取营养成分的含量一直增高。综合其它条件可选择合适的浸提时间可以得到较理想的浸提效果。比较结果见图3-1:
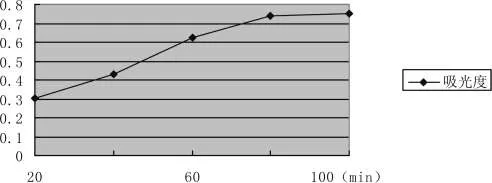
图3-1 浸提时间的选择Pic.3-1 Extraction temperature selection
2.1.2 浸提温度单因素试验
采用不同温度对人参进行提取,在其他条件相同情况下,浸提温度为80℃时提取的人参有效成分含量最高,随着浸提温度的增加,提取营养素的含量并不是一直增高,而是先增高后减小。因为随着浸提温度的增大温度会上升,在高功率条件下营养素容易被氧化,营养素氧化引起的损失导致提取率降低,因此选择80℃浸提温度可以得到较理想的浸提效果。比较结果见图3-2:
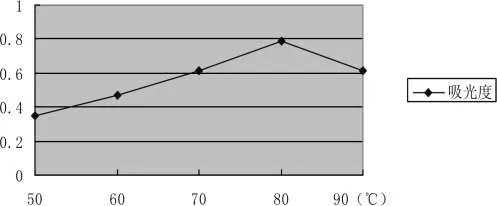
图3-2 浸提温度的选择Pic.3-2 Extraction time selection
2.1.3 料液比单因素试验
采用不同料液比对人参进行提取,在其他浸提因素相同条件下,料液比为1∶25时,提取的人参总皂苷含量最高。随着料液比的增加,人参总皂苷提取率已无显著提高。因此最佳料液比为选择1∶25。比较结果见图3-3:
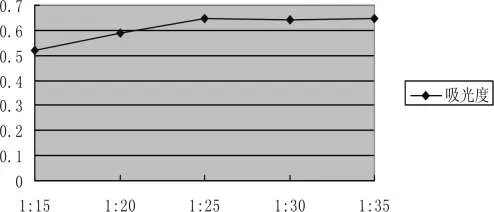
图3-3 料液比的选择Pic.3-3 Liquid ratio selection
2.1.4 超声功率单因素试验
采用不同超声功率对人参进行提取,在其他亲体条件相同情况下,浸提超声功率为200W时提取营养素的含量最高。在相同条件下,随着浸提功率的增加,提取营养素的含量并不是一直增高,而是先增高后减小。因为随着浸提功率的延长,营养素容易被氧化,营养素氧化引起的损失导致浸提率降低,因此选择合适的浸提超声功率可以得到较理想的浸提效果。比较结果见图3-4:
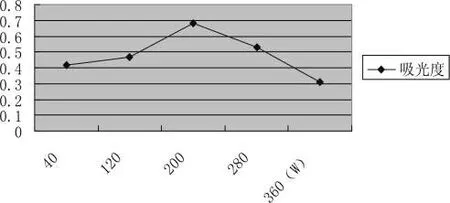
图3-4 浸提功率的选择Pic.3-4 Extraction power of choice
2.1.5 人参提取工艺的正交实验
根据单因素试验所得到各试验参数的基本范围以浸提温度,浸提时间,料液比,超声功率四因素进行L9(34)正交试验,确定最佳浸提工艺参数。
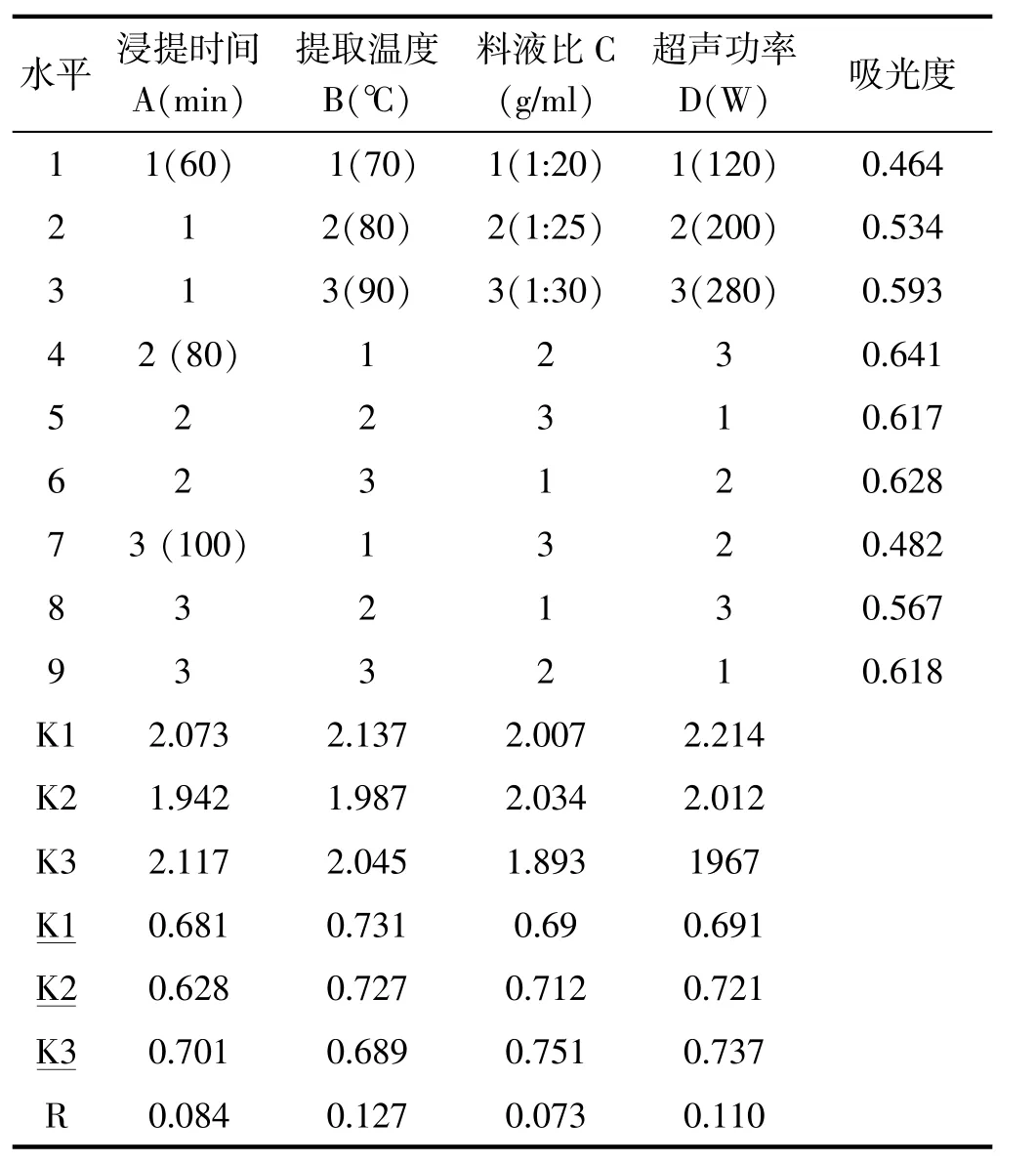
表3-1 正交试验设计及结果Tab.3-1 Orthogonal experimental design and results
表中的K1、K2、K3分别表示在各因素各水平下人参中人参皂苷取量的总和,K1、K2、K3分别表示在各因素各水平下人参皂苷提取量的平均值。由于有时会遇到各因素水平数不等的情况,因此,一般用提取量的平均值大小来反映同一个因素的各个不同水平对试验结果(提取量)影响的大小,并以此确定该因素应取的最佳水平。用同一因素各水平下平均提取量的极差R(极差=平均提取量的最大值-平均提取量的最小值)来反映各因素的水平变动对试验结果(提取量)影响的大小。极差大就表示该因素的水平变动对试验结果的影响大,极差小就表示该因素的水平变动对试验结果的影响小。由表中数据得到因素的主次顺序依次为提取温度(因素B)、超声功率(因素D)、浸提时间(因素A)、料液比(因素C)。主要因素应取最好的水平,而次要因素则可根据成本收益等方面的统筹考虑选取适当的水平。由此得到各因素的最佳搭配为A3B2C2D2,即最佳工艺为浸提时间100min,浸提温度80℃,料液比1∶25,超声功率为200W,人参提取液中总皂苷含量为0.067%。
2.2 拐枣提取结果与分析
2.2.1 浸提时间单因素试验
采用不同时间对拐枣进行提取,在其他条件相同情况下,浸提时间为60min时提取活性多糖的含量最高。在相同条件下,随着浸提时间的增加,提取活性多糖的含量并不是一直增高,而是先增高后减小。因为随着浸提时间的延长,活性多糖容易被氧化,氧化引起的损失导致浸提率降低,因此选择合适的浸提时间可以得到较理想的浸提效果。比较结果见图3-5:
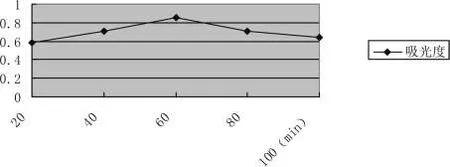
图3-5 浸提时间的选择Pic.3-5 Extraction temperature selection
2.2.2 浸提温度单因素试验
采用不同温度对拐枣进行提取,在其他条件相同情况下,浸提温度为70℃时提取的活性多糖含量最高,随着浸提温度的增加,提取活性多糖的含量并不是一直增高,而是先增高后减小。因为随着浸提温度的增大温度会上升,因此在高功率条件下活性多糖容易被氧化,氧化引起的损失导致提取率降低,因此选择合适的浸提温度可以得到较理想的浸提效果。比较结果见图3-6:
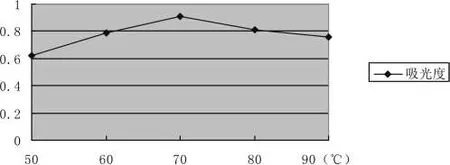
图3-6 浸提温度的选择Pic.3-6 Extraction time selection
2.2.3 料液比单因素试验
采用不同料液比对拐枣进行提取,在条件相同情况下,料液比为1∶10 g/ml时,提取的活性多糖含量已经比较高了。随着料液比的增加,活性多糖提取量是先增高后趋于稳定。因拐枣中的活性多糖含量一定,使用更多的提取溶剂对实验的结果影响并不大,选择固液比1∶10g/ml为最佳。比较结果见图3-7:
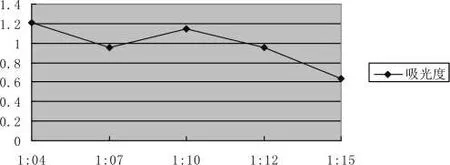
图3-7 料液比的选择Pic.3-7 Liquid ratio selection
2.2.4 超声波功率单因素试验
采用不同超声功率对拐枣进行提取,在其他条件相同情况下,浸提超声功率为200W时提取活性多糖的含量最高。在相同条件下,随着浸提功率的增加,提取活性多糖的含量并不是一直增高,而是先增高后减小。因为随着浸提功率的延长,活性多糖容易被氧化,氧化引起的损失导致浸提率降低,因此选择合适的浸提超生功率可以得到较理想的浸提效果。比较结果见图3-8:
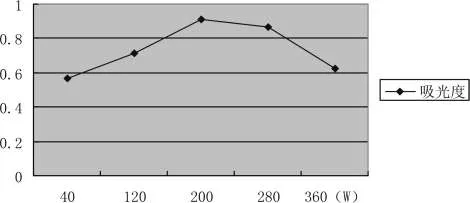
图3-8 浸提功率的选择Pic.3-8 Extraction power of choice
2.2.5 枳椇子提取工艺的正交实验
根据单因素试验所得到各试验参数的基本范围以浸提温度,浸提时间,料液比,超声功率四因素进行L9(34)正交试验,确定最佳浸提工艺参数,正交实验设计及结果见表3-2:
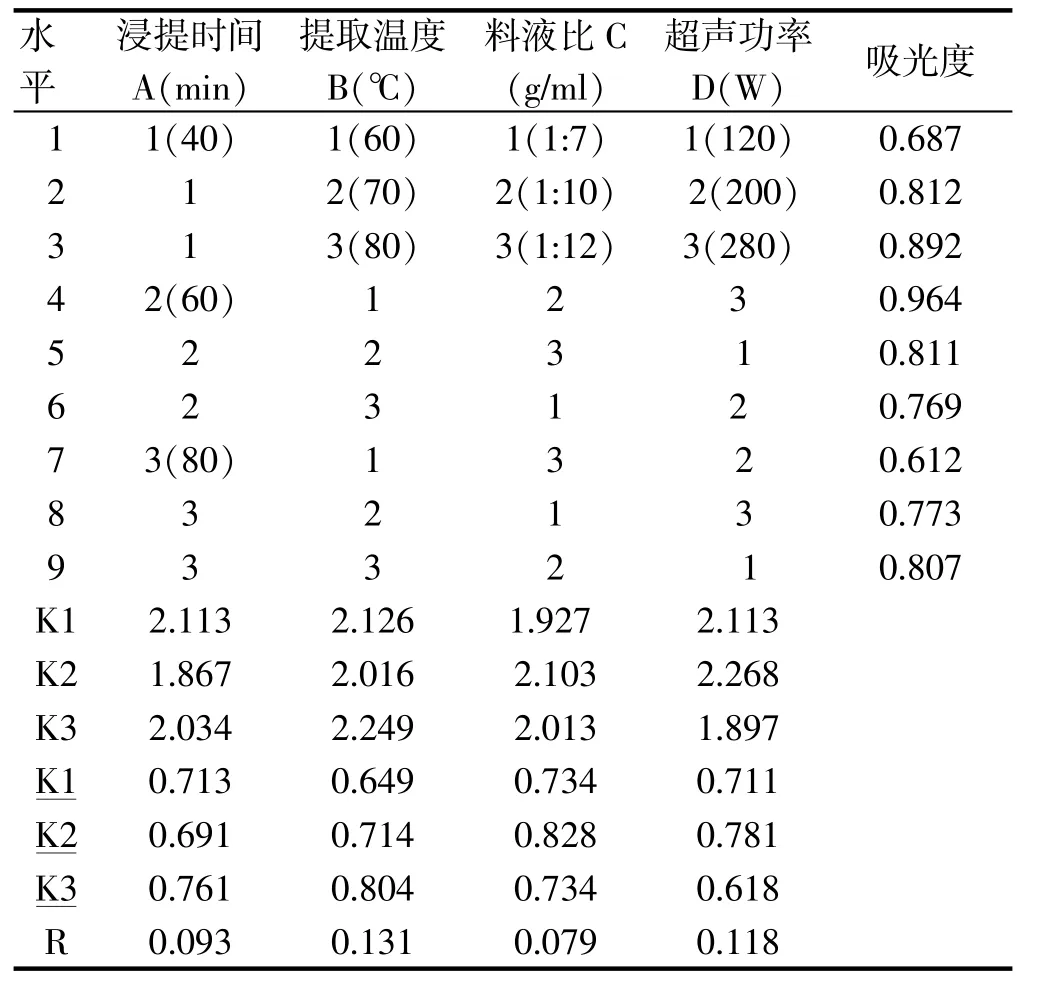
表3-2 正交试验设计及结果Tab.3-2 Orthogonal experimental design and results
表中的K1、K2、K3分别表示在各因素各水平下拐枣中活性多糖提取量的总和,K1、K2、K3分别表示在各因素各水平下拐枣中活性多糖提取量的平均值。由于有时会遇到各因素水平数不等的情况,因此,一般用提取量的平均值大小来反映同一个因素的各个不同水平对试验结果(提取量)影响的大小,并以此确定该因素应取的最佳水平。用同一因素各水平下平均提取量的极差R(极差=平均提取量的最大值-平均提取量的最小值)来反映各因素的水平变动对试验结果(提取量)影响的大小。极差大就表示该因素的水平变动对试验结果的影响大,极差小就表示该因素的水平变动对试验结果的影响小。由表中数据得到因素的主次顺序依次为提取温度 (因素B)、超声功率 (因素D)、浸提时间(因素A)、料液比(因素C)。主要因素应取最好的水平,而次要因素则可根据成本收益等方面的统筹考虑选取适当的水平。由此得到各因素的最佳搭配为A2B2C2D2,即最佳工艺为浸提时间60min,浸提温度70℃,料液比1∶10,超声功率为200W,提取液中活性多糖含量为1.21%。
2.3 人参枳椇子液澄清结果与分析
2.3.1 人参提取液澄清结果与分析
2.3.1.1 壳聚糖澄清结果
不同壳聚糖用量的澄清效果,结果见如图3-9所示:
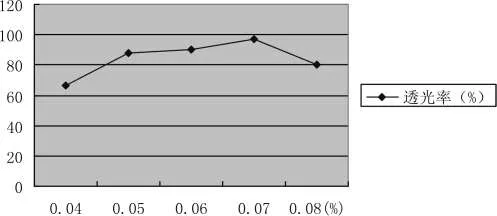
图3-9 壳聚糖澄清效果Pic.3-9 Clarification effect
随着壳聚糖用量的增加,透光率逐渐增大,当壳聚糖添加量为 0.07%时,透光率为 97.31%,此时澄清度最高,若继续增加用量,透光率则趋于下降,这是因为壳聚糖溶液有很强的黏性,当其过量时自身形成一个稳定的体系,反而不利于澄清。
2.3.1.2 明胶单宁法
不同单宁用量的澄清效果,结果见如图3-10所示:
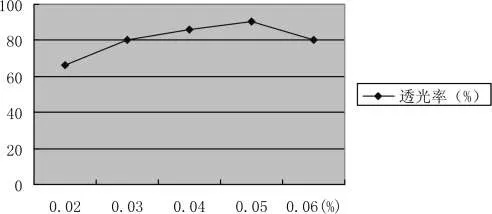
图3-10 明胶单宁澄清效果Pic.3-10 Clarification effect
随着单宁用量的增加,透光率逐渐升高,当单宁用量为0.04%,澄清效果最好,透光率达到86.14%,若继续增加用量,透光率则趋于下降,这是因为单宁溶液并不稳定,体系中过量单宁会增加体系势能,反而不利于澄清。
2.3.1.3 皂土法
不同皂土用量的澄清效果,结果见如图3-11所示:

图3-11 皂土澄清效果Pic.3-11 Clarification effect
随着皂土用量的增加,透光率逐渐增大,当皂土用量为0.06%时,透光率为84.55%,此时澄清度最高。这是由于皂土吸水膨胀后形成胶体悬浮液,颗粒带负电荷,吸附溶液中带正电荷的蛋白质,形成絮状沉淀,使溶液澄清。皂土过量会使得体系电荷为负,依然不算稳定。
比较上述三种方法,发现人参营养液的澄清剂为壳聚糖0.07%时,透光率为97.31%,澄清效果最佳。
2.3.2 枳椇子提取液澄清结果与分析
2.3.1.1 壳聚糖澄清结果
不同壳聚糖用量的澄清效果,结果见如图3-12所示:
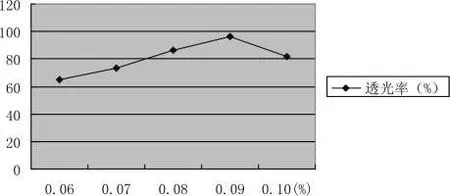
图3-12 壳聚糖澄清效果Pic.3-12 Clarification effect
随着壳聚糖用量的增加,透光率逐渐增大,当壳聚糖添加量为 0.09%时,透光率为 96.44%,此时澄清度最高,若继续增加用量,透光率则趋于下降,这是因为壳聚糖溶液有很强的黏性,当其过量时自身形成一个稳定的体系,反而不利于澄清。
2.3.2.2 明胶单宁法
不同单宁用量的澄清效果,结果见如图3-13所示:
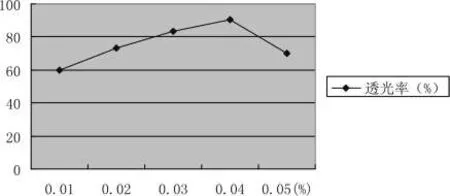
图3-13 明胶单宁澄清效果Pic.3-13 Clarification effect
随着单宁用量的增加,透光率逐渐升高,当单宁用量为0.04%,澄清效果最好,透光率达到90.56%,若继续增加用量,透光率则趋于下降,这是因为单宁溶液并不稳定,体系中过量单宁会增加体系势能,反而不利于澄清。
2.3.2.3 皂土法
不同皂土用量的澄清效果,结果见如图3-14所示:
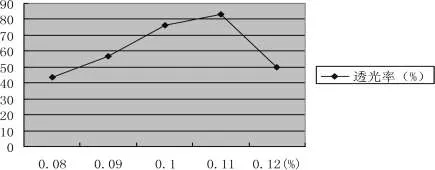
图3-14 皂土澄清效果Pic.3-14 Clarification effect
随着皂土用量的增加,透光率逐渐增大,当皂土用量为0.11%时,透光率为83.11%,此时澄清度最高。这是由于皂土吸水膨胀后形成胶体悬浮液,颗粒带负电荷,吸附溶液中带正电荷的蛋白质,形成絮状沉淀,使溶液澄清。皂土过量会使得体系电荷为负,依然不算稳定。
比较上述三种方法,发现拐枣提取液的澄清剂为壳聚糖0.09%时,透光率为96.44%,澄清效果最佳。
2.4 人参拐枣复合饮料配方试验结果与分析
上面通过对人参提取液和拐枣提取液的浸提条件选择到混合澄清工艺的选择基本可以确定人参拐枣饮的生产工艺条件,下面对复合饮品添加剂的含量比例做一个正交对比试验以确定配方中添加剂的添加含量。质量评断标准主要通过杂质、风味、滋味以及组织状态四个方面,评价标准见表3-19。
通过正交试验,确定最佳人参添加量、拐枣添加量、蔗糖和柠檬酸添加量,正交试验结果参见表3-3。
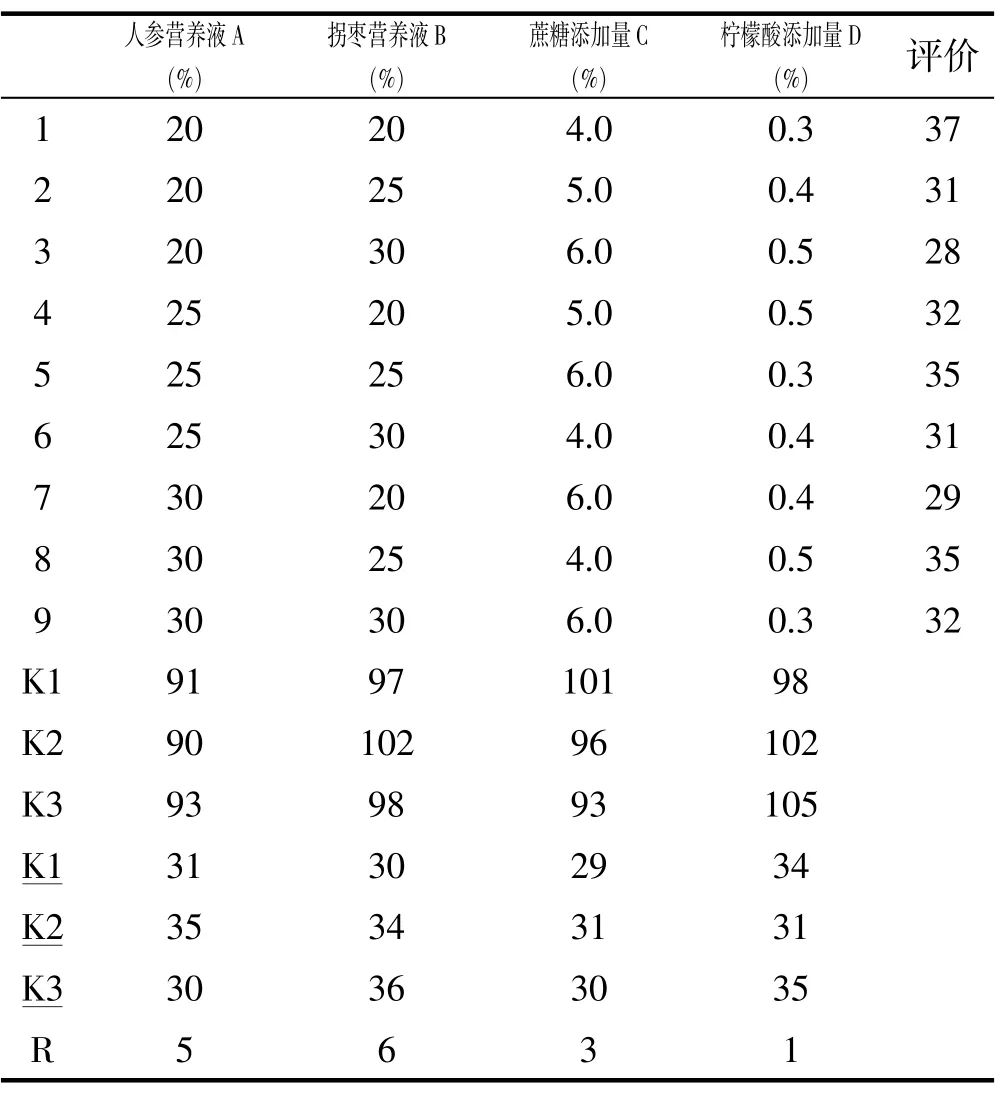
表3-3 正交试验设计及结果Tab.3-3 Orthogonal experimental design and results
表中的K1、K2、K3分别表示在各因素各水平下人参拐枣饮的综合评分的总和,K1、K2、K3分别表示在各因素各水平下人参拐枣饮的综合评分的平均值。由于有时会遇到各因素水平数不等的情况,因此,一般用综合评分的平均值大小来反映同一个因素的各个不同水平对试验结果(综合评分)影响的大小,并以此确定该因素应取的最佳水平。用同一因素各水平下平均综合评分的极差R(极差=平均综合评分的最大值-平均综合评分的最小值)来反映各因素的水平变动对试验结果(综合评分)影响的大小。极差大就表示该因素的水平变动对试验结果的影响大,极差小就表示该因素的水平变动对试验结果的影响小。由表中数据得到因素的主次顺序依次为拐枣营养液(因素B)、人参营养液(因素A)、蔗糖添加量(因素C)、柠檬酸添加量(因素D)。主要因素应取最好的水平,而次要因素则可根据成本收益等方面的统筹考虑选取适当的水平。由此得到各因素的最佳搭配为A1B1C1D1,即选择人参和拐枣营养液的含量均为20%,并添加8.4%的蔗糖以及0.36%的柠檬酸,复合饮品的综合评价最高。
3 产品质量标准与产品分析
3.1 产品质量标准
3.1.1 感官指标
色香味状态四项,质量标准参见下表4-1:

表4-1 复合饮质量标准Tab.4-1 Composite drinking quality standards
3.1.2 理化指标
糖、酸等,理化指标标准参见下表4-2:

表4-2 复合饮理化标准Tab.4-2 Composite drinking quality standards
3.1.3 微生物指标
通过复合工艺生产出的人参拐枣饮品应该达到以下微生物的指标要求,此标准有国家食品安全技术监督局提供,参见表4-3。

表4-3 人参拐枣饮品微生物综合指标要求Tab4-3 Ginseng Drinks Calligonum complex microbial composite index requirements
3.2 产品分析
选择10人对复合饮样品进行评测,男女各5人,对制得的饮料按上述标准进行分析,结果如下:
3.2.1 感官分析结果
对复合饮产品进行质量评价,结果见表4-4:

表4-4 复合饮质量评测Tab.4-4 Composite drinking quality standards
3.2.2 理化分析结果
对复合饮产品进行理化分析评价,结果见表4-5:

表4-5 复合饮理化分析评测Tab.4-5 Composite drinking quality standards
3.2.3 微生物分析结果
对复合饮产品进行微生物分析评价,结果见表4-6:

表4-6 复合饮微生物分析评测
可见人参枳椇子复合饮料复合上述标准。
4 结论
通过试验,本研究建立了人参拐枣饮品加工工艺的最佳生产条件,并且详细介绍了超声波提取方法和原理,最后还对人参拐枣复合饮品的稳定性做出了测定,以下就是本文通过试验对比得出以下结论:
4.1 超声提取法是对提取过程进行超声波强化处理,是利用超声波的机械破碎和空化作用,加速色素浸提物从原料中向溶剂扩散的速度,缩短浸提时间,增加有效成分的提取率,随着人们对超声波提取更深层次的了解,必定会在更多的科研领域运用到这种方法。
4.2 通过了一系列的单因素对照试验比较得出了人参原料浸提液最佳浸提条件为:浸提温度80℃,浸提时间100min,料液比为1∶25,浸提超声功率为200W。
4.3 通过了一系列的单因素对照试验比较得出了拐枣原料浸提液最佳浸提条件为:浸提温度70℃,浸提时间60min,料液比为1∶10,浸提超声功率为200W。
4.4 人参枳椇子提取液澄清方法采用壳聚糖澄清效果最佳人参提取液澄清方法以壳聚糖法最佳,用量为0.07%,透光率为97.31%。枳椇子提取液澄清方法以壳聚糖法最佳,用量0.09%,透光率为96.44%。
4.5 使用正交试验的方法比较得出了人参拐枣饮品的最佳配方为人参提取液20%,枳椇子提取液20%,蔗糖8.4%,柠檬酸0.36%。
4.6 人参枳椇子复合饮料经提取、澄清、调配、过滤、灌装、封口、杀菌、冷却等工艺,得到的饮料色泽偏黄,无明显沉淀与悬浮物质,具有枳椇子特有的香气和滋味,酸甜适口。
