弱光环境对长白落叶松和樟子松菌根苗生长的影响1)
2020-10-21郝龙飞武晓倩李星月王续富刘婷岩许吉康
郝龙飞 武晓倩 李星月 王续富 刘婷岩 许吉康
(内蒙古农业大学,呼和浩特,010019)
森林天然更新是森林生态系统稳定的基础,但不同森林生态系统普遍存在林下更新不良的现象。在森林生态系统中,不同的生态学过程(如:种子扩散方式、种内和种间竞争、外界干扰、环境异质性及空间分布格局等)对森林更新产生重要影响[1]。林下光照是影响树种更新及演替的重要因素,林冠层郁闭度是决定幼苗生长发育的关键。不同树种对光照需求存在差异,一般喜光性树种对光的需求较大,导致其林下更新更为困难[2]。研究发现,长白落叶松(Larixolgensis)人工林由于造林密度过大,林隙较小,限制了其林下幼苗更新,通过间伐虽然能够促进林下阔叶树的苗木更新,但长白落叶松幼苗仍很难更新[3-4]。樟子松(Pinussylvestrisvar.mongolica)人工林天然更新也存在同样的问题,当郁闭度0.4以上时,观察不到樟子松幼苗更新的情况[5],说明光照是影响长白落叶松及樟子松幼苗更新的主要因素之一。
针叶树大多数为典型的外生菌根依赖型树种,且外生菌根能够改善宿主植物的养分状况,其菌丝在土壤中的广泛分布,扩大了植物根系对养分的吸收面积,增强宿主植物对难移动元素和微量元素的吸收,进而促进林木生长[6]。林木形成菌根后,可以提高林下更新幼苗的抗逆性和抗病性,有利于天然更新幼苗生长[7]。当土壤中外生菌根真菌缺失时,更新幼苗不能形成菌根共生体,致使其抗旱抗病能力较弱,限制了更新幼苗生长[8]。关于不同菌根真菌对苗木生长的影响虽然进行了大量研究[9-10],但对弱光环境下长白落叶松和樟子松菌根苗生长状况的研究未见相关报道。
本研究以长白落叶松和樟子松1年生菌根苗为研究对象,在弱光环境条件下,分析接种不同外生菌根真菌对苗木生长的影响,探讨林冠下喜光性菌根依赖型树种生长发育规律,为人工促进天然更新提供技术支持。
1 材料与方法
1.1 试验材料
长白落叶松和樟子松种子分别于2017年在吉林省白山市露水河林场和内蒙古红花尔基樟子松自然保护区采集。将长白落叶松和樟子松的种子在体积分数2%的高锰酸钾溶液中消毒30 min,用无菌水冲洗4~5次,放入铺有用无菌水浸湿滤纸的培养皿中;将培养皿置于25 ℃恒温光照培养箱中进行催芽处理,待种子萌发后,播入装有经高温高压灭菌基质中(V(土)∶V(蛭石)=1∶1)。
试验选择8种外生菌根真菌作为接种菌剂,各菌种均采用MMN平板培养基活化、扩繁后,利用固体培养基对其进行菌剂制备。接种主要菌剂为:褐环粘盖牛肝菌(Suillusluteus)、厚环粘盖牛肝菌(Suillusgrevillei)、黄褐口蘑(Tricholomafulvum)、浅灰小牛肝菌(Boletinusgrisellus)、粘盖牛肝菌(Suillusbovinus)、球根白丝膜菌(Leucocortinariusbulbiger)、浅黄根须腹菌(Rhizopogonluteolus)和彩色豆马勃(Pisolithustinctorius)等。
1.2 试验方法
待长白落叶松和樟子松幼苗生长2个月后,对其幼苗根部进行固体菌剂接种处理。试验前用体积分数3% H2O2对所用花盆内壁进行消毒、灭菌,并放置24 h后备用。试验设置单一接种、混合接种和对照3种处理,单一接种处理中,长白落叶松接种彩色豆马勃菌剂[11],樟子松接种粘盖牛肝菌菌剂[12];混合接种处理,选取8种外生菌根真菌菌剂等量均匀混合后接种;对照处理中加入灭菌后的固体菌剂基质。苗木幼苗接菌时,选用直径15 cm的花盆,在花盆底部放入适量灭菌基质,然后将菌剂均匀平铺于灭菌基质上,每个花盆中放置菌剂20.0 g,选取前期培养长势良好的长白落叶松和樟子松苗木,将根系与菌剂充分接触栽于花盆中,每盆栽植5株幼苗,覆灭菌基质,每盆育苗总基质质量控制为1.0 kg;各处理分别设置15个重复,2树种各3个处理共计90盆。将接种后的苗木置于光照气候室中(最大光照度7 000 lx)弱光环境培养,该光照强度为模拟未经人工抚育采伐的近熟针叶林林冠下光照强度[13]。培养过程中,每5 d定量浇水150 mL/盆,每15 d浇体积分数10%的Hogland营养液150 mL/盆。
1.3 样品采集及测定
菌根苗合成后,在气候室弱光控制环境中培养6个月,然后进行样品采集和相关指标测定。
苗木成活率统计:统计各接种处理中成活苗木数量。苗木成活率=(成活苗木数量/试验苗木总数量)×100%。
外生菌根侵染率计算:采用统计法计算外生菌根侵染率。各处理分别选取9株苗木,将其根系清洗后剪成1 cm长的根段,各处理中每3株苗木根系取50个根段为1次重复,测定菌根侵染率。菌根侵染率=(侵染成功的菌根根段数/总根段数)×100%。
苗木形态指标及生物量测定:测定各处理下的苗高和地茎。生长指标测定结束后,采用破坏性取样方法,在各处理中选择大小均匀的30株完整苗木,用于根系形态测定,量取从根基部至主根根尖的自然长度,为其主根长;将生长在苗木主根上长度大于5 cm的侧根进行数量统计,为一级侧根数。测定结束后,将苗木烘干至恒定质量,测定其地上、地下生物量。
苗木养分指标测定:将烘干后的植物样品粉碎并过筛(孔径为0.149 mm),测定其养分质量分数。苗木全氮质量分数采用元素分析仪(德国·Elementer,VARIO Macro)测定。植物样品经消化后,采用钼锑抗比色法测定其全磷质量分数[14]。苗木养分质量=苗木生物量×养分质量分数。
苗木质量指数(QI)=苗木总生物量/((苗高/地径)+(茎生物量/根生物量))。
采用SPSS 18.0对数据进行描述统计、正态检验、方差分析及LSD多重比较,并对各指标进行Pearson相关性分析。
2 结果与分析
2.1 不同接种处理对苗木根系形态特征和菌根侵染率的影响
由表1可知,弱光环境下长白落叶松和樟子松苗木主根长、一级侧根数及菌根侵染率均在混合接种处理下达到最大,除樟子松主根长外,其它指标在处理间均达到了显著水平(P<0.05)。混合接种处理下长白落叶松苗木主根长及一级侧根数较单一接种处理分别提高了26.0%(P<0.05)、99.7%(P<0.05),较对照分别提高了61.4%(P<0.05)、144.3%(P<0.05);混合接种处理长白落叶松苗木菌根侵染率较单一接种处理提高了16.7%(P<0.05)。混合接种处理樟子松苗木一级侧根数较单一接种和对照分别提高了46.2%(P<0.05)、72.5%(P<0.05);混合接种处理樟子松苗木菌根侵染率较单一接种处理提高了68.3%(P<0.05)。
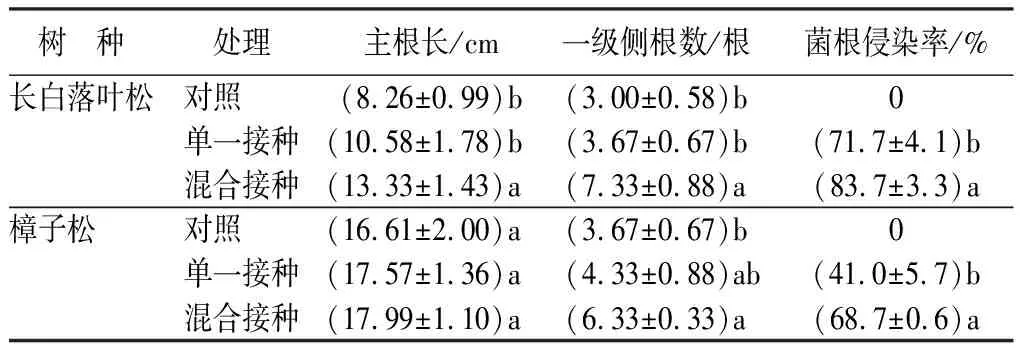
表1 不同接种处理对长白落叶松和樟子松苗木根系形态特征和菌根侵染率的影响
2.2 不同处理对苗高、地径及生物量的影响
由表2可知,弱光环境下长白落叶松和樟子松苗木苗高、地径和生物量均在混合接种处理下达到最大(P<0.05)。长白落叶松苗木混合接种处理与其它处理相比,显著提高了苗木地径、地上生物量及总生物量(P<0.05)。樟子松苗木混合接种处理与对照相比,显著提高了苗木地上、地下及总生物量(P<0.05)。
2.3 不同处理对苗木养分质量的影响
由表3可知,弱光环境下长白落叶松和樟子松苗木养分质量由高到低的顺序为:混合接种、单一接种、对照。混合接种处理长白落叶松苗木氮、磷质量比单一接种处理和对照显著提高(P<0.05),比单一接种处理分别提高了81.0%(P<0.05)、28.0%(P<0.05),较对照分别提高了128.7%(P<0.05)、28.0%(P<0.05)。混合接种处理樟子松苗木氮、磷质量较单一接种处理提高了33.4%(P<0.05)、18.6%,比对照分别提高了74.4%(P<0.05)、70.0%(P<0.05)。

表3 不同接种处理对长白落叶松和樟子松苗木养分质量的影响
2.4 不同接种处理对苗木质量指数及成活率的影响
由表4可知,弱光环境下长白落叶松和樟子松苗木质量指数和成活率均在混合接种处理下达到最大,其中,混合接种处理下,2种苗木质量指数和成活率均显著高于对照(P<0.05),而单一接种处理与对照相比均未达到显著水平(P<0.05)。混合接种处理下长白落叶松苗木质量指数及成活率较单一接种处理分别提高了100%(P<0.05)、8.8%,较对照分别提高了100%(P<0.05)、14.4%(P<0.05)。混合接种处理下樟子松苗木质量指数及成活率较单一接种处理分别提高了20.0%、2.7%,较对照分别提高了71.4%(P<0.05)、9.3%(P<0.05)。

表4 不同接种处理对长白落叶松和樟子松苗木质量指数及成活率的影响
2.5 接种处理、菌根侵染率与苗木质量指标的相关性
由表5可知,弱光环境下,接种处理与落叶松苗木各质量指标之间,除地下生物量外,与其它指标相关性系数均达到了显著水平(P<0.05),苗木菌根侵染率与地上生物量、氮质量、磷质量、苗木质量指数及苗木成活率相关性达到了显著水平(P<0.05);接种处理和菌根侵染率与樟子松苗木各质量指标间均达到了显著水平(P<0.05)。其中接种处理和菌根侵染率与2种苗木氮、磷养分质量Pearson相关性系数较大,而与苗木地下生物量相关性系数较小。

表5 接种处理、菌根侵染率与长白落叶松和樟子松苗木质量指标Pearson相关性分析
3 结论与讨论
林下光照是限制林下幼苗更新生长的主要原因之一[15-16]。接种菌根真菌有助于提高苗木光合能力[17],在一定程度上可以促进林下幼苗生长[7]。长白落叶松和樟子松为典型的外生菌根依赖型树种[11,18],在弱光环境中,单一接种处理可以提高苗木生物量积累,但效果不显著,而混合接种处理显著增加苗木生物量积累,且对地上生物量积累促进作用明显。该研究结果符合不同光照强度下,苗木生物量分配的植物生长策略。当光照充足时,植物会偏向更多生物量向地下根系分配以获取养分;当光照受到限制时会分配给地上更多的生物量以维持植物地上光合作用的需求[19]。混合接种处理,苗木质量指数显著提高,证明了植物形成菌根共生体后有助于增强苗木对弱光环境的适应能力。
弱光环境下,接种处理可以明显改善苗木根系形态,提高养分吸收效率,以往关于菌根真菌对根系构型及养分吸收的影响研究结果[20]一致。混合接种处理对苗木根系形态的改善效果高于单一接种处理,其原因是不同的外生菌根真菌与植物形成共生体后的主体功能存在差异,混合接种处理可以使菌根真菌间的协同效应得以有效发挥,提高菌根化苗木对外界环境的适应能力,进而有效促进苗木生长[21]。菌根共生体有效提高苗木养分吸收能力,主要因为混合接种处理下,2种苗木通过改善根系形态以及菌根共生体的形成,苗木增加了养分的吸收面积,这与前人研究结果[20,22]一致。
弱光环境下,接种处理促进了苗木的生物量积累和养分吸收,进而影响苗木质量指数及成活率。苗木氮质量与接种处理及苗木菌根侵染率的相关性系数均高于磷质量与二者间的相关性系数,说明菌根共生体有效促进了苗木磷吸收,但低于苗木对氮吸收的促进效率,由于土壤磷为限制性元素,并且磷元素在土壤中移动性较差,在根系周围易形成耗竭区,苗木吸收较为困难[23]。以往研究中发现,苗木体内高氮质量有助于提高苗木光合速率[24],因此,弱光环境中菌根化苗木有助于增加其生物量积累,提高苗木成活率。在弱光环境中,菌根化苗木主要通过增加苗木地上生物量,改善苗木光合能力以应对低光照胁迫,研究结果也符合苗木生长策略[19]。
综上所述,弱光环境下长白落叶松和樟子松苗木菌根化处理,特别是混合接种处理有利于苗木应对弱光环境条件。弱光环境中菌根化苗木主要通过增加苗木养分吸收,提高光合能力,改善苗木质量,进而增强苗木对弱光环境的适应能力。因此,通过混合接种的菌根苗在一定程度上可以解决长白落叶松和樟子松林下更新不良的现状。
