红花玉兰根腐病化学防治药剂的室内筛选及毒力测定1)
2020-10-21陈雨姗尹群王杰王相震段劼马履一贾忠奎
陈雨姗 尹群 王杰 王相震 段劼 马履一 贾忠奎
(省部共建森林培育与保护教育部重点实验室(北京林业大学),北京,100083)
红花玉兰(MagnoliawufengensisL.Y.Ma et L.R.Wang),又名五峰玉兰,是北京林业大学马履一教授团队于2004年在湖北省五峰县发现,并于2006年正式发表的木兰科植物新种[1]。该树种主要分布于五峰海拔1 400~2 000 m的天然次生林中,原生株不足2 000株,是珍稀的植物材料。又因其树形高大,花被片变异丰富,花色内外均由深红到浅粉色,花被片数目9~46瓣不等,花型涵盖了牡丹型、莲花型、月季型等,是珍贵的园林绿化观赏植物,具有极高的观赏和科研价值。
病害是影响红花玉兰健康生长发育的重要因素,红花玉兰根腐病是一种高发于红花玉兰幼苗上的致命性病害。该病发生初期地上部分难以观察,根部表皮层出现褐色病斑,颜色略深于健康皮层。随着病害发展,病斑逐渐蔓延到须根、侧根、主根,其木质部相继腐烂变黑。病害发生到一定程度时,地上部分才开始出现叶片变小、叶色加深、萎蔫、干枯甚至落叶的症状。该病害发生后不仅造成土壤有害微生物增多,还大大降低林地生产力以及种子、果实产量和质量,影响红花玉兰花芽分化等发育过程,严重时苗木成片死亡。根腐病作为一种土传病害,日趋影响林业可持续发展[2]。主要是由于土壤中微生物侵染致病,病原菌通过侵染植株根部伤口,直接进入植物体内,阻碍植物通过根部吸收养分、水分,影响植株发育,严重时造成植株死亡。根腐病的病原菌主要是土壤中的真菌,1917年Thomas et al.[3]首次在弗吉尼亚州苹果根腐病上发现其致病菌为多形炭角菌(Xylariapolymorpha),之后疫霉菌[4](Pythiumspp.)、丝核菌[5](Rhizoctoniaspp.)、镰刀菌[6](Fusariumspp.)等根腐病病原菌也被相继报道,其中镰刀菌最为广泛报道,致使红花玉兰感染根腐病的主要病原菌也是镰刀菌。在众多植物病害中,根腐病较其他病害致病性强,对植株危害大,易造成大片植株死亡。每年因根腐病,造成各苗圃经济损失巨大。
目前,根腐病的主要防治方法有选育抗病品种、林业技术防治、化学防治和生物防治[7]。传统育种方式选育抗病品种年限较长,面临遗传变异等不定性风险。林业技术防治主要通过轮作、间作等手段提高植株抵御病害能力,能够有效预防,但一旦发生大规模病害则无法起到有效防控。生物防治具有对环境污染影响小,对人类、牲畜活动干扰低的特点,但现阶段生产实践中仍主要依赖于化学药剂。因化学药剂见效快、效果显著、使用方便简洁,得到广泛应用。随着生态文明建设的大力宣传、人们绿色环保意识的逐步提升,化学药剂也趋向低毒、低残留、环境友好型发展。因此,科学、合理、高效、安全地使用环境友好型药剂,才能更好地发挥药剂的药效,有效防治植物根腐病。
然而,近年未曾有关于红花玉兰根腐病化学药剂防治的报道,因此,筛选抑制病原菌生长的化学药剂,高效、正确使用化学药剂已为当前形势所需。本研究选用不同化学药剂,设置多个稀释倍数,在实验室条件下,对红花玉兰根腐病主要病原菌镰刀菌的菌落生长进行研究并计算药剂有效中质量浓度(EC50),旨在选择对红花玉兰根腐病病原菌具有抑制作用的化学药剂,为红花玉兰根腐病大田防治提供科学依据和实践指导。
1 材料与方法
1.1 试验材料
1.1.1 供试菌种
根腐病病原菌由北京林业大学省部共建森林培育与保护教育部重点实验室提供,分离自湖北省五峰县王家坪种质资源生长区的红花玉兰根腐病病株,鉴定为镰刀菌(Fusariumsp.)。本试验选择分离比率较高的4个菌株作为供试菌株开展试验,分别是1223-8(Fusariumsp.GenBank: KX020568.1)、1123-3(FusariumsolaniGenBank: KR049251.1)、1129-4(FusariumsolaniGenBank: KT192216.1)、1108-3(Fusariumspp.GenBank: JQ340209.1)。病原菌在PDA培养基上纯化后置于培养箱25 ℃恒温培养。
1.1.2 供试药剂
本研究选用了市面上常见的6种根腐病防治化学药剂[6,8-10]进行药剂筛选试验(表1)。

表1 供试药剂情况
1.1.3 培养基
马铃薯葡萄糖琼脂培养基(PDA培养基):马铃薯200 g,葡萄糖20 g,琼脂15 g,蒸馏水1 L。
含药培养基:将6种药剂在原基础上梯度稀释(表2),搅拌融入未冷却的PDA培养基中,配成均匀含药平板。

表2 药剂稀释倍数与用量
1.2 试验方法
1.2.1不同化学药剂对红花玉兰根腐病病原菌菌落生长的抑制作用
每种药剂设置5个稀释倍数(表2),共30个处理,每个处理3次重复,以不加药剂的PDA平板作为空白对照。
菌丝生长速率法[11]:在超净台中,用直径为6 mm的无菌打孔器在红花玉兰根腐病病原菌菌落边缘打取菌饼,接种于含药平板和空白对照平板中央,每个平板接种一个病原菌菌饼。接种后的平板置于培养箱内25 ℃恒温黑暗培养7 d,观察菌落大小。在培养第3、5、7天时,采用十字交叉法测量菌落直径,并计算抑菌率(由于第7天对照病原菌已长满平板,试验用第5天的数据计算抑菌率),以血球计数法测定产孢量,即用25×16型血球计数板计算孢子数。
抑菌率=(处理菌落直径-对照菌落直径)/(处理菌落直径-6 mm)×100%。
(1)
产孢量=80个方格孢子总数/80×400×10 000×稀释倍数。
(2)
1.2.2 药剂毒力测定
以药剂质量浓度(或体积分数)的对数值为x,抑菌率的机率值为y,运用SPSS22.0软件进行回归分析,作毒力回归方程(y=a+bx)[12],同时计算供试药剂对病原菌的EC50,即当y=50%时,求得的x是EC50的对数。
1.3 数据统计与分析
试验数据利用Microsoft Excel 2010统计整理,采用SPSS22.0统计分析软件进行差异显著性分析、相关性分析,并求出各药剂对病原菌的毒力回归曲线方程、EC50、95%置信区间及R2。
2 结果与分析
2.1 不同化学药剂对红花玉兰根腐病病原菌的抑制作用
6种化学药剂的抑菌试验结果表明,5种化学药剂(代森锰锌、恶霉灵、福美双、根腐消、多菌灵)对红花玉兰根腐病病原菌(1123-3菌株、1129-4菌株、1223-8菌株、1108-3菌株)均有明显抑制作用(P<0.05);氰氨化钙对1123-3菌落生长有抑制作用,对其他3个病原菌株(1129-4菌株、1223-8菌株、1108-3菌株)无显著抑制作用(图1)。
不同化学药剂对同一病原菌株的抑制作用不同。对1123-3菌株,代森锰锌、福美双、多菌灵抑制效果比恶霉灵、根腐消、氰氨化钙好,其中多菌灵抑菌效果最好;对1129-4菌株,福美双和多菌灵抑制效果比代森锰锌、恶霉灵、根腐消好,氰氨化钙抑制效果不显著;对1223-8菌株,氰氨化钙无抑制作用,其他5种药剂均抑制效果显著;对1108-3菌株,福美双、多菌灵抑制效果比代森锰锌、恶霉灵、根腐消好,氰氨化钙抑制效果不显著(图1)。
2.2 不同化学药剂对红花玉兰根腐病病原菌产孢量的影响
被试菌株中1123-3菌株和1223-8菌株未产生孢子,因此,试验仅统计1129-4菌株和1108-3菌株2个菌株的产孢量。抑菌试验中发现,氰氨化钙对病原菌株抑制效果不显著,因此,试验仅比较另5种化学药剂对病原菌产孢量的影响。与对照相比,5种化学药剂对2个病原菌株的产孢量均有显著的抑制作用(表3)。
对1129-4菌株的抑制效果中,多菌灵对其产孢量抑制效果最显著,且与其他药剂有显著差异,抑菌率达97.33%;恶霉灵的抑制效果仅次于多菌灵,抑制率为90.35%;代森锰锌的抑制效果最差,抑菌率仅有61.76%,显著低于其他药剂;福美双和根腐消间无显著差异,抑菌率分别为82.05%和83.91%(表3)。
对1108-3菌株的抑制效果中,多菌灵抑菌效果显著优于其他药剂,抑菌率为94.08%;代森锰锌抑菌率仅有63.21%,显著低于其他药剂;多菌灵和恶霉灵以及恶霉灵和福美双间的抑菌效果无显著差异,恶霉灵、福美双和根腐消抑菌率分别为89.02%、82.23%和74.70%(表3)。
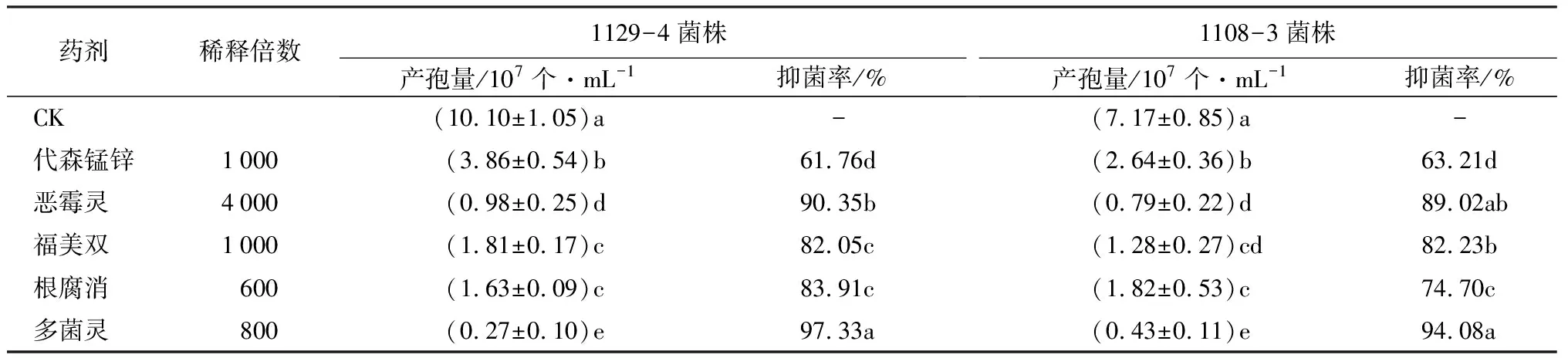
表3 不同化学药剂对红花玉兰根腐病病原菌产孢量的影响
综上所述,多菌灵对1129-4菌株和1108-3菌株产孢量的抑制效果最好。
2.3 不同稀释倍数化学药剂对红花玉兰根腐病病原菌菌丝生长的影响
同种化学药剂不同稀释倍数对不同病原菌株抑制效果有差异。比如,稀释600倍的代森锰锌对各菌株菌落生长抑制率效果最好,抑制率效果由强到弱的排序为1123-3菌株、1223-8菌株、1129-4菌株、1108-3菌株,其中最大抑制率达91.46%,而最小抑制率仅为57.92%。同种化学药剂稀释倍数越小,抑制效果越好。代森锰锌不同稀释倍数对1123-3菌株菌落生长抑制率由大到小的排序为600、800、1 000、1 200、1 400倍,即稀释倍数越小,抑制效果越好,最大抑制率达91.46%,最小抑制率仅为83.57%(表4)。
具有抑制作用的化学药剂中,多菌灵抑制效果最好,不同稀释倍数多菌灵对4个病原菌株的抑制作用差异不显著,且对4个病原菌株的抑制率均在90%左右。其他化学药剂不同稀释倍数中,最小稀释倍数和最大稀释倍数对菌株菌落直径大小影响显著。除氰氨化钙外,5种化学药剂随着药剂稀释倍数减小,病原菌菌落生长直径呈减小趋势,即抑制作用呈增大趋势(表4)。
总体来说,对红花玉兰根腐病病原菌4个菌株抑制效果最好的是多菌灵,5种稀释倍数的多菌灵对4个菌株的抑制率均约为90%,其中稀释400倍的多菌灵对1123-3菌株、1129-4菌株和1223-8菌株抑菌率最大,分别为99.42%、90.15%和99.91%,稀释400倍的多菌灵对4个病原菌株平均抑菌率为94.88%,稀释600倍的多菌灵对1108-3菌株抑菌率最大,为90.79%。其次是福美双,对4个菌株的抑制率均在60%以上;再次为根腐消,抑菌率均在55%以上。恶霉灵和代森锰锌抑制率大部分低于50%,抑制率最小的分别为24.37%和28.77%(表4)。综上,多菌灵、福美双和根腐消3种化学药剂抑制病原菌菌落生长效果较好。

表4 不同化学药剂、不同稀释倍数对红花玉兰根腐病病原菌菌落生长的影响
2.4 供试化学药剂室内毒力测定结果
通过抑菌试验求得供试化学药剂对不同病原菌的毒力回归方程,结果表明,不同稀释倍数的代森锰锌、福美双、恶霉灵、根腐消4种化学药剂对红花玉兰根腐病4个病原菌株均有明显抑制作用。5种稀释倍数的氰氨化钙只对1123-3菌株表现出抑制作用,因此,只求得氰氨化钙对1123-3菌株的毒力方程,其他3个菌株无毒力方程。多菌灵不同稀释倍数处理间对1123-3菌株抑菌效果差异不显著,因此未对其求得毒力回归方程(表5)。

表5 不同化学药剂、不同稀释倍数对红花玉兰根腐病病原菌菌丝生长的毒力回归方程
2.4.1 6种化学药剂对1123-3菌株的毒力
对于1123-3菌株,根腐消对菌丝生长抑制作用最强,其中稀释400倍的根腐消抑制率达88.41%,EC50为0.384 mg·L-1;其次是福美双,EC50为29.050 mg·L-1;代森锰锌和恶霉灵抑制作用较前两种药剂差,EC50>100.000 mg·L-1(表5)。
2.4.2 6种化学药剂对1129-4菌株的毒力
对于1129-4菌株,多菌灵对菌丝生长抑制作用最强,稀释400倍时多菌灵抑制率达90.15%,EC50为0.002 mg·L-1;根腐消次之,EC50为0.691 mg·L-1;然后是福美双和恶霉灵EC50分别为140.688 mg·L-1和369.086 mg·L-1;代森锰锌抑制作用最弱,EC50为1 261.563 mg·L-1(表5)。
2.4.3 6种化学药剂对1223-8菌株的毒力
从表5可以看出,根腐消的EC50值最小,为0.583 mg·L-1;其次为福美双、恶霉灵,EC50值分别为37.676、87.050 mg·L-1;代森锰锌的EC50值最大,为352.582 mg·L-1。结果表明,根腐消对1223-8的抑制效果最好,代森锰锌的抑制效果最差。
2.4.4 6种化学药剂对1108-3菌株的毒力
从表5可以看出,根腐消的EC50值最小,为0.394 mg·L-1;其次为恶霉灵、福美双,EC50值分别为383.205、490.451 mg·L-1;代森锰锌的EC50值最大,为1 107.251 mg·L-1。结果表明,根腐消对1108-3的抑制效果最好,代森锰锌的抑制效果最差。
3 结论与讨论
本研究的抑菌试验结果表明,代森锰锌、福美双、多菌灵、恶霉灵、根腐消5种化学药剂对红花玉兰根腐病病原菌(1123-3菌株、1129-4菌株、1223-8菌株、1108-3菌株)有明显抑制作用,5种稀释倍数的氰氨化钙对1123-3菌落生长均有抑制作用,对其他3个病原菌株(1129-4菌株、1223-8菌株、1108-3菌株)无显著抑制作用。
无论是对病原菌菌落生长还是产孢量的影响,多菌灵对4个病原菌株均表现出很高的抑制性。这与游景茂等[13]研究发现多菌灵可有效抑制白术(Atractylodesmacrocephala)根腐病病原菌生长的结果一致,他们发现多菌灵可湿性粉剂在室内及田间防治效果都很好,在田间施加根腐消1 000倍液,10 d后田间防效为67.37%。多菌灵的主要成分是苯并咪唑-2-氨基甲酸丙酯,通过抑制病原菌细胞有丝分裂过程中纺锤体的形成而抑制菌丝生长[14],有力的支持了多菌灵在白术的室内及田间防治效果一致的试验结果。但本研究结果仅代表多菌灵对红花玉兰根腐病病原菌的室内抑制效果很好,具体田间试验结果仍需进一步探究。
根腐消在4个病原菌株的抑制试验中也表现较优越,且相对EC50值较低,抑制作用较强。汪静等[15]研究发现,根腐消600倍液对三七(Panaxnotoginseng)根腐病室内抑制率可达100%,杜宾等[16]研究发现,在大棚中根腐消250倍液可有效抑制灯盏花(Erigeronbreviscapus)的根腐病发生。这说明同种药剂针对不同植物的根腐病有不同的响应,对于植物处于不同环境下影响效果也不同,直接导致在进行防治时所需药剂稀释倍数的差异。由于根腐消是一种内吸性药剂,进入土壤后与土壤的铁、铝离子结合增强杀菌能力,建议继续进行红花玉兰根腐病大田防治试验,研究是否在大田中和土壤作用后防治效果更佳。
室内化学药剂筛选试验中,福美双和恶霉灵对1123-3菌株、1223-8菌株抑制率达到90%以上,对1129-4菌株和1108-3菌株抑制率为20%~80%,说明福美双和恶霉灵具有防治红花玉兰根腐病的潜质,也可作为之后大田试验的待选化学药剂。福美双属于有机硫类广谱保护性药剂,作用机理是通过抑制病原菌的酶活性和干扰三羧酸代谢循环而导致病原菌死亡发挥抑制作用。恶霉灵作为一种内吸性药剂,具有独特的作用机理,恶霉灵进入土壤后被土壤吸收并与土壤中的铁、铝等无机金属盐离子结合,有效抑制孢子的萌发和病原真菌菌丝体的正常生长或直接杀灭病菌。就这点来说,福美双直接作用于菌体本身,这是其抑制作用更强的根源所在,而恶霉灵在室内试验中失去了与无机金属离子结合从而增强抑菌效果的机会,在大田使用过程中,表现出的防治效果或许能够进一步提升。但是,具体的防治功效还得依大田复杂的实际情况而言,红花玉兰苗木本身的苗龄、生长状况、受害程度等同样会影响药剂的防治效果。因此,今后两种药剂的大田试验是必不可少且更具实践意义的。
代森锰锌对1129-4菌株和1108-3菌株的孢子及菌落生长抑制率仅60%左右,对另2个病原菌株的抑制率较其他药剂也并未体现得很高,并且对4个病原菌株的EC50值都相对较大,在实际应用中建议红花玉兰种植户慎重考虑。代森锰锌在银杏上也并未表现出绝对优势,俞家楠等[17]研究发现,代森锰锌对银杏根腐病病原菌抑制率仅44.17%。代森锰锌是一种二硫代氨基甲酸盐类广谱保护性药剂,主要是通过抑制病原菌株体内丙酮酸的氧化阻碍菌株能量供应达到抑菌效果[10]。Reglinski et al.[9]研究发现,对辐射松(Pinusradiata)剪枝一周后施用代森锰锌可有效抑制根腐病。结合代森锰锌作用机理说明虽同为根腐病,同一药剂在不同植物中抑制效果不同,可能是因为药剂对不同病原菌抑制其体内代谢效果不同,具体植物仍需进行进一步研究和探讨。
氰氨化钙对4个病原菌株的抑制效果较差,仅对1123-3菌株表现出较高的抑制率,不建议作为红花玉兰根腐病的防治药剂。氰氨化钙是一种环保型高效土壤消毒剂[18],主要是在土壤中分解,其分解中间产物单氰胺和双氰胺具有消毒、灭虫和防病的作用。由于氰氨化钙主要在土壤中作用,其并未在室内平板试验中表现出优良品质。氰氨化钙分解后含有氮和钙离子,一定质量浓度的氮素及钙离子能有效促进菌丝生长[19],这就解释了为什么部分稀释倍数的氰氨化钙对菌丝菌落生长表现出抑制率为负。氰氨化钙虽为环境友好型土壤消毒剂,人体吸入其粉可能产生急性毒性,具有一定的风险,使用时需谨慎。试验结果不推荐将氰氨化钙投入到防治红花玉兰根腐病的实际应用中。
代森锰锌、福美双、多菌灵、恶霉灵、根腐消这5种化学药剂均具有抗菌谱较广、高效、低毒的特点,且对4个病原菌株均有较好的抑制效果,建议生产上可5种药剂交替使用,以有效控制根腐病害,防止病原菌对某种单一试剂产生抗药性。在室内运用抑菌试验进行化学药剂的筛选仅代表药剂与病原菌直接接触时药剂对病原菌菌丝生长及产孢的抑制效果,而药剂在田间对病害的防治效果不仅与药剂对病原菌菌丝抑制有关,还与药剂作用机理、施药技术、施药天气状况等因素有关。本研究仅代表室内筛选效果,不代表大田研究结果,可基于本试验结果进行大田防治研究及评价。
