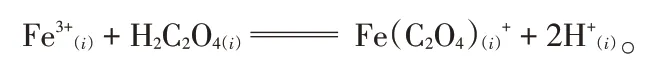草酸反萃S-15萃取剂中铁离子的动力学研究
2020-10-20许德华庄海波
邓 强,杨 林,许德华,郭 磊,庄海波
(四川大学 化学工程学院,四川 成都 610065)
近年来,湿法磷酸已逐渐取代热法磷酸成为生产工业级或食品级磷酸及磷酸盐的重要原料[1-2]。但由于湿法磷酸生产过程需用强酸分解磷矿,磷矿中的伴生金属(如铁、铝、镁、锰等)进入磷酸中,不仅增大磷酸的黏度,使运输过程能耗增大,还可能降低磷酸中有效磷含量,使湿法磷酸及下游产品品质降低[3-5]。因此,如何有效降低湿法磷酸中的金属离子含量使其满足下游产品的生产要求已经成为企业和科研院校面对的难题之一。笔者所在课题组采用溶剂萃取技术净化湿法磷酸,并开发出一种S-15萃取剂,可脱除湿法磷酸中的金属离子。郭磊、黄懿等[6-7]分别采用该萃取剂脱除湿法磷酸中的铁离子和锰离子,在反应时间20 min、反应温度60 ℃、相比(O/A)3 的实验条件下,铁离子、锰离子的单级萃取率分别达到90%和35%左右。为实现该萃取剂的循环利用和金属元素的资源化利用,需要对负载金属离子的萃取剂进行再生。课题组采用草酸反萃S-15 萃取剂中的铁离子,获得了反萃过程的热力学数据及适宜的反萃操作参数,但对于反萃过程的机制研究尚不够深入。
研究反萃过程的机制及动力学具有重要意义。在工程方面可以指导反萃器的设计,反萃过程停留时间越短,反萃器体积越小;此外,动力学揭示了反应规律,有助于确定反应发生的位置及反萃过程的速率控制步骤,对于寻找强化传质的途径、优化反萃过程的工艺参数、指导工业生产有重要意义[8-11]。动力学的研究方法主要有恒界面池法、高速搅拌法和单液滴法等[12-14],其中恒界面池法具有装置简单、易实现连续取样等优点,应用范围较为广泛。本研究采用恒界面池法考察草酸反萃S-15萃取剂中铁离子的动力学,探究搅拌转速、反应温度、界面直径对铁离子反萃速率的影响,推导反萃过程的机制,确定反萃过程速率控制步骤,建立反萃过程控制模型。
1 实验部分
1.1 试剂和仪器
试剂:S-15萃取剂(实验室自制);磷酸(分析纯,w(H3PO4)85%);硫酸(分析纯,w(H2SO4)98%);硝酸(分析纯,w(HNO3)65%~67%);磺化煤油、二水草酸、硫酸铁,均为分析纯;超纯水等。
仪器:电感耦合等离子体发射光谱仪(ICPOES)、分析天平(FA2004)、电子天平(DJ-2002)、恒温磁力搅拌器(DF-101S)、恒速搅拌器(S212型)、超纯水仪(UPH-I-100L)等。
恒界面池装置为实验室自行设计,由双搅拌器、界面环、折流挡板等组成,其主体部分如图1所示。恒界面池内径为7.0 cm,中间固定有界面环,将恒界面池分为上下等体积(150.0 mL)的2个腔室,每隔120°设置一道折流挡板,以防止两相主体流动。

图1 恒界面池装置示意图
1.2 实验流程与数据分析方法
实验于恒界面池中进行,具体实验步骤如下:
(1)取两只烧杯分别装入一定量的萃取剂和草酸,预热至设定的温度;将草酸150.0 mL倒入恒界面池底部,然后缓慢加入等体积的S-15萃取剂。
(2)开启搅拌器,设定搅拌转速,并用红外转速仪校准搅拌转速,开始计时。
(3)用25 μL 液相平头微量进样器取样,前10 min在1、3、5、10 min时取样,10 ~30 min时每隔5 min取一次样,30 ~120 min时每隔10 min取一次样。取样总体积为450 μL,小于总体积的0.3%,对于界面的影响可以忽略。
(4)用ICP-OES 分析铁离子的浓度,并绘制水相铁离子浓度随时间的变化曲线。
2 实验结果与讨论
2.1 反萃过程平衡方程的确定
铁离子在S-15 萃取剂中以Fe(H2PO4)A2·2HA的形式存在[6],因此可以假设反应方程式为:
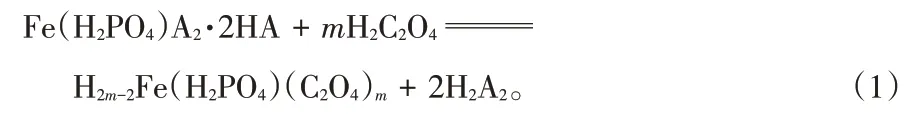
式中H2A2表示以二聚体形式存在的S-15 萃取剂分子。
反应的化学平衡常数可以用式(2)表示[15]:

由分配系数的定义知:

将式(3)代入式(2),并对两侧同时取对数:
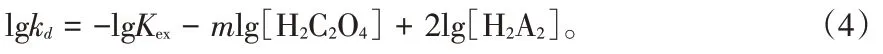
由式(4)可知,改变草酸的浓度,以lgkd对lg[H2C2O4]做图,拟合直线的斜率值即为m。实验条件:反萃温度333.15 K,搅拌转速300 r/min,萃取剂中铁离子质量分数0.67%,反萃时间15 min,草酸质量浓度为40 ~100 g/L,实验结果如图2所示。

图2 分配系数与草酸浓度的关系
图2中直线的斜率为-1.012 9,则m值为1,因此,反应方程式可以写为:

式(5)表示草酸与萃取剂中铁离子发生的最主要反应。在实际反萃过程中,由于草酸根与铁离子可能发生1,2,3 配位,体系还存在多种副反应。铁离子与草酸根的配位形式与体系pH有关,文献资料表明,当pH<1时,铁离子和草酸根主要以FeH(C2O4)2+形式结合;当pH在1 ~2时,铁离子和草酸根主要以Fe(C2O4)+、Fe(C2O4)2-形式结合;当pH>3时,铁离子和草酸根主要以Fe(C2O4)33-形式结合[16]。在实验所选草酸浓度下,体系pH约为1.2,此时反萃液中铁离子的存在形式为Fe(H2PO4)(C2O4),这与文献规律是相符合的。
2.2 反萃过程速率控制步骤的确定
速率控制步骤的判断方法主要有3种,即搅拌速率法、恒界面积法和温度判别法。
2.2.1 搅拌转速对铁离子反萃速率的影响
增大搅拌转速,若反萃速率也随之增大,则表明反萃过程主要受扩散控制;若反萃速率先增大后基本保持不变,反萃速率曲线出现“坪区”,则说明在该区域扩散的影响已基本消除,该过程主要受化学反应控制[17]。搅拌转速对铁离子反萃速率的影响见图3。实验条件:界面直径为6.0 cm,萃取剂中铁离子质量分数为0.61%,反萃温度为303.15 K,反萃时间为120 min,草酸质量浓度为60 g/L,搅拌转速为50 ~160 r/min。

图3 搅拌转速对铁离子反萃速率的影响
从图3 可知,当搅拌转速处于50 ~120 r/min时,界面相对平稳,铁离子反萃速率变化较为平缓,可以认为出现了“坪区”,此阶段反萃过程受扩散影响较小,主要受化学反应控制;当搅拌转速处于120 ~160 r/min 时,铁离子反萃速率增加的趋势变大,界面开始波动。当搅拌转速大于160 r/min时,界面出现漩涡,不再稳定。因此在后续的实验中采用120 r/min作为搅拌转速以维持界面的稳定。
2.2.2 界面直径对铁离子反萃速率的影响
在反萃过程中,萃取剂在水相的溶解度、表面活性、溶解速率及络合反应速率决定反应发生的位置。根据反应发生的位置,化学反应主要分为相内反应和界面反应,这可以通过研究界面积与反萃速率的关系来判断。一般来说,若反萃速率不随界面积增大而增大,则反萃过程受相内化学反应控制;若反萃速率随界面积增大而线性增大,则反萃过程受界面化学反应控制[18]。本小节研究了界面直径对铁离子反萃速率的影响,其结果如图4所示。实验条件:萃取剂中铁离子质量分数为0.61%,反萃时间为120 min,草酸质量浓度为60 g/L,搅拌转速为120 r/min,反萃温度为303.15 K,界面直径范围为4.0 ~6.0 cm。

图4 界面直径对铁离子反萃速率的影响
从图4可以看出,随着界面直径逐渐增大,铁离子的反萃速率线性增大,拟合的直线为不通过原点的直线,这表明反萃过程受界面化学反应控制或扩散和界面化学反应共同控制。
2.2.3 温度对铁离子反萃速率的影响
温度对于受化学反应控制的反萃速率的影响非常显著,而对于受扩散控制的反萃速率影响不明显。因此,根据阿伦尼乌斯公式求解的活化能(Ea)也可以用于判断控制步骤。当活化能小于20 kJ/mol,反萃过程受扩散控制;当活化能为20 ~42 kJ/mol,反萃过程受扩散和化学反应共同控制;当活化能大于42 kJ/mol,反萃过程受化学反应控制[19]。本小节研究了温度对铁离子反萃速率的影响,并通过阿伦尼乌斯公式求解了反应过程的表观活化能。实验条件:界面直径为6.0 cm,萃取剂中铁离子质量分数为0.61%,反萃时间为120 min,草酸质量浓度为60 g/L,搅拌转速为120 r/min,温度为303.15 ~333.15 K。
采用阿伦尼乌斯公式计算反萃过程的活化能:

将阿伦尼乌斯公式两端取对数:

以ln([Fe3+](O)/[Fe3+](t))对t做图并拟合,求得斜率k,再以lnk对1/T做图并拟合,结果如图5所示。
根据斜率计算出反应的活化能Ea为31.87 kJ/mol,介于20 ~42 kJ/mol,这表明反萃过程受扩散和化学反应共同控制。

图5 反应活化能的确定
2.2.4 小结
综合分析上述实验结果,S-15 萃取剂中铁离子的反萃过程属于扩散和界面化学反应共同控制。
2.3 反应级数的确定
铁离子的反萃速率表达式如式(8)所示:

式中:r为铁离子的反萃速率,g/(L·min);t为反应时间,min。
根据式(8),可以假设铁离子与草酸反应的动力学反应速率方程如下:

其中:kf代表正反应速率常数,kb代表逆反应速率常数,m、n 分别是正反应铁离子和草酸的反应级数,a、b是逆反应铁离子和草酸的反应级数。
笔者主要研究反萃初始阶段的动力学,可以忽略逆反应的影响,且由于草酸远远过量,可以忽略草酸浓度的变化,式(9)可以简化为:

式(10)两边同时取对数:
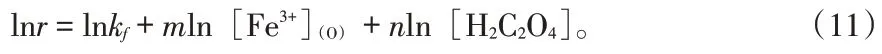
分别改变萃取剂中铁离子浓度和草酸浓度,获取铁离子的反萃速率r,再 以lnr 对ln[Fe3+](O)和ln[H2C2O4]分别做图,即可求出铁离子和草酸的反应级数。实验条件:界面直径为6.0 cm,搅拌转速为120 r/min,反萃温度为303.15 K。结果如图6所示。
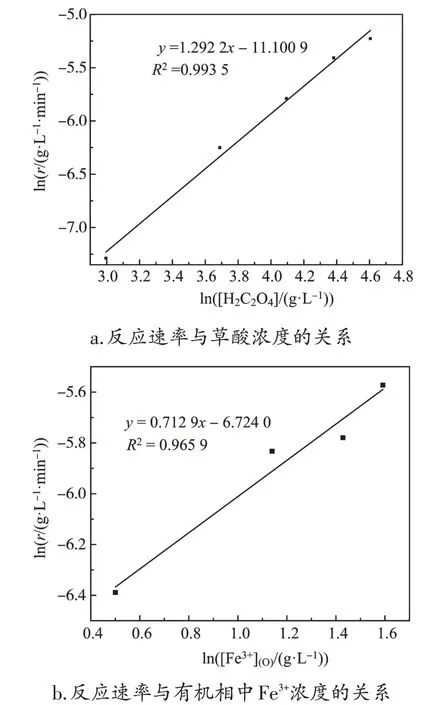
图6 反应级数的确定
从图6 可 知,m 为0.712 9,n 为1.292 2,因此,铁离子的反应级数为0.712 9 级,草酸的反应级数为1.292 2级。由图6所得拟合直线的截距求出lnkf的值分别为-12.01和-12.29,取平均值求出kf为5.29×10-5。因此,铁离子的反应速率方程为:
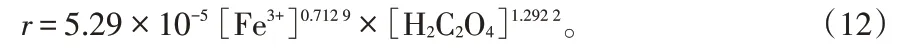
2.4 控制模型的推导
在2.2 节已推导出反萃过程受界面反应和扩散共同控制。根据双膜理论建立了如图7所示的反萃控制模型示意图。

图7 铁离子反萃过程示意图
图7中,[o,x]为液膜厚度,δ处为界面反应区,反萃过程可以分为以下5个步骤:(1)水相中草酸分子和有机相中铁离子分别向液膜处扩散;(2)草酸分子和有机相中铁离子穿过滞留层向界面处(反应区)扩散;(3)草酸分子和铁离子在反应区反应,生成草酸铁络合物和萃取剂分子;(4)草酸铁络合物和萃取剂分子穿过滞留层向液膜边界扩散;(5)草酸铁络合物和萃取剂分子穿过液膜边界层分别向水相和有机相主体扩散。
反萃过程可以用式(13)至(17)表示:
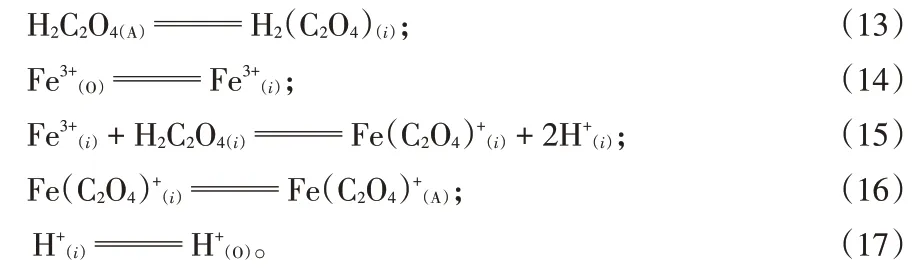
H2C2O4、Fe3+、Fe(C2O4)+、H+的传质速率方程可以用式(18)至(21)表示:
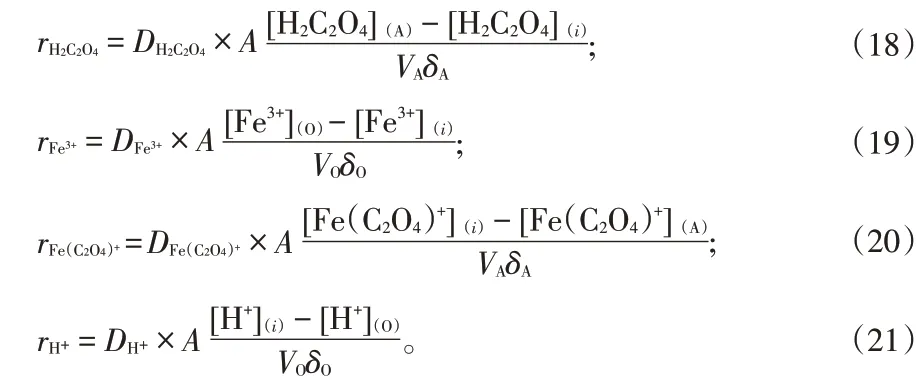
其中,D 代表传质系数,VA、VO分别代表水相和有机相体积,δA、δO分别代表水相和有机相处的滞留层厚度,下标i 代表界面处的物质浓度,A 表示恒截面池截面积。
由以上各式可以分别求出界面处各物质的浓度,如式(22)至(25)所示:

假设式(15)为速率控制步骤,反萃过程的速率方程可以写作式(26):
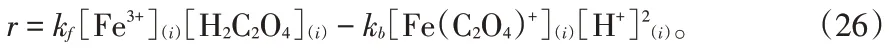
由于逆反应可以忽略,式(26)可以简化为:

联立式(27)、(22)、(23)得:
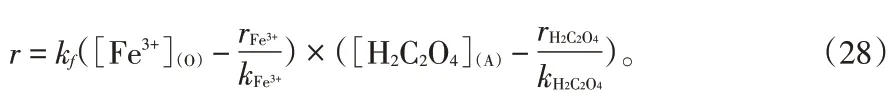
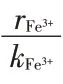

式(29)与2.3 节推导出的铁离子和草酸反萃级数基本吻合。因此,式(15)为速率控制步骤的假设是正确的。
3 结论
笔者采用恒界面池法获取了各实验条件下草酸中铁离子的浓度变化规律,求解出铁离子的反萃速率方程,推导出铁离子的反萃平衡方程、反萃级数和反萃速率表达式,确定了反萃过程的控制步骤,建立了反萃控制模型,主要得出以下结论:
(1)S-15 萃取剂中铁离子与草酸的反应方程式为:

(2)反萃对铁离子为0.712 9 级反应,对草酸为1.292 2级反应,铁离子的反萃速率表达式为:
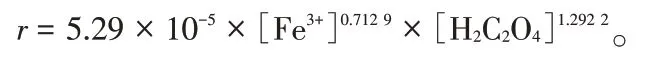
(3)当搅拌转速为50 ~120 r/min时,增大搅拌速率对铁离子反萃速率的影响并不明显;增大界面直径,铁离子反萃速率也随之增大;反应的表观活化能为31.87 kJ/mol,此时反萃过程受扩散和界面化学反应共同控制,反萃过程的速率控制步骤为: