腐乳来源乳酸菌的分离及其对斑马鱼生长发育的影响
2020-10-20王之怡陈怡然张美玲
王之怡, 钱 烨, 陈怡然, 许 蓉, 张美玲
(华东师范大学 生命科学学院, 上海200241)
益生菌是指被机体经过口服或其他方式摄入适当数量后,能够定植于宿主肠道改善微生态平衡,从而发挥有益作用的活菌。益生菌及其制剂已成为国内外研究的热点,被广泛应用于诸多领域[1]。
腐乳是中国特色的传统发酵食品,其中的益生菌也受到许多学者的关注。王夫杰等[2]曾报道在腐乳中分离得到了能够耐受10%盐度和5%酒精度的乳酸菌。邓加聪[3]曾报道从豆腐乳中分离获得一株具有广谱抑菌性能的乳杆菌,对短小杆菌、藤黄八叠球菌、甘薯病菌、大肠埃希菌和金黄色葡萄球菌这5种指示菌均有抑制活性。因此,发酵食品作为益生菌筛选的良好来源,具有一定的发掘潜力。
乳酸菌是较为常用的益生菌。目前,针对乳酸菌进行的体外研究发现,乳酸菌具有耐酸耐胆盐[4]、产生具有广谱的抑制真菌活性的抗菌肽[5]、吸附食品中的重金属[6]等功能。在此基础上,研究者们开展了乳酸菌在体的作用及机制探究,结果表明乳酸菌可以促进营养物质的吸收和代谢[7],提高宿主免疫能力[8],影响宿主肠道微生态平衡[9]等作用。关于乳酸菌对宿主行为发育的影响,以及宿主代谢与行为的关系探究还鲜有报道。
动物肠道内胆盐含量约为0.3%~0.5%[10],是典型的高胆盐环境。具备胆盐耐受能力提示着该菌株具有肠道定植潜能[11]。因此,本研究设计0.3%胆盐平板对分离得到的乳酸菌进行耐胆盐能力检测,以期得到一株能耐受动物肠道环境的乳酸菌进行进一步在体实验。
斑马鱼(Daniorerio)常用于胚胎发育[12]、脂肪积累[13]和毒理实验[14]等研究。近年来,斑马鱼模型也被广泛应用于益生菌的在体功能检测[15-16]。斑马鱼模型具有显著优点:1)斑马鱼早期胚胎透明,利于脂肪沉积情况的染色观察[17]和微生物在体实验的定植情况观察[18]。2)斑马鱼具有较强的繁殖能力,胚胎发育迅速,饲养条件简单。3)斑马鱼基因数据库较为完善,具有良好的研究基础。
本研究首先从腐乳中筛选获得乳酸菌,进行在体实验探究,检测菌株对实验动物营养代谢和运动摄食的影响,以期对腐乳中分离得到的乳酸菌菌株进行较为全面的功能评价。
1 材料与方法
1.1 材料
家庭自制腐乳,MRS肉汤培养基、MRS琼脂培养基、牛胆盐(杭州百思生物技术有限公司),细菌基因组DNA提取试剂盒(天根生化科技有限公司),DNA marker 2000 plus(TaKaRa),引物27 F:5′-AGAGTTTGATCCTGGCTCAG-3′、1492R:5′-TACCTTGTTACGACTT-3′,6×Loading Buffer,2×EasyTaqPCR SuperMix,琼脂糖,EB染液,ASP染液,尼罗红染液。
1.2 方法
1.2.1 腐乳中乳酸菌的富集与分离
取腐乳(FR)样品5 mL,1200 r/min离心1 min,取上清液1 mL稀释10倍。取稀释液1 mL加入100 mL MRS肉汤培养基,厌氧条件下37 ℃,200 r/min培养过夜,富集菌体。第二天,将菌液稀释104倍后取100 μL稀释液涂布在MRS固体培养基上,将培养皿置于厌氧环境中37 ℃倒置培养48 h,得到乳酸菌单菌落。
1.2.2 耐胆盐乳酸菌的筛选
利用影印平板法的原理,用牙签挑取MRS固体培养基上形成的乳酸菌单菌落,分别接种到MRS平板以及含有0.3%牛胆盐的MRS平板的相同位置上,每个菌落设置2个平行。将培养皿置于厌氧环境中37 ℃倒置培养48 h。
1.2.3 DNA的提取与16S rDNA的扩增
利用细菌基因组DNA提取试剂盒(DP302)提取耐胆盐菌株的DNA,并以其作为模板,PCR扩增其16S rDNA的片段,PCR体系为6 μL DNA模板,30 μL 2×EasyTaqPCR SuperMix,6 μL上下游引物(5 μmol/μL),扩增体系为60 μL。
1.2.4 16S rDNA鉴定和进化树的构建
将PCR产物用1%琼脂糖进行凝胶电泳,并送至上海美吉生物公司进行测序。测序得到的乳酸菌16S rRNA基因序列使用DNAMAN 8软件进行拼接后,与NCBI数据库进行比对,初步确定筛选得到的乳酸菌的种类。
将测序结果和数据库中的参比菌株序列使用MEGA-X软件,利用邻近法(Neighbor-Joining method)构建系统进化树,进一步确定筛选得到的乳酸菌与其参比菌株之间的进化关系,同时进行100次Bootstrap自举法检验进化树分支的可信度。
1.2.5 斑马鱼幼鱼的饲养
选取野生型斑马鱼中性成熟且生长状况良好、规格均匀的雌雄鱼,使其自由交配,收取鱼卵当天记为第0天。将鱼卵以合适密度(每皿50~100条)放入盛有卵水的培养皿中孵化,分为对照组(除每天半定量更换卵水外,不额外添加其他物质,Control组),低浓度处理组(水体加菌终浓度为104cfu/mL,FR27-4组),高浓度处理组(水体加菌终浓度为105cfu/mL,FR27-5组)。培养皿放于28 ℃恒温光照培养箱中,每天用新鲜卵水半定量换水,并吸走卵壳和死卵。待斑马鱼幼鱼生长到5 dpf(days post fertilization,dpf)后,开始喂食草履虫液和蛋黄液,待斑马鱼幼鱼生长到10 dpf后,改喂丰年虫。
乳酸菌添加方式:每天取乳酸菌菌液于离心管中1200 r/min离心1 min后去上清,根据平板计数结果,往菌体中加入相应量的卵水重悬后加入对应组。乳酸菌从0 dpf开始每天在换水后添加直至实验结束,每隔7 d重新进行计数。
卵水配方:11 L 超纯水中加入 16.5 mL 海盐溶液和 100 μL 亚甲基蓝。
1.2.6 斑马鱼卵孵化率的测定
分别统计0 dpf各组中初始斑马鱼卵数和3 dpf孵出的斑马鱼幼鱼数,计算各组斑马鱼卵的孵化率,计算公式如下:
孵化率(%)= (3 dpf存活幼鱼数/0 dpf 鱼卵数)×100%
1.2.7 斑马鱼幼鱼的平均体长比较
使用 Image J软件对斑马鱼幼鱼的荧光显微镜白光照片进行体长的测量统计。
1.2.8 斑马鱼幼鱼脂肪沉积的测定
将实验用鱼置于12孔板中,每孔5条。吸干每孔中的水,在避光条件下加入2 mL尼罗红工作液,没过鱼体。避光染色30 min,随后每隔30 min用卵水洗涤2次,共洗涤8次。将实验用鱼置于荧光显微镜下以绿色激发光观察并拍照记录(曝光时间为200 ms),利用Image J软件测量统计荧光面积。
1.2.9 斑马鱼幼鱼的摄食实验
取50 mL草履虫培养液,加入5 μL ASP染料避光染色1 h,用500目滤网过滤。将实验用鱼置于12孔板中,每孔5条。每孔加入2~3 mL上述草履虫饵料,放置于28 ℃的培养箱中避光1 h。将实验用鱼置于荧光显微镜下以蓝色激发光观察并拍照记录(曝光时间为5 s),利用Image J软件测量统计荧光面积。
1.2.10 斑马鱼幼鱼的行为学实验
取不同组相同日龄斑马鱼幼鱼各5条置于24孔板中,每孔1条。将24孔板置于Zebrabox及ZebraLab系统中,记录其每分钟运动情况,实验持续24 h,利用Microsoft Excel软件对其行动距离进行分析计算并制得图表。其中,小于3 mm/s为低速运动;3~8 mm/s为中速运动;大于8 mm/s为高速运动。
1.2.11 数据统计分析
用GraphPad Prism 6软件对实验数据进行独立样本t检验(t-test), 分析比较处理组与对照组的差异,P<0.05代表有显著性差异。“*”为P<0.05, “**”为P<0.01, “***”为P<0.001。
2 结果与分析
2.1 耐胆盐乳酸菌的分离筛选、16S rDNA鉴定及进化树构建
从腐乳中成功分离纯化出一株耐胆盐乳酸菌,编号为FR27。经测序比对后发现,FR27与植物乳杆菌LactobacillusplantarumNG3(KR107060.1)相似度达99.52%。构建进化树(图1)显示,FR27在进化上与LactobacillusplantarumNG3的关系最近,同时与其他几株Lactobacillusplantarum的遗传距离都较近,但与同为乳酸菌的Enterococcusfaecium和Pediococcuspentosaceus的遗传距离相对较远,因此可以判断FR27属于Lactobacillusplantarum。
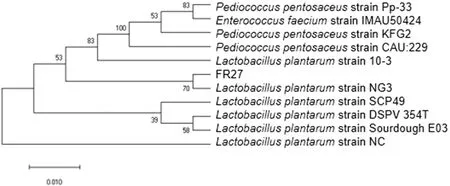
图1 FR27系统进化树
2.2 FR27对斑马鱼幼鱼生长发育的影响
2.2.1 FR27对斑马鱼卵孵化率的影响
为了判断FR27对斑马鱼是否安全,同时探究其对鱼体发育的影响,统计各组斑马鱼卵孵化率,结果如图2所示。与对照组相比,FR27-4组的孵化率无显著差异(P=0.0611),FR27-5组的孵化率显著提高(P<0.05),表明FR27对鱼体是安全的,同时在一定程度上能促进斑马鱼卵的发育成熟。
2.2.2 FR27对斑马鱼幼鱼体长的影响
通过统计相同日龄各组斑马鱼的平均体长来探究FR27对幼鱼生长的影响。由图3可知,FR27的添加对斑马鱼幼鱼生长存在一定促进作用,且该作用效果随菌液浓度的增加而增强。其中,FR27-4组的平均体长显著大于对照组(P<0.05),FR27-5组平均体长增加极为显著(P<0.001)。

图2 不同浓度FR27菌液处理后斑马鱼卵孵化率(n=5)

图3 相同日龄各组斑马鱼幼鱼体长(n=5)
2.2.3 FR27对斑马鱼幼鱼脂肪沉积的影响
图4显示了FR27对斑马鱼幼鱼脂肪沉积的影响,低浓度组的脂肪沉积较对照组无显著差异(P=0.0747),高浓度组的脂肪沉积显著增加(P<0.01)。该结果表明在相同投喂条件下,FR27可促进斑马鱼幼鱼的脂肪沉积,但菌液浓度需达到较高水平才会表现出显著效果。
图4中a、b和c分别表示对照组、FR27-4组和FR27-5组。1、2列分别表示白光下斑马鱼幼鱼的形态图以及使用Image J软件得到的荧光分布图。d图为不同组斑马鱼幼鱼腹部荧光面积的统计图(n=5,a、b和c中每组选取3条以作展示)。
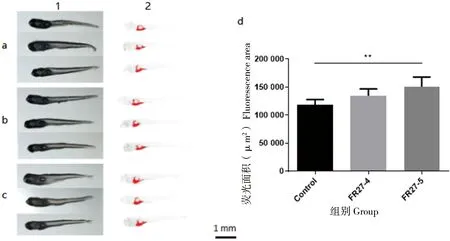
图4 不同浓度FR27菌液处理后斑马鱼幼鱼的尼罗红染色情况
2.3 FR27促进斑马鱼幼鱼生长发育的原因探究
2.3.1 FR27对斑马鱼幼鱼摄食能力的影响
为进一步探究FR27处理组的脂肪沉积高于对照组的原因,检测相同时间内各组斑马鱼的摄食量。由图5可知,FR27可提高斑马鱼幼鱼的摄食能力,且高浓度组表现更显著。其中,FR27-4组的消化道荧光面积显著大于对照组(P<0.05),FR27-5组与对照组相比差异极为显著(P<0.001)。
图5中a、b和c分别表示对照组、FR27-4组、FR27-5组。1、2列分别表示白光下斑马鱼幼鱼的形态图、曝光时间为5 s拍摄的斑马鱼幼鱼摄食带荧光的草履虫1 h后荧光显微镜下图。d图为不同组斑马鱼幼鱼消化道荧光面积的统计结果(n=5,a、b和c中每组选取3条以作展示)。
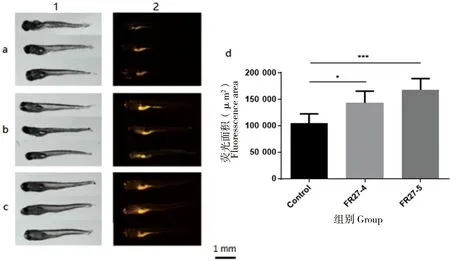
图5 不同浓度FR27菌液处理后斑马鱼幼鱼的摄食情况
2.3.2 FR27对斑马鱼幼鱼运动能力的影响
对斑马鱼幼鱼进行24 h的行为监测,探究不同组斑马鱼幼鱼摄食能力表现出明显差异的原因,结果如图 6所示。从图 6-a中可以看出,在白天FR27-5组斑马鱼幼鱼的运动距离大于FR27-4组,且FR27处理组都大于对照组,而在夜晚3组斑马鱼幼鱼的运动距离无差异;从图 6-b中可见,在高速运动中,FR27处理组的运动距离与对照组相比均表现出显著性差异(FR27-4组:P<0.01;FR27-5组:P<0.001)。同时,FR27-5组低速运动距离也显著大于对照组(P<0.05)。这说明FR27的添加能够提高斑马鱼幼鱼的运动能力,且随菌液浓度的增加,该作用效果增强。
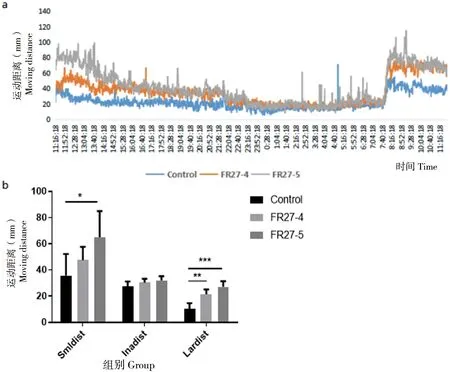
a:24 h内各组斑马鱼幼鱼的行动距离图。b:24 h内各组斑马鱼幼鱼每分钟以不同速度运动的平均运动距离统计,其中Smldist表示每分钟以低速运动的平均运动距离;Inadist表示每分钟以中速运动的平均运动距离;Lardist表示每分钟以高速运动的平均运动距离(n=5)
3 讨论
在现有的乳酸菌研究中,研究者们主要从泡菜[11]、传统发酵酸奶[19]和健康动物新鲜粪便样品[20]等来源分离筛选得到具有不同功能的乳酸菌。发酵食品腐乳作为乳酸菌的来源虽已引起关注,但目前主要集中于离体性质研究,对腐乳来源乳酸菌的在体作用尚无报道。本研究成功地从腐乳中筛选得到一株耐受0.3%胆盐的乳酸菌菌株FR27,通过基因测序比对后发现FR27是一株植物乳杆菌(Lactobacillusplantarum)。Oguntoyinbo和Narbad[21]曾报道在非洲发酵谷物中分离得到一株具有耐胆盐能力的LactobacillusplantarumULAG24,其具有竞争性排除体外培养的HT29细胞系中SalmonellaentericaLT2的能力,且能刺激BALB/c小鼠免疫因子IFN γ和IL10的产生,这提示着植物乳杆菌Lactobacillusplantarum对动物体的健康具有一定潜在作用。
为了进一步探究分离筛选得到的FR27对斑马鱼生长发育的影响,将不同浓度的FR27以浸泡方式添加至斑马鱼受精卵孵育的水环境中,随后进行了一系列在体功能实验。结果表明,FR27能促进斑马鱼受精卵孵化(图 2)。目前,关于益生菌的添加提高动物受精卵孵化能力的研究多在家禽中开展,Mazanko等[22]曾发现:芽孢杆菌益生菌补充剂能提高鸡蛋孵化率。在水生动物领域,相关研究还鲜有报道。此外,FR27能显著增加幼鱼体长(图 3),该结果与黄坤鹏[23]使用鱼源克劳氏芽孢杆菌Bacillusclausii在石斑鱼幼鱼上开展的实验结果一致。同时,FR27的作用效果随水体菌浓度的增加而更为显著。FR27的添加还能增加斑马鱼幼鱼的脂肪沉积,高浓度组表现出显著性差异(图 4)。益生菌对动物体脂肪沉积及体重的影响一直以来都饱受争议,在一项健康足月婴儿中开展的人体实验中发现[24],与安慰剂组相比,益生菌服用组的体重会显著增加。但在益生菌对畜禽作用的研究结果中发现[25-27],益生菌的添加可以增加畜禽个体的大小、体重以及瘦肉比例,但不能增加脂肪沉积,甚至可能降低胴体脂肪率,这与本研究结果相悖。为了探究FR27促进脂肪沉积的原因,对斑马鱼幼鱼的摄食能力和行为能力进行进一步检测后发现:FR27能提高斑马鱼幼鱼的摄食和运动能力,同时也表现出浓度效应(图 5和图6)。关于乳酸菌能够提高鱼体的运动能力这一观点与Phelps等[28]在2017年发表的研究结果一致,他们对无菌斑马鱼模型进行早期微生物的接种后发现10 dpf实验组的运动能力大于对照组,他们认为微生物的定植是斑马鱼神经行为正常发育的必要条件。本研究结果表明,一定浓度的乳酸菌添加能提高幼鱼的摄食和运动能力,从而进一步促进斑马鱼幼鱼的生长发育和脂肪沉积,这一研究结果也提示:在探究益生菌对宿主生长发育的影响时,摄食量是需要考量的主要指标之一。
外源乳酸菌对鱼体作用机制原因较多。早期的研究认为,外源乳酸菌可以通过定植在鱼类肠道使乳酸菌数量增加来发挥作用[29]。随后的研究发现,外源乳酸菌还可通过调节宿主肠道菌群结构进而产生一定效应。陈营等[30]发现外源乳酸菌的添加使牙鲆(Paralichthysolivaceus)稚鱼肠道中形成酸性环境,进而对弧菌的增殖产生拮抗。王静等[31]也指出,外源乳酸菌通过与宿主消化道正常菌群互相作用,进一步参与动物生长发育和营养物质消化吸收过程。还有研究指出,外源乳酸菌对宿主的作用机制表现在:将复杂的碳水化合物发酵成为乳酸或挥发性脂肪酸,促进宿主对营养物质的消化吸收并进一步产生促生效应[32]。本研究中发现,外源乳酸菌的添加可以显著促进斑马鱼的生长发育和脂肪沉积,并增强摄食和运动能力,但是具体作用机制尚不清楚,有待进一步探讨。
益生菌的开发在动物营养学研究中受到越来越多科学研究者及产业从业人员的关注,但是目前大多数益生菌筛选主要关注抑菌活性,对于益生菌促进动物体发育和代谢的研究,主要集中在益生菌对动物体的体重[33-34]和消化酶活性的影响[35-37],对于益生菌促进动物摄食与行为,及其与生长发育的关系探究还鲜有报道。本研究对未来开发动物用益生菌制剂、评估益生菌功能提供了技术平台。通过本研究将动物行为及动物营养代谢特征相关联,为启发后续动物体生长代谢研究提供新的思路。
