烟碱偏好模型不同阶段大鼠海马组织中23 种细胞因子水平的变化
2020-10-20程皖燕王红娟付亚宁侯宏卫胡清源
程皖燕,王红娟,陈 欢,付亚宁,王 安,刘 勇,侯宏卫,胡清源*
1. 安徽大学物质科学与信息技术研究院,合肥市经济开发区九龙路111 号 230601 2. 国家烟草质量监督检验中心,郑州高新技术产业开发区翠竹街6 号 450001 3. 中国科学院合肥物质科学研究院,合肥市蜀山湖路350 号 230031
烟碱是一种具有较强致瘾性的物质,存在于烟草制品中[1]。烟碱偏好与大脑内奖赏和决策等神经生物学系统密不可分。烟气能够抑制免疫系统发挥作用,烟碱作为烟气中的主要成分之一,可能通过中枢神经系统影响免疫系统[2]。然而,近些年的一些研究表明烟碱可能是一种具有抗炎作用的“消炎药”,对脓血症等炎症疾病具有缓和作用[3]。但目前针对烟碱与神经炎症相关作用的研究还较少。
海马组织是与学习记忆相关的标志性脑区[4],分布了大量的小胶质细胞,能够对中枢神经系统损伤做出反应,释放大量细胞因子。有报道称烟碱能够通过激活免疫细胞上的α7 烟碱乙酰胆碱受体(Nicotinic acetylcholine receptor,nAChR)减少促炎症细胞因子的产生,进而改善神经退行性疾病的认知功能,发挥神经保护作用[5-6]。细胞因子是一种主要由神经元和胶质细胞分泌并具有广泛生物活性的小分子蛋白质[7],主要包括白细胞介素、趋化因子和其他与炎症反应相关的细胞因子等。其中白细胞介素类细胞因子在传递信息、激活与调节免疫细胞和介导炎症反应中发挥重要作用,其中,白细胞介素(Interleukin,IL)-1α、IL-5、IL-6、IL-10 和IL-18 水平与烟碱摄入密切相关,有文献报道称吸入烟碱会导致肺部IL-1αmRNA 水平上调[8],刺激人内皮细胞表达IL-6[9],或者抑制过敏原诱导的肺部IL-5 水平升高[10]等。趋化因子是一类能够介导神经炎症并且在神经系统生理学包括神经元迁移、细胞增殖以及突触活动中发挥重要作用的细胞因子,其中生长相关癌基因/角细胞趋化(Growth-related oncogene/keratinocyte chemoattractant,GRO/KC)、巨噬细胞炎性蛋白(Macrophage inflammatory protein,MIP)-1α和受激活调节正常T 细胞表达和分泌因子(Regulated upon activation normal T cell expressed and secreted factor,RANTES)是3 种较为常见的趋化因子,文献报道机体炎症反应会导致这3 种趋化因子水平显著升高(p<0.05)[11-13]。此外,肿瘤坏死因子α(Tumor necrosis factorα,TNF-α)在炎性反应和免疫应答中也发挥了重要作用[14-15]。条件位置偏好(Conditioned place preference,CPP)是药物研究中广泛使用的动物嗜好性评价模型,目前建立CPP获得模型的烟碱剂量主要在0.06~0.80 mg/kg 范围内。为全面探究烟碱对神经炎症的作用,本研究中采用文献范围内低和较高的烟碱剂量即0.2 和0.6 mg/kg 分别构建了大鼠CPP 获得、消退和重建模型,应用Bio-Plex 悬液芯片技术考察了两种烟碱剂量下不同给药阶段大鼠海马组织中23 种炎症相关细胞因子水平的变化,旨在为研究物质偏好不同阶段神经系统中细胞因子表达变化提供方法参考。
1 材料与方法
1.1 材料、试剂和仪器
大鼠[SPF 级,郑州大学基础医学院,许可证号:SCXK(豫)2015-0004]。
烟碱(国家烟草质量监督检验中心提供);生理盐水(河南科伦药业有限公司);水合氯醛(扬州奥鑫助剂公司);Western 及IP 细胞裂解液(上海碧云天生物技术有限公司);蛋白浓度测定试剂盒(美国Thermo 公司);23 种细胞因子检测试剂盒(美国Bio-Rad 公司),23 个细胞因子分别为粒细胞集落刺激因子(Granulocyte colony stimulating factor,G-CSF),粒细胞巨噬细胞集落刺激因子(Granulocyte-macrophage colony stimulating factor,
GM-CSF),GRO/KC,干扰素g(Interferon gamma,IFN-g),IL-1α,IL-1β,IL-2,IL-4,IL-5,IL-6,IL-7,IL-10,IL-12p70,IL-13,IL-17A,IL-18,单核细胞趋化 蛋 白 1(Monocyte chemoattractant protein-1,MCP-1),巨噬细胞集落刺激因子(Macrophage colony-stimulating factor,M-CSF),MIP-1α,MIP-3α,RANTES,TNF-α,血管内皮细胞生长因子(Vascular endothelial growth factor,VEGF)。
RD1111-CPP 装置(上海多毅实业有限公司,合格证号:DOiTCPP20160226004);JXFSTPRP-48组织研磨仪(上海净信实业发展有限公司);3-30K 台式高速冷冻离心机(美国Sigma 公司);ULT2586-6-W48 冰箱(-80 ℃,美国Thermo 公司);SpectraMax®M5 多功能酶标仪(美 国Molecular Devices 公司);Bio-Plex 200 蛋白质悬液芯片机(美国Bio-Rad 公司)。
1.2 方法
1.2.1 大鼠烟碱CPP 获得、消退和重建模型的建立
(1)实验动物的选择:选择约7 周龄,体质量为(200±20)g 的SD 雄性大鼠,实验开始前进行为期5 d 的CPP 基准值测试,根据测试结果剔除在白箱中停留时间超过在黑箱、白箱和中间箱中停留总时间50%及不足10%的大鼠。
(2)CPP 获得阶段:筛选大鼠并随机分为4 组,3 组实验组共18 只,1 组对照组共6 只。以皮下注射的方式对大鼠进行给药,对实验组在奇数日给烟碱,在偶数日给生理盐水;对对照组均注射生理盐水,每两天为一个给药周期。在较长时间的烟碱作用下即第7 次给药周期后成功构建大鼠烟碱CPP 获得模型,第7 次测试后从实验组中随机选6只大鼠,处死并取出海马组织于-80 ℃保存。
(3)CPP 消退阶段:每天对实验组剩余大鼠和对照组大鼠仅注射生理盐水。戒断4 d 后实验组大鼠的烟碱偏好消除,第4 天测试后从实验组剩余大鼠中随机选6 只大鼠,处死并取出海马组织于-80 ℃保存。
(4)CPP 重建阶段:对剩余实验组大鼠注射烟碱,次日注射生理盐水,仍以2 d 为一个给药周期,对照组则每天只注射生理盐水。仅3 次给药周期即相对短时间的烟碱作用后将剩余大鼠处死,并取出海马组织于-80 ℃保存。
1.2.2 海马组织总蛋白提取
向海马组织中加入组织裂解液,用组织匀浆机将组织打碎,4 ℃条件下放置0.5~1.0 h,离心7 min(10 000 r/min,4 ℃),吸取上清液,于-80 ℃保存。
1.2.3 蛋白浓度测定
使用PierceTMBCA Protein Assay Kit 测定蛋白浓度[16]。
1.2.4 样品检测
将已处理的蛋白样本从-80 ℃冰箱中取出,用样品稀释液将蛋白样品稀释8倍。应用蛋白悬液芯片检测烟碱给药不同阶段23种细胞因子的水平[17]。
1.2.5 数据处理
通过IBM SPSS Statistics 21 软件分别对0.2 和0.6 mg/kg 烟碱剂量下CPP 获得、消退和重建阶段23 种细胞因子的表达量进行单因素方差分析(One-way analysis of variance,ANOVA),p<0.05 表示组间具有显著性差异。采用Graphpad prism 6 软件展示不同阶段存在显著差异的细胞因子水平的变化趋势。
2 结果与讨论
2.1 23 种细胞因子表达量检测结果
以0.2 和0.6 mg/kg 烟碱剂量分别成功构建大鼠CPP 获得、消退和重建模型,通过Bio-Plex 悬液芯片技术对两种烟碱剂量下生理盐水对照组,以及CPP 获得、消退和重建共4 组大鼠海马中23 种细胞因子水平同时进行了检测。检测结果显示:IL-4、MIP-3α、G-CSF 和VEGF 这4 种细胞因子的水平低于最低检测限,其他19 种细胞因子的检测结果如表1 所示。通过对生理盐水对照组,以及CPP 获得、消退和重建组大鼠海马中19 种细胞因子的表达量进行ANOVA 分析,发现任意两组间IL-1β、IL-2、IL-7、IL-12p70、IL-13、IL-17A、MCP-1、M-CSF、GM-CSF 和IFN-g 共10 种细胞因子水平均无显著差异(p>0.05),不同组间IL-1α、IL-5、IL-6、IL-10、IL-18、GRO/KC、MIP-1α、RANTES 和TNF-α共9 种细胞因子有显著差异(p<0.05)。将本实验结果与文献中有报道的细胞因子水平进行比较,发现文献报道生理盐水处理组大鼠海马中IL-1α、IL-6 和IL-18 水平分别在30、500 和3 500 pg/mL 左右[18],未经任何处理大鼠海马中IL-1β和TNF-α水平分别在60 和400 pg/mL 左右[19],与本实验检测结果基本一致。
2.2 差异表达的细胞因子
9 种有显著差异表达的细胞因子主要包括白细胞介素、趋化因子和其他细胞因子,以下分别将0.2 和0.6 mg/kg 烟碱剂量下,CPP 获得、消退和重建阶段9 种细胞因子的表达量进行分类分析。
2.2.1 白细胞介素
图1 所示分别为两种烟碱给药剂量下,5 种有显著差异表达的白细胞介素在烟碱偏好模型不同阶段的变化趋势。其中图1a~图1e 分别表示白细胞介素IL-1α、IL-5、IL-6、IL-10、IL-18 的变化趋势。
如图1a 所示,在0.2 mg/kg 给药剂量下,CPP 获得、消退和重建阶段IL-1α水平分别有升高、下降和升高的变化趋势,其中消退和重建阶段IL-1α水平均显著低于获得组(p<0.05);在0.6 mg/kg 给药剂量下,3 个阶段IL-1α水平分别有升高、下降和持续下降的变化趋势,其中重建组IL-1α水平显著低于获得组(p<0.05)。根据文献[20]报道,IL-1α具有神经保护作用,在10、25 和50 ng/mL 的IL-1α作用下,小鼠胚胎皮层细胞存活率显著升高(p<0.05)。在本研究中的烟碱给药剂量下,烟碱能够促进IL-1α的表达,在一定程度上可能具有神经保护作用,但在戒断后该作用消失。此外,在低烟碱剂量下重建烟碱嗜好模型,可以恢复烟碱对IL-1α表达的促进作用;而较高剂量下重建烟碱嗜好模型,不可逆转戒断对IL-1α水平的影响。
表1 烟碱偏好模型不同阶段19 种细胞因子的表达量(±s)Tab.1 Expression of 19 cytokines at different stages of nicotine preference model

表1 烟碱偏好模型不同阶段19 种细胞因子的表达量(±s)Tab.1 Expression of 19 cytokines at different stages of nicotine preference model
0.2 mg·kg-1 0.6 mg·kg-1对照组16.35±3.58 51.84±2.21 726.13±423.22 28.62±5.03 3 446.33±170.40 30.30±13.21 13.21±2.34 34.29±8.55 461.47±16.70 604.63±516.61 44.37±38.78 73.27±30.91 28.17±17.26 91.04±131.99 65.99±31.90 51.44±37.70 2.94±0.81 12.92±8.75 120.53±58.52 IL-1α IL-5 IL-6 IL-10 IL-18 GRO/KC MIP-1α RANTES TNF-α IL-2 IL-1β IL-17A IL-7 IL-12p70 IL-13 MCP-1 M-CSF GM-CSF IFN-g获得21.02±7.27 52.69±2.21 664.58±217.58 33.80±13.83 3 323.29±149.14 16.71±6.68 15.38±6.28 26.17±6.88 449.87±34.22 441.60±187.30 39.21±58.15 52.82±10.84 25.15±6.14 36.88±45.89 68.43±63.11 38.08±24.56 3.58±1.72 6.78±4.55 93.68±11.32消退15.03±3.63 54.26±0.98 624.10±161.95 35.05±10.42 3 259.92±163.24 23.22±12.22 9.89±4.12 28.72±7.23 460.17±49.22 438.10±145.02 21.91±24.73 69.09±11.99 22.52±9.19 81.66±45.77 65.86±9.83 39.30±33.97 1.61±2.07 8.13±3.32 89.61±12.68重建15.58±1.53 52.64±1.57 621.79±94.02 37.48±10.38 3 359.65±118.30 17.26±12.25 12.80±1.55 23.55±4.48 514.06±72.17 450.53±228.29 12.04±22.81 57.33±6.508 18.85±7.25 41.13±24.50 67.39±14.22 33.71±27.52 1.19±1.37 5.55±6.01 94.13±15.05获得19.25±2.36 54.54±2.22 667.99±102.68 33.89±7.49 3 319.87±124.87 14.46±7.20 14.76±3.51 33.58±5.95 489.72±71.56 497.55±191.99 55.88±31.52 71.29±17.45 26.84±8.88 92.20±49.82 87.52±15.15 34.79±40.42 4.66±1.49 11.93±4.98 100.18±15.70消退17.12±1.85 53.35±2.07 600.57±261.49 36.84±6.61 3 376.23±202.28 18.76±10.69 12.98±3.16 30.67±3.66 473.02±46.93 504.23±242.45 67.46±29.62 79.85±15.66 27.76±4.70 83.92±32.41 79.18±30.13 46.01±33.50 2.29±1.345 12.00±5.62 93.01±13.36重建14.74±2.64 51.45±3.61 518.26±120.80 27.90±6.40 3 366.43±81.74 14.30±3.26 11.10±2.63 24.91±4.824 452.92±35.06 369.99±90.63 19.67±22.26 58.59±9.80 20.51±5.13 53.19±15.01 66.35±17.37 16.79±28.17 2.15±1.873 8.09±3.19 92.79±9.30

图1 烟碱偏好模型不同阶段5 种白细胞介素水平变化Fig.1 Variations of five interleukins’levels at different stages of nicotine preference model
如图1b 所示,在0.2 mg/kg 给药剂量下,CPP 获得、消退和重建阶段IL-5 水平分别有升高、持续升高和下降的变化趋势,其中,消退阶段IL-5 水平显著高于对照组(p<0.05);在0.6 mg/kg 给药剂量下,3 个阶段的IL-5 水平均与对照组无显著差异(p>0.05)。IL-5 是调节造血细胞产生及活性的细胞因子,IL-5 的生物学活性在机体稳态条件下作用不大,而在紧急造血和免疫应答中起关键作用,通常在感染和免疫过程中大量产生[21],Tilp 等[10]证实过敏原能够诱导肺部中IL-5 的水平升高。目前针对IL-5 的研究集中于一些以嗜酸性粒细胞为主要免疫效应细胞的疾病中,主要考察其在支气管中水平的变化,在脑部的研究较少。从本研究中可以发现,低和较高剂量烟碱摄入均不会诱导IL-5的过表达,大鼠海马组织未产生免疫应答反应。此外,在低剂量烟碱下,戒断会影响海马组织区稳态,引起IL-5 水平升高,可以通过再次给烟碱恢复。
如图1c 所示,在0.2 mg/kg 给药剂量下,CPP 获得、消退和重建阶段IL-6 水平分别有下降、持续下降和不变的趋势,其中,消退阶段IL-6 水平显著低于对照组(p<0.05);在0.6 mg/kg 给药剂量下,3 个阶段IL-6 水平持续保持下降,且消退和重建阶段IL-6 水平均显著低于对照组(p<0.05)。IL-6 是一种兼促炎和抗炎双重作用的细胞因子[22],在慢性炎性疾病中,IL-6 主要发挥促炎作用。Bao 等[23]研究表明烟碱能够抑制脂多糖(Lipopolysaccharide,LPS)诱导的促炎因子IL-6 的表达,从而发挥抗炎作用。还有研究表明,海马组织中神经元的坏死与脑脊液中IL-6 水平上升有关[24],烟碱能够通过抑制促炎因子IL-6 的表达发挥心肌保护作用[25]。本研究结果表明,低和较高剂量烟碱均不会诱导大鼠海马中IL-6 的表达升高而产生炎症反应;相反,在烟碱偏好模型的不同阶段,IL-6 的表达量均有不同程度的下降趋势,提示烟碱可能通过抑制促炎因子IL-6 的表达,从而发挥神经保护作用。
如图1d 所示,在0.2 mg/kg 给药剂量下,CPP 获得、消退和重建阶段IL-10 水平有持续升高的趋势,但与对照组相比均无显著差异(p>0.05);在0.6 mg/kg 给药剂量下,3 个阶段IL-6 水平分别有升高、持续升高和下降的趋势,其中消退阶段IL-10水平显著高于对照组(p<0.05)。IL-10 是一种具有抗炎作用的细胞因子,主要是通过抑制巨噬细胞和树突状细胞将抗原呈递给T、B 淋巴细胞且抑制其产生促炎症因子,减少过度和失控的炎症效应造成的组织损伤[26]。目前有研究表明中枢神经系统(Central nervous system,CNS)中IL-10 的表达增加,发挥抗炎作用,有助于大脑炎症恢复[27],Li等[28]发现芒柄花黄素通过刺激大脑皮层中IL-10的表达抑制炎症反应,发挥神经保护作用。此外,IL-10 能够通过平衡体内促炎因子水平发挥抗炎作用[23]。本研究中发现低和较高剂量烟碱能够促进IL-10 的表达,在一定程度上可能具有神经保护作用,在较高剂量下,戒断后可能引起机体应激反应过表达IL-10;随后继续给烟碱,应激反应消失,IL-10 水平恢复,与对照组无显著差异(p>0.05)。
如图1e 所示,在0.2 mg/kg 给药剂量下,CPP 获得、消退和重建阶段IL-18 水平分别有下降、持续下降和升高的变化趋势,其中消退阶段IL-18 水平显著低于对照组(p<0.05);在0.6 mg/kg 给药剂量下,3 个阶段IL-18 水平分别有下降、升高和下降的变化趋势,每一阶段IL-18 水平均与对照组无显著差异(p>0.05)。IL-18 是一种促炎症细胞因子,有研究表明100 ng/mL IL-18 能够有效抑制海马组织的长时程增强(Long-term potentiation,LTP),对学习和记忆形成产生影响[29]。Bossù等[30]报道LPS通过促进海马组织中IL-18 的过表达,抑制神经元细胞的分化或诱导其死亡,引起持续性认知障碍,针对阿尔兹海默症(Alzheimer’s disease,AD)的研究表明1 和10 μmol/L 烟碱均能显著增强神经元细胞的活力,发挥神经保护作用[31]。此外,抑制IL-18的表达可抑制全身性炎症反应[32]。本研究结果表明,低和较高剂量烟碱能够抑制IL-18 的表达,在一定程度上可能具有神经保护作用;此外,低剂量下戒断后可能会产生代偿性适应,引起大鼠海马中IL-18 水平持续下调,并随着烟碱的再摄入而消失。
2.2.2 趋化因子
图2 所示分别为两种烟碱给药剂量下,3 种有显著差异表达的趋化因子在烟碱偏好模型不同阶段的变化趋势。其中图2a~图2c 分别表示趋化因子GRO/KC、MIP-1α和RANTES 的变化趋势。
如图2a 所示,在0.2 mg/kg 给药剂量下,CPP 获得、消退和重建阶段GRO/KC 水平分别有下降、升高和下降的变化趋势;在0.6 mg/kg 给药剂量下,3个阶段GRO/KC 水平变化趋势同0.2 mg/kg 剂量,并且趋势更为明显,每一阶段GRO/KC 水平均显著低于对照组(p<0.05)。GRO/KC 作为促炎症因子,参与多种炎症类疾病发生,背根神经节局部发生炎症会导致GRO/KC 的表达大幅度上调[33]。Smith 等[34]表明LPS 能够促进大鼠肺泡灌洗液中GRO/KC 的表达。此外,GRO/KC 与人体中IL-18的作用相似,有研究中将烟碱和LPS 共同作用于人的气道上皮细胞系HBE16 细胞,发现烟碱能显著减少LPS 诱导的IL-18 蛋白的表达(p<0.05),具有一定的抗炎功能[35]。本研究中发现低和较高剂量烟碱均可能通过抑制炎症反应诱导的GRO/KC水平的升高发挥抗炎作用,戒断后抑制作用减弱,并且可通过再次给烟碱而恢复;较高剂量烟碱构建模型时,该作用比低剂量烟碱构建模型时更为明显。

图2 烟碱偏好模型不同阶段3 种趋化因子水平变化Fig.2 Variations of three chemokines’levels at different stages of nicotine preference model
如图2b 所示,在0.2 mg/kg 给药剂量下,CPP 获得、消退和重建阶段MIP-1α水平分别有升高、下降和升高的变化趋势,其中消退和重建阶段MIP-1α水平均显著低于获得阶段(p<0.05),重建阶段MIP-1α水平显著高于消退阶段(p<0.05);在0.6 mg/kg 给药剂量下,3 个阶段MIP-1α水平分别有升高、下降和持续下降的变化趋势,且重建阶段MIP-1α水平显著低于获得阶段(p<0.05)。MIP-1α作为一种与免疫细胞紧密联系的细胞因子,多被用于阿尔兹海默症[36]和关节炎等炎症类疾病发生机制的研究中[37]。有研究表明长期饮酒会引起纹状体中MIP-1α水平显著升高(p<0.05),戒断24 h 后仍显著高于对照组(p<0.05),酒精能够持续影响纹状体中MIP-1α的水平,并指出戒断过程产生的应激反应是造成MIP-1α升高的主要原因[38]。在本研究结果中,低和较高剂量烟碱不会诱导海马组织中MIP-1α的过表达,戒断后MIP-1α水平相较于获得组未持续上升反而下降,可能是由于戒断时间较长(>24 h)引起的;此外,在低剂量下消退过程中MIP-1α水平的降低可通过再次给烟碱而恢复,在较高剂量作用下戒断对MIP-1α水平的影响不可逆。
如图2c 所示,在0.2 mg/kg 给药剂量下,CPP 获得、消退和重建阶段RANTES 水平分别有下降、升高和下降的变化趋势,每一阶段RANTES 水平均与对照组无显著差异(p>0.05);在0.6 mg/kg 给药剂量下,3 个阶段RANTES 水平持续保持下降,其中重建组RANTES 水平相比于对照组和获得组分别下降了27%和25%(p<0.05)。大量研究表明,RANTES 表达的上调与多种炎症疾病相关,其中相比于健康对照组,2 型糖尿病患者血清中RANTES 水平升高[39]。Tripathy 等[13]报 道 相 比于健康对照组,AD 患者脑微血管中RANTES 的表达上调,LPS 能够诱导RNATES 的表达。本研究结果表明,低和较高剂量下,烟碱能够抑制RANTES 的表达,机体处于稳态,可能具有神经保护作用;在低剂量下,戒断后RANTES 水平的升高可通过再次给烟碱恢复;在较高剂量下,戒断后RANTES 表达受到抑制,且这种抑制作用具有持续性,不能通过短期内再次给烟碱而扭转。
2.2.3 TNF-α
如图3 所示,在0.2 mg/kg 给药剂量下,CPP 获得、消退和重建阶段TNF-α水平分别有下降、升高和持续升高的变化趋势,其中重建阶段TNF-α水平显著高于获得阶段(p<0.05);在0.6 mg/kg 给药剂量下,3 个阶段TNF-α水平分别有升高、下降和持续下降的变化趋势,但与对照组均无显著差异(p>0.05)。TNF-α具有双重作用:一方面在机体免疫调节、机体生理功能和抗感染等方面发挥重要作用,另一方面若持续释放或产生过多时则会引起发热休克等[15]。Mihara 等[40]表示LPS 能够诱导大鼠肠间皮细胞中TNF-αmRNA 水平的升高。本研究结果表明,低和较高剂量烟碱不会诱导大鼠海马中TNF-α的过表达,机体处于稳态;此外,在低和较高剂量下TNF-α的变化趋势相反,低剂量下重建阶段TNF-α水平显著升高(p<0.05)。这可能是由于重建组大鼠烟碱暴露时间较短,急性烟碱给药可能导致TNF-α水平上调。
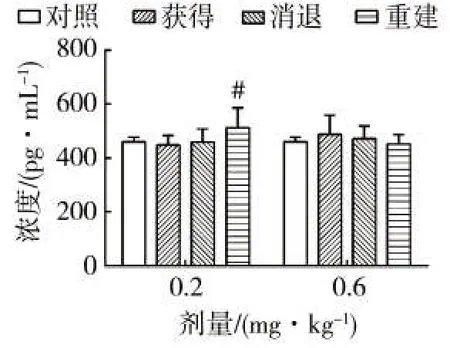
图3 烟碱模型不同阶段TNF-α水平的变化Fig.3 Variations of TNF-α level at different stages of nicotine preference model
3 结论
①应用悬液芯片技术同时检测了烟碱偏好模型不同阶段大鼠海马组织中23 种炎症相关的细胞因子水平,其中9 种细胞因子水平有显著差异(p<0.05),包括5 种白细胞介素,3 种趋化因子和TNF-α;②在低和较高剂量下,烟碱能够促进IL-1α和IL-10 的 表 达,抑 制IL-6、IL-18、GRO/KC 和RANTES 的表达;③大鼠海马组织中GRO/KC 水平易受烟碱影响,单一烟碱作用会降低促炎症因子GRO/KC 的表达,在获得-消退阶段该降低作用减弱,在消退-重建阶段该降低作用再次恢复至获得阶段,该细胞因子可能参与了烟碱的潜在抗炎作用机制。
