新生猪缺氧缺血脑损伤后神经网络重建相关蛋白的表达
2020-10-20张志男郑阳王晓明
张志男,郑阳,王晓明
(中国医科大学附属盛京医院放射科,沈阳 110004)
神经网络重建是脑组织缺氧缺血 (hypoxicischemic,HI) 损伤后脑功能恢复过程中必须经历的过程,重建过程主要包括突触和轴突的再生,主要评估指标有突触素 (synaptophysin,Syn) 和神经蛋白聚糖 (neurocan,Neu) 等。Syn可以准确反映突触的密度和分布,参与突触的形成和稳定性的维持,可以作为反映神经损伤后修复机制的标志性分子[1]。Neu是由神经胶质细胞分泌的特异性蛋白质,调节细胞连接,参与中枢神经系统发育和神经修复过程,与胶质瘢痕形成和抑制轴突生长等生理和病理过程密切相关[2]。本研究采用新生猪急性HI模型,模拟新生儿HI病理变化,检测Syn和Neu的表达,分析HI后神经再生信号途径的交互作用及新生细胞与受损神经细胞间的相互关系,进一步阐明HI损伤后神经网络重建机制,以加深对新生儿缺氧缺血性脑病的理解,为其诊断和治疗提供有意义的帮助。
1 材料与方法
1.1 实验动物和分组
选用健康新生约克夏猪,3~5日龄,雌雄不限,共计28头,平均体质量约为1.0~1.5 kg,随机为对照组 (n=4) 和HI模型组 (n=24)。HI模型组根据HI后的存活时间分为6个亚组,分别为0~2 h亚组、2~6 h亚组、6~12 h亚组、12~24 h亚组、24~48 h亚组、48~72 h亚组,每个亚组4头。所有实验动物执行《实验动物管理条例》和《实验动物许可证管理办法》规定的标准。本研究通过我院伦理委员会审批。
1.2 动物模型的制作
1.2.1 对照组:在28~30 ℃的室温条件下进行手术操作,以0.6 mL/kg剂量肌注麻醉药 (速眠新注射液,长春军事医学院兽医研究所)。待新生猪麻醉失去意识后进行气管插管 (直径2.5 mm),同时连接到小动物呼吸机 (TKR.200C,江西特力麻醉呼吸设备中国有限公司) 进行机械通气,通入100%氧气 (我院医疗用品站配制);使用Tuff Sat手掌式脉搏血氧仪(美国GE公司) 监测心率和血氧饱和度。用碘伏消毒颈部皮肤,取颈部正中切口,将双侧颈总动脉与颈内静脉和喉返神经小心游离开,不做其他操作,直接缝合切口。
1.2.2 HI模型组:模型组新生猪进行上述相同操作,游离双侧颈总动脉后,放置于保温箱内约30 min,待其状态稳定,用动脉夹夹闭双侧颈总动脉阻断血流,同时机械通入含氧浓度为6%的氮氧混合气(大连大特气体有限公司),计时,维持HI状态40 min后恢复双侧颈总动脉血流,同时机械通气改为通入100%氧气。最后缝合切口,自主呼吸恢复后停用呼吸机。全程严密监控血氧饱和度和心率,及时处理术中和术后可能发生的休克、抽搐等症状。
1.3 免疫组化染色
1.3.1 染色过程:HI造模完成后,根据不同时间段分组处死动物,迅速取出脑组织,置于4%多聚甲醛中固定,以冠状面为标准切成4 mm厚的组织片,保留含有基底节区的层面,经脱水、二甲苯透明、石蜡包埋后切片,切片厚4 μm,进行Syn和Neu免疫组化染色,采用链酶菌抗生物素蛋白-过氧化物酶连结法,DAB显色。使用37 ℃烤箱烤干切片,然后进行常规脱水、透明、封片的操作。阴性对照用PBS代替一抗。Syn和Neu抗体由英国Abcam公司提供。
1.3.2 免疫组化染色图像的采集与结果的判断:由2位病理科医师协助判定Syn和Neu的免疫组化染色结果,镜下出现棕黄色斑块或颗粒为阳性表达。免疫组化图像的采集和处理应用日本Nikon Edipse E 800显微镜和日本NIS-Elements F 2.30图像采集软件,400倍镜下观察。免疫组化图像光密度 (optical density,OD) 值的分析应用日本NIS-Elements BR 2.10图像分析软件,以OD值的大小表示Syn表达的多少。每张切片基底节区各观察5个视野,综合分析5个视野的数据,判断对照组和HI模型组各亚组中Syn和Neu的表达情况。
1.4 统计学分析
2 结果
2.1 Syn的免疫组化染色结果和表达变化趋势
HI后基底节区Syn的免疫组化染色结果 (图1)显示,各组均见大量棕黄色染色,HI模型组6~12 h亚组染色最多。Syn的OD值整体呈先升高后降低的趋势,6~12 h表达达到高峰,而后下降。与对照组相比,HI模型组0~2 h亚组、2~6 h亚组、6~12 h亚组Syn的表达均升高,差异均有统计学意义 (P< 0.05);与HI模型组6~12 h亚组相比,HI模型组12~24 h亚组、24~48 h亚组、48~72 h亚组Syn的表达均降低,差异均有统计学意义 (P< 0.05)。见图2。
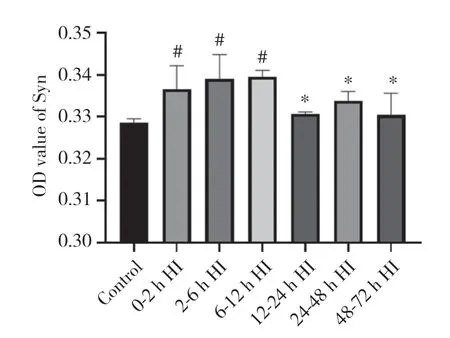
图2 HI后72 h内Syn的OD值变化趋势Fig.2 The trend of OD value of Syn within 72 h after HI
2.2 Neu的免疫组化染色结果和表达变化趋势

图3 各组Neu的表达 ×400Fig.3 Expression of Neu in each group ×400
HI后基底节区Neu的免疫组化染色结果 (图3)显示,各组整体染色浅淡,仅可见少量棕黄色染色,6~12 h亚组染色最少,24~48 h亚组染色最多。Neu的OD值整体呈先降低后升高再降低的趋势,6~12 h表达最低,而后升高,24~48 h表达达到高峰,随后下降。与HI模型组6~12 h亚组相比,对照组及HI模型组0~2 h亚组、2~6 h亚组、12~24 h亚组、24~48 h亚组、48~72 h亚组Neu的表达均升高,差异均有统计学意义 (P< 0.05);与HI模型组24~48 h亚组相比,对照组及HI模型组0~2 h亚组、2~6 h亚组、6~12 h亚组、12~24 h亚组、48~72 h亚组Neu的表达均降低,差异均有统计学意义 (P< 0.05)。见图4。
3 讨论
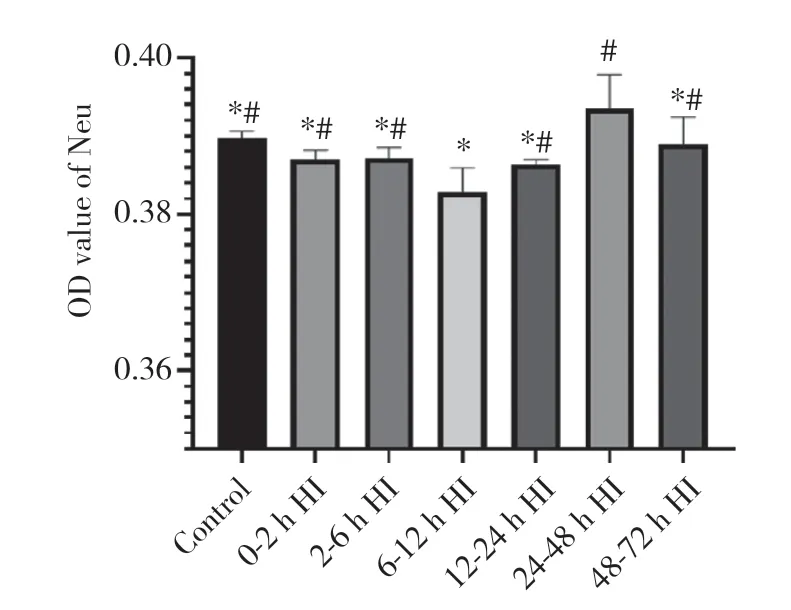
图4 HI后72 h内Neu的OD值变化趋势Fig.4 The trend of OD value of Neu within 72 h after HI
既往针对Syn和Neu的研究[3-5]多集中于啮齿类动物如新生大鼠的海马区,且多为HI损伤后较远期的研究。本研究选择新生猪为实验对象,研究72 h内急性期时较易受HI影响的基底节区Syn和Neu表达的变化规律,阐释HI后神经网络重建的机制,以及再灌注损伤对神经网络重建的影响。
Syn是一种位于突触前囊泡膜上的钙结合蛋白,与突触的结构和功能密切相关,是突触连接的标志。Syn参与突触小泡膜与突触前膜的融合,直接影响神经递质的释放和囊泡的转运,在突触形成和重塑的过程中发挥重要作用[6]。由于Syn的含量与突触的密度呈正相关,因此检测Syn免疫阳性产物的OD值,就可以反映突触前囊泡的分布,进而推测出突触数量和密度的变化情况[7]。
本研究通过检测HI后不同时间Syn的表达,描述Syn的动态变化,这种动态变化提示了HI后突触的损伤和重建。本研究结果显示,72 h内的急性期Syn的变化整体呈先升高再降低的趋势。对照组神经元完好,镜下可见均匀分布的Syn表达阳性产物。HI模型组Syn的表达12 h前呈升高趋势,提示突触发生了再生,推测发育期脑组织在HI状态的同时即开始神经网络重建过程,HI状态解除后,未死亡的神经细胞在得到血氧供应后短时间内即可代偿性大量表达Syn,以便尽快恢复神经网络。当脑组织由低灌注转为再灌注时,会出现再灌注损伤,通常发生在HI后的6~24 h内[8]。本研究发现,Syn的表达在6~12 h达高峰后随时间延长整体呈下降趋势,Syn减少提示突触受到损伤,推测其与再灌注损伤的出现有关。此时再灌注损伤逐渐加重,一方面HI后乳酸大量堆积,脑组织优先利用乳酸供能,但乳酸代谢产生的能量不足以维持神经元正常的生理活动,能量不足加重了神经损伤[9];另一方面谷氨酸的稳态失衡,引起兴奋性毒性损伤,通过坏死、凋亡和自噬等机制导致细胞损伤或死亡[10]。据此,笔者认为HI后的再灌注损伤比HI状态本身造成的直接损伤更加严重。
Neu是硫酸软骨素蛋白聚糖的一种,主要来源于神经胶质细胞,是细胞外基质的成分,参与胶质瘢痕的形成,是一种轴突生长抑制蛋白[11]。MATSUI等[12]在成年鼠脑损伤模型中发现Neu在脑损伤后表达增高,认为脑损伤后Neu的聚集可能参与脑损伤后神经的修复过程。生理情况下,Neu的主要作用为抑制轴突的无序生长,诱导神经纤维向正确的靶细胞投射,中枢神经系统受到损伤后,Neu可有短暂性表达增加,抑制轴突生长[13]。
本研究通过检测HI损伤后不同时间Neu的表达,探讨神经网络重建相关抑制因素在HI脑损伤后的变化规律。在HI后的神经网络重建过程中,轴突的再生受到Neu的调控。对照组可见Neu的表达,即未受损发育期脑组织有Neu的表达,这与既往的研究[14]一致。HI后Neu的表达逐渐下调,至12 h达最低,此时神经元和轴突受损,由于Neu抑制轴突再生长的作用,此时Neu表达的下调有利于轴突的恢复;12 h后,轴突得到一定的恢复,Neu的表达增加,在一定程度上抑制神经轴突的无序生长,消除错误分支,保证轴突生长方向的正确性,确保轴突可以与正确的靶细胞相连,此时再灌注的损伤加重以及Neu的抑制作用,轴突再次受损减少,因此48 h后Neu的表达再次下调。Neu虽有保证轴突正确生长的作用,但其影响轴突的再生,迟滞了神经网络重建的过程。Syn和Neu在HI后的神经再生过程中共同发挥作用,确保神经网络重建过程得以正确进行。
神经系统受到HI损伤后,突触和轴突受到破坏,信息的传递、加工和储存出现障碍,此时若不及时干预治疗,可能导致严重的后遗症,甚至死亡。在HI后6~24 h这段“治疗时间窗”内及时干预,可能减轻脑损伤程度甚至阻断脑损伤进展[8]。因此,寻找Syn和Neu表达的干预因素成为治疗缺氧缺血性脑病的研究方向。粒细胞集落刺激因子结合丰富环境的刺激等可以上调Syn的表达,促进突触的再生[4];移植骨髓间充质干细胞等可以下调Neu的表达,间接促进轴突的再生[2]。这些研究为缺氧缺血性脑病早期促进神经网络重建提供了可能的治疗方法。
新生猪与新生大鼠相比有着更多的优势,但相关研究较少。新生猪与新生儿有更多的相似性,能够更好的模拟新生儿HI损伤,更贴近新生儿HI损伤后的自然状态[15]。本研究采用新生猪制作急性HI模型,该模型通过阻断双侧颈总动脉来维持HI状态,维持一定时间后再恢复血供,有利于模拟再灌注的研究[16]。本课题组前期研究[17]已经证实该模型的重复性较高,实验结果较为可靠,虽然该模型的制作可能和临床病例实际情况有一定的差别,但仍不失为一种良好的动物模型。
发育期脑组织本来就存在大量的神经发生,活体HI损伤后Synt和Neu的变化规律可能更加复杂,新生猪HI模型Syn和Neu的表达在72 h后及更远期的变化规律仍需更进一步的研究。总之,研究Syn和Neu在HI损伤后不同时期的变化规律,对研究新生儿缺氧缺血性脑病神经网络的病理改变及其修复机制具有重要的意义,可为指导新生儿发生缺氧缺血性脑病后促进脑神经修复的临床治疗提供实验依据。
