大肠癌BRAF基因突变与病理特征的相关性
2020-10-19王志斌周智辉贺伯伟廖和和
王志斌 周智辉 刘 芳 贺伯伟 廖和和
大肠癌是常见的消化系统肿瘤,且近年来随着饮食结构及生活方式的改变,当前该病在我国的发病率逐年增加[1]。大肠癌的预后比较差,可给患者的生活质量及生命健康均构成极大威胁[2]。而随着肿瘤病理分期的增长、肿瘤的侵犯深度加深和淋巴结转移、远处转移的发生,患者生存率逐渐下降[3-4]。随着对大肠癌研究的深入,对大肠癌临床病理特征的研究已经不仅仅局限于简单的单因素分析,还需要从其他因素进行深入分析。丝裂原活化蛋白激酶(MAPK)异常激活是恶性肿瘤发生发展的重要通路,鼠类肉瘤滤过性毒菌致癌同源体B(v-raf murine sarcoma viral oncogene homolog B,BRAF)基因是RAS/RAF/MEK/ERK/MAPK通路重要的转导因子,参与调控细胞生长、分化和凋亡等生物学事件[5-7]。在人类结直肠癌、甲状腺癌、肝癌、胰腺癌、恶性黑色素瘤、肺癌等均存在不同比例的BRAF基因突变,因此检测BRAF基因突变可能有助于筛选出对治疗反应最敏感的大肠癌人群[8-9]。当前有研究也显示BRAF基因突变是消化道肿瘤最常见也是最有特异性的基因改变,可能决定患者的临床和病理表现[10-11],但是在大肠癌中的应用情况还无相关报道。本文具体探讨了大肠癌BRAF基因突变与病理特征的相关性,希望为临床工作提供经验和借鉴。现总结报告如下。
1 材料与方法
1.1 研究对象
研究得到了本院伦理委员会的批准,2016年2月至2019年5月选择在本院诊治的大肠癌患者118例与大肠腺瘤患者118例,纳入标准:病理诊断证实为原发性大肠癌或大肠腺瘤;术前均未接受任何放化疗等治疗;临床病理资料完整;无合并严重的心脑血管、肝肾肺等器官组织疾病;均自愿参加并签署知情同意书。排除标准:临床病理资料缺乏者;合并其他类型恶性肿瘤;合并血液系统、免疫系统或内分泌系统严重疾病者;妊娠与哺乳期妇女。
大肠癌患者中男性67例,女性51例;平均年龄(56.20±5.21)岁;平均肿瘤直径(4.82±0.78)cm;肿瘤部位:直肠45例,结肠73例;临床分期:Ⅰ期47例,Ⅱ期13例,Ⅲ期58例;淋巴结转移45例,组织学分化:低分化23例,中分化82例,高分化13例;浸润深度:T1+T2 32例,T3+T4 86例。大肠腺瘤患者中男性65例,女性53例;平均年龄(56.67±3.78)岁。两组不同患者的性别、年龄等对比差异无统计学意义(P>0.05)。
1.2 标本采集
取所有患者的病灶组织样本,均经10%的甲醛溶液固定,制成石蜡包埋切片。提取组织的基因组DNA,采用上海生工有限公司生产的基因突变检测试剂盒(实时荧光定量PCR探针法)提取组织的基因组DNA并进行检测,检测仪器为Stratagene Mx3000P荧光PCR检测仪。PCR扩增条件:42 ℃ 5 min,94 ℃ 3 min;(94 ℃ 45 s;60 ℃ 45 s)40个循环,BRAF:目的基因Ct值<38为突变型。检测引物由大连TAKAR有限公司设计及合成,正向序列为:5’-AGTATTACCAACCAGACTATCCT-3’,反向序列为:5’-TCATAATGCTTGGTCTGATAGGA-3’。
1.3 观察指标
调查所有患者的性别、年龄等资料,同时记录大肠癌患者的临床分期、分化程度、浸润深度、肿瘤部位、肿瘤直径、淋巴结转移等临床病理学特征。
1.4 统计方法
应用SPSS 19.00软件对本研究所有数据进行分析,计量资料以均数±标准差表示,计数数据采用百分比、率等等表示,计数资料采用χ2检验进行对比分析,计量资料采用t检验进行对比分析,并采用Cox比例风险模型进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 BRAF基因突变率对比
大肠癌患者的BRAF基因突变率为34.7%(41/118),显著高于大肠腺瘤患者的5.1%(6/118)(χ2=32.545,P<0.05)。
2.2 BRAF基因突变与临床病理特征的关系
在大肠癌患者中,不同性别、年龄、肿瘤直径、肿瘤部位、分化程度等患者的BRAF基因突变率对比差异无统计学意义(P>0.05),而不同浸润深度、淋巴结转移、临床分期等患者的BRAF基因突变率对比差异有统计学意义(P<0.05),见表1。
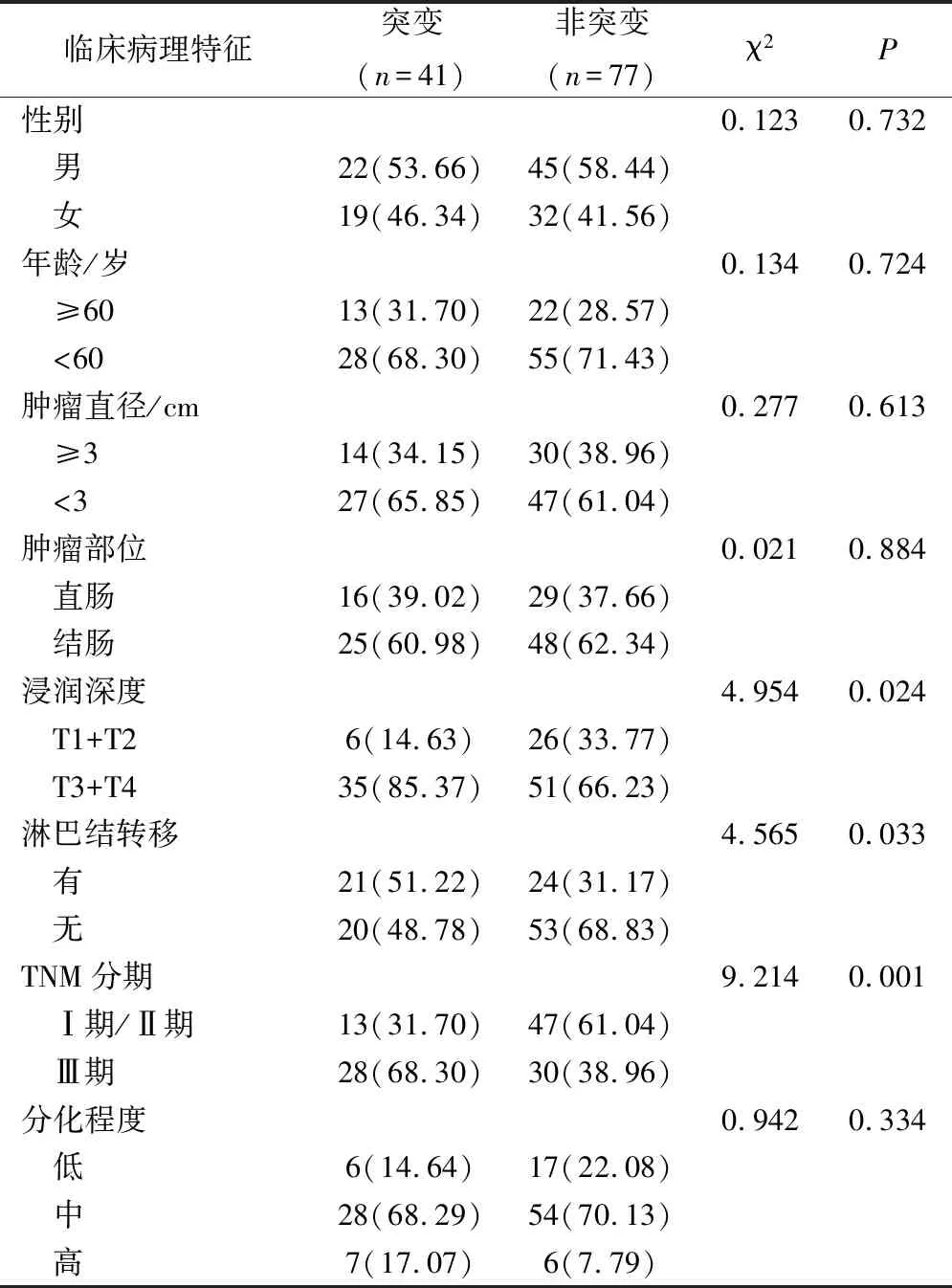
表1 BRAF基因突变与临床病理特征的关系(例,%)
2.3 相关性分析
在大肠癌患者中,以BRAF基因突变作为因变量,以浸润深度、淋巴结转移、临床分期作为自变量,Cox比例风险模型显示浸润深度、淋巴结转移、临床分期为导致BRAF基因突变的影响因素(P<0.05)。见表2。

表2 导致大肠癌BRAF基因突变的影响因素
3 讨论
随着世界人口的老龄化、饮食结构的改变与经济的发展,近年来大肠癌的发病率呈逐年上升趋势,已经成为危害我国人民生命健康的主要疾病之一[12]。而随着分子生物学的发展,对大肠癌的分子机制研究也不断深入。BRAF基因又名鼠类肉瘤滤过性的毒菌致癌同源体B1,位于人染色体7q34,属于丝氨酸-苏氨酸蛋白质激酶类[13]。BRAF基因属于属MAPK通路中的分子之一,也是EGFR信号通路中的重要作用因子。BRAF基因突变能激活ERK信号,诱导细胞增殖,防止细胞凋亡。BRAF的主要突变位点是蛋白质产物中第600位的赖氨酸(V)谷氨酸(E)所替代(V600E),从而使丝氨酸-苏氨酸蛋白质激酶发生持续性活化,诱发癌变的形成[14-15]。本研究显示大肠癌患者的BRAF基因突变率为34.7%,显著高于大肠腺瘤的5.1%,表明大肠癌患者多伴随有BRAF基因突变。
BRAF基因是EGFR下游信号通路中的重要信号传导蛋白,对细胞的增殖等功能产生重要影响[16]。BRAF基因突变使细胞的生长摆脱EGFR信号通路的调控,从而可诱发肿瘤的形成[17]。本研究显示在大肠癌患者中,不同性别、年龄、肿瘤直径、肿瘤部位、分化程度等患者的BRAF基因突变率对比差异无统计学意义,而不同浸润深度、淋巴结转移、临床分期等患者的BRAF基因突变率对比差异有统计学意义。从机机制上分析,BRAF基因突变可激活细胞内酪氨酸激酶蛋白活性,使酪氨酸发生磷酸化,激活Ras/MAPK等多种信号传导途径,当信号传导至细胞膜及细胞间质时,导致细胞增殖失控,并抑制细胞凋亡发生,进而导致细胞癌变[18-20]。
BRAF基因突变与多种肿瘤的发生、发展等有关,也可能是1种新的恶性肿瘤相关基因治疗靶点[21-22]。本研究Cox比例风险模型显示浸润深度、淋巴结转移、临床分期为导致BRAF基因突变的影响因素。原发肿瘤的浸润深度超过浆膜者,肿瘤细胞容易发生转移,导致淋巴转移和血行转移,使得临床分期增加,局部组织残留不可见的肿瘤细胞的可能性增大,从而可影响BRAF基因突变情况[23-25]。本研究也有一定的不足,样本的数量较少,BRAF基因突变位点分析比较少,将在下一步进行深入分析。
总之,大肠癌BRAF基因突变率比较高,与患者的浸润深度、淋巴结转移、临床分期等病理特征显著相关。
