不同浓度黄芪多糖在SH-SY5Y细胞内外抗氧化的研究
2020-10-18王楠楠
劳 军,王楠楠
(吉林化工学院 生物与食品工程学院,吉林 吉林 132022)
黄芪(Astragalusmembranaceus)为豆科属多年生草本植物,是较为常见的一种中草药,其药用部分为根部,由于含有多糖、皂苷及酚类等成分,因此可以用来保肝、抗氧化,刺激免疫系统和抗病毒等[1-2].其中黄芪多糖可以用来抗氧化自由基、降低血糖和延缓衰老.在黄芪中的多糖可以分为水溶性多糖和水不溶性多糖,而其水溶性多糖中含有葡萄糖、果糖以及半乳糖等,常用来止汗、抗肿瘤以及调节免疫等[3].目前关于黄芪的水溶性多糖的研究报道很多,而对其水溶性多糖在细胞内的抗氧化活性研究较少.因此本文通过水提醇沉法提取黄芪水溶性多糖,用DPPH法研究其体外抗氧化活性,同时也用DCFH-DA法检测了其在胞内抗氧化活性,并进一步用MTT法探索了其对H2O2损伤细胞模型的保护作用.
1 实验部分
1.1 试剂与仪器
实验用黄芪为市售,购自于吉林大药房,烘干后研磨成粉.无水乙醇(天津永大化学试剂公司)、1,1-二苯基-2-三硝基苯肼(DPPH)(天津凯信化学试剂公司)、2,7-二氯二氢荧光素乙酰乙酯(DCF-DA)(苏州宇恒生物科技有限公司)
实验所用仪器主要有紫外可见分光度计(TU-1901)、电热恒温干燥箱(DHG-9245A)、离心机(PDZ5-WS)、CO2培养箱(LS-C0150)、细胞成像微孔板检测系统(170524B).
1.2 实验过程
(1)黄芪水溶性多糖的提取
采用水提醇沉淀法,称取100 g黄芪粉,加适量的水定容于900 mL,水浴加热至70 ℃.维持100 min之后,加300 ml 75%乙醇沉淀多糖物质,3 000 rpm,离心10 min之后,所得沉淀即为黄芪粗多糖[4].
(2)DPPH法对不同浓度黄芪多糖清除自由基能力的测定
将上述黄芪多糖配成10、25、50、75、100 mg/mL的溶液,对照组加入50 μL水、2 mL DPPH溶液和 950 μL 95%乙醇;实验组分别加入不同浓度50 μL黄芪多糖溶液、2 mL DPPH溶液和950 μL 95%乙醇;混合后摇匀,静止30 min.在分光光度计517 nm处测出每组的吸光度值代入如下公式[5]:
自由基的清除率=(A0-A)/A0 ×100%(A0代表对照组,A代表实验组)
从而计算出黄芪多糖对DPPH自由基的清除率
(3)H2O2对细胞损伤模型的建立及黄芪多糖对细胞活力作用的测定
取生长状态良好的SH-SY5Y细胞按照每孔1×104均匀铺到96孔板中,待细胞形态良好后,用0、6.25、12.5、25、50、100、200、400、800 μM H2O2和0、10、25、50、75、100 mg/mL黄芪多糖分别处理细胞,每个浓度和空白组设置三个复孔,处理24 h后,加入100 μL不完全培养基和10 μL 0.5 mg/mL MTT,在37 ℃恒温CO2培养箱中继续培养4 h,弃培养基,每孔加入150 μL DMSO,震荡10 min,在酶标仪570 nm波长下检测细胞的吸光度.
(4)黄芪多糖对H2O2处理的细胞ROS生成率的影响[6]
将DCFH-DA溶于甲醇中配成1 M的储备液.取生长状态良好的SH-SY5Y细胞按照每孔1×104均匀铺到96孔板中,待细胞形态良好后,以PBS洗涤细胞3次,加入200 μL0、10、25、50、75、100 mg/mL黄芪多糖溶液,于37 ℃ 下放置2 h,去除上清液,加入10 μL 0 μL不完全培养基,再加入H2O2终浓度为200 μM培养24 h之后,去除上清液,再加入95 μL的PBS和5 μL DCFH-DA,37 ℃孵育45 min,在酶标仪上激发光488 nm,发射波长525 nm进行检测.
(5)黄芪多糖对H2O2损伤细胞的保护作用测定
取生长状态良好的SH-SY5Y细胞按照每孔1×104均匀铺到96孔板中,待细胞形态良好后,以PBS洗涤细胞3次,分别加入200 μL0、10、25、50、75、100 mg/mL黄芪多糖溶液,于37 ℃下对细胞分别预处理3、6和12 h之后,去除上清液,加入100 μL不完全培养基,再加入H2O2终浓度为200 μM培养24 h之后,用MTT检测细胞活力,方法同上.
(6)统计学分析
使用Graphpad prism 7.0进行统计学分析,两组间分析使用t检验,组间分析使用软件进行One-Way ANOVA分析,P<0.05说明数据存在的差异性.
2 结果与讨论
2.1 黄芪多糖在细胞外清除自由基的能力
在体外不同浓度的黄芪多糖对自由基的清除能力如图1所示,在黄芪多糖浓度低于50 mg/mL时,随着浓度不断增加,对自由基的清除率也不断升高;当浓度达到50 mg/mL时,清除率可达(72.3±1.7)%;浓度达100 mg/mL时,清除率可达(73.1±2.8)%,对自由基的清除率上升幅度不大,达到了一个平台期.
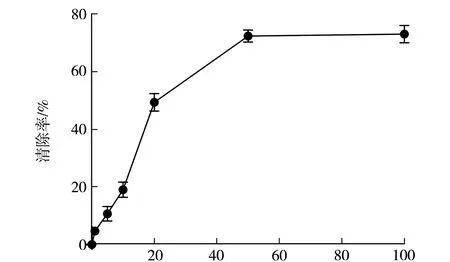
黄芪多糖浓度/(mg·mL-1)
2.2 黄芪多糖在细胞内的抗氧化结果
2.2.1 H2O2及黄芪多糖对细胞活力作用的测定
H2O2是一种强氧化剂,是最常用的建立细胞内活性氧产生模型的试剂,进入细胞培养液后,会直接攻击细胞上的蛋白质、脂类,破坏膜系的完整性,从而造成细胞连续受损而坏死[7].本实验中,在细胞培养过程中加入外源性的 H2O2,通过MTT法检测H2O2对细胞活力的影响,结果见图2.
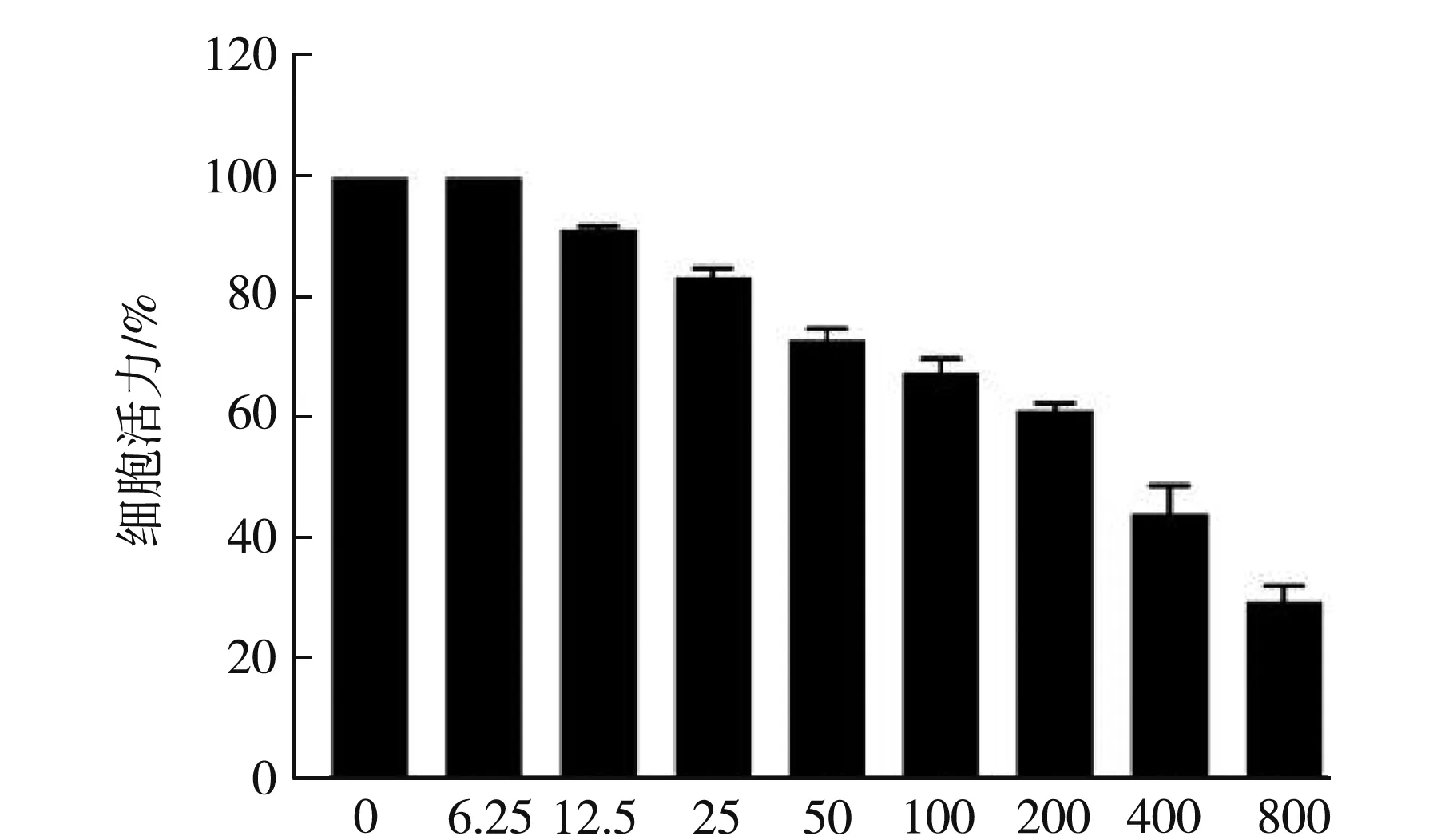
H2O2浓度/μM
图2表明SH-SY5Y细胞经H2O2处理后细胞活力明显下降,表明细胞受到损伤或者部分已经死亡,在12.5~800 μM浓度范围内,随着H2O2浓度升高,细胞活力呈梯度下降,与对照组相比具有统计学差异(P<0.05),当H2O2浓度为200 μM时细胞活力达到(55±1.52)%,与H2O2其它浓度的细胞活力相比之下较为适中,故选择200 μM H2O2作为建立氧化损伤模型的最佳浓度.同时,通过MTT检测了不同浓度的黄芪多糖对SH-SY5Y细胞活力的影响,如图3所示,黄芪多糖对细胞活力的影响不大,随着其浓度的升高,细胞活力略微下降,当浓度达到100 mg/mL,细胞活力仍在95%以上.
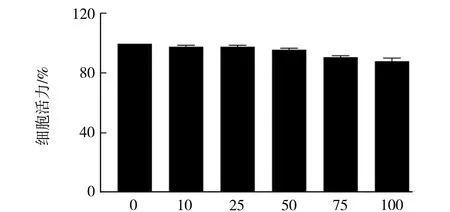
黄芪多糖浓度/(mg·mL-1)
2.2.2 黄芪多糖细胞内抗氧化实验结果
DCFH-DA 是可穿透细胞的非荧光性物质,能够被细胞中的ROS 所氧化.进入细胞以后,经过细胞的脂酶作用脱去二乙酰基生成非荧光的2′,7′-二氯氢化荧光素(DCFH),DCFH 被细胞内的活性氧氧化以后生成发荧光的2′,7′-二氯荧光素(DCF),因此通过检测荧光的强度可以判断细胞的氧化程度[8].黄芪多糖对细胞内ROS的清除率结果如图4所示,图4表明用200 μM H2O2处理细胞,胞内产生ROS.经过黄芪多糖预处理的细胞,能够清除胞内的ROS;并且预处理的黄芩多糖浓度越大,对ROS自由基的清除率也增大.当黄芪多糖浓度到达75 mg/mL时,对ROS自由基的清除率达到(53.33±5.24)%;而当黄芪多糖浓度到达100 mg/mL时,对ROS自由基的清除率达到(53.67±2.33)%,对自由基清除率变化不大,从而达到一个平台期.
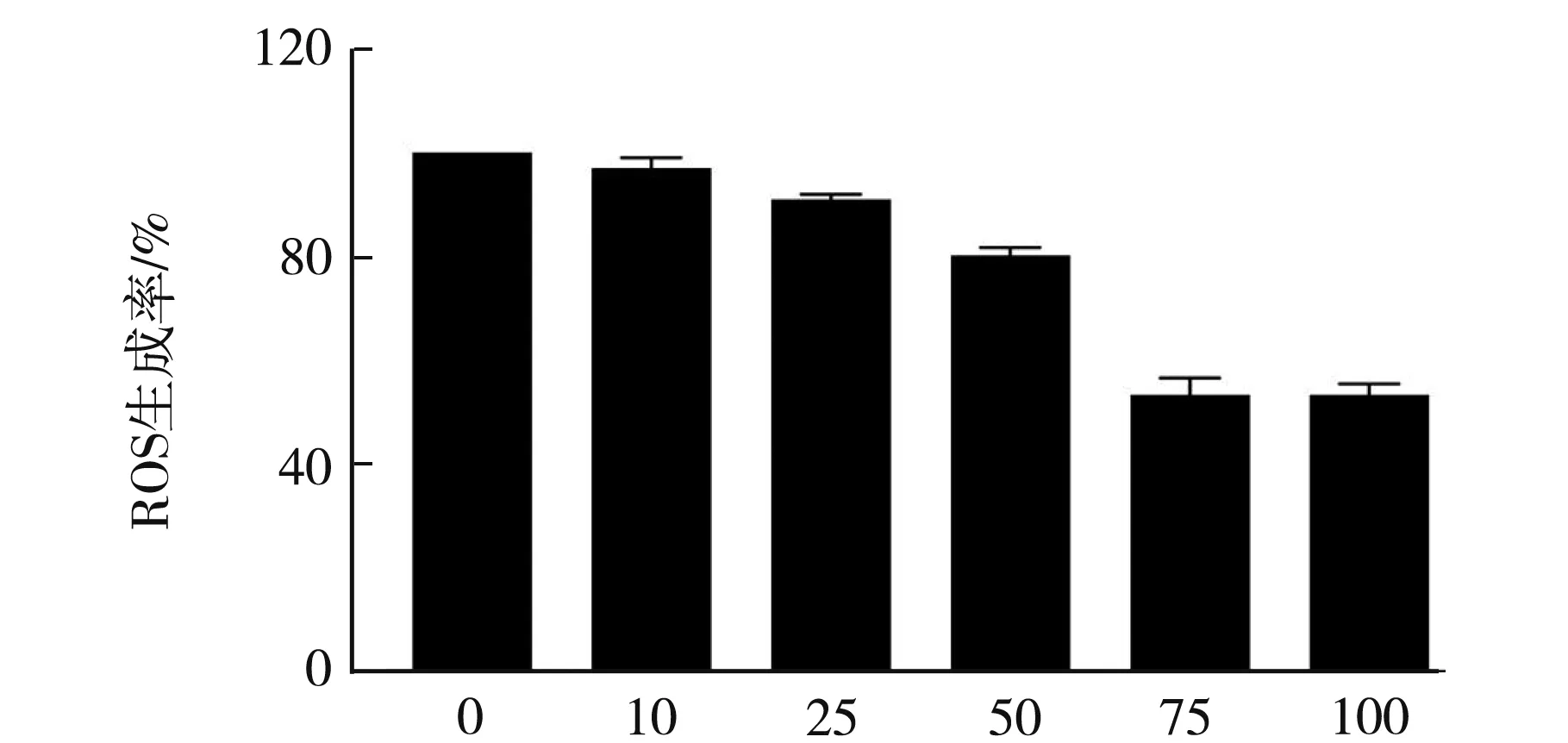
黄芪多糖浓度/(mg·mL-1)
2.2.3 黄芪多糖对H2O2损伤的SH-SY5Y细胞活力的影响
为了考察黄芪多糖对H2O2损伤SH-SY5Y细胞的活力作用情况,本文用黄芪多糖分别在0、10、25、50、75、100 mg/mL的浓度下,分别预处理SH-SY5Y细胞3 h、6 h和12 h之后,用H2O2作用SH-SY5Y细胞24 h之后,使用MTT检测其细胞活力,结果见图5.图5表明在浓度75、100 mg/mL处理3 h后细胞活力均高于其他浓度和处理时间的细胞活力,其中浓度在75 mg/mL下细胞活力最高;两者与其对照组相比较具有统计学差异(P<0.05),表明对H2O2损伤的细胞具有一定的保护作用,这与黄芪多糖清除细胞内活性氧结果相对应,而其他浓度预处理3 h、6 h和12 h的细胞活力与其各自的对照组相比较,没有显著统计学差异(P<0.05)表明对细胞无保护作用,这可能是由于黄芪多糖长时间处理细胞会产生一定的毒性.
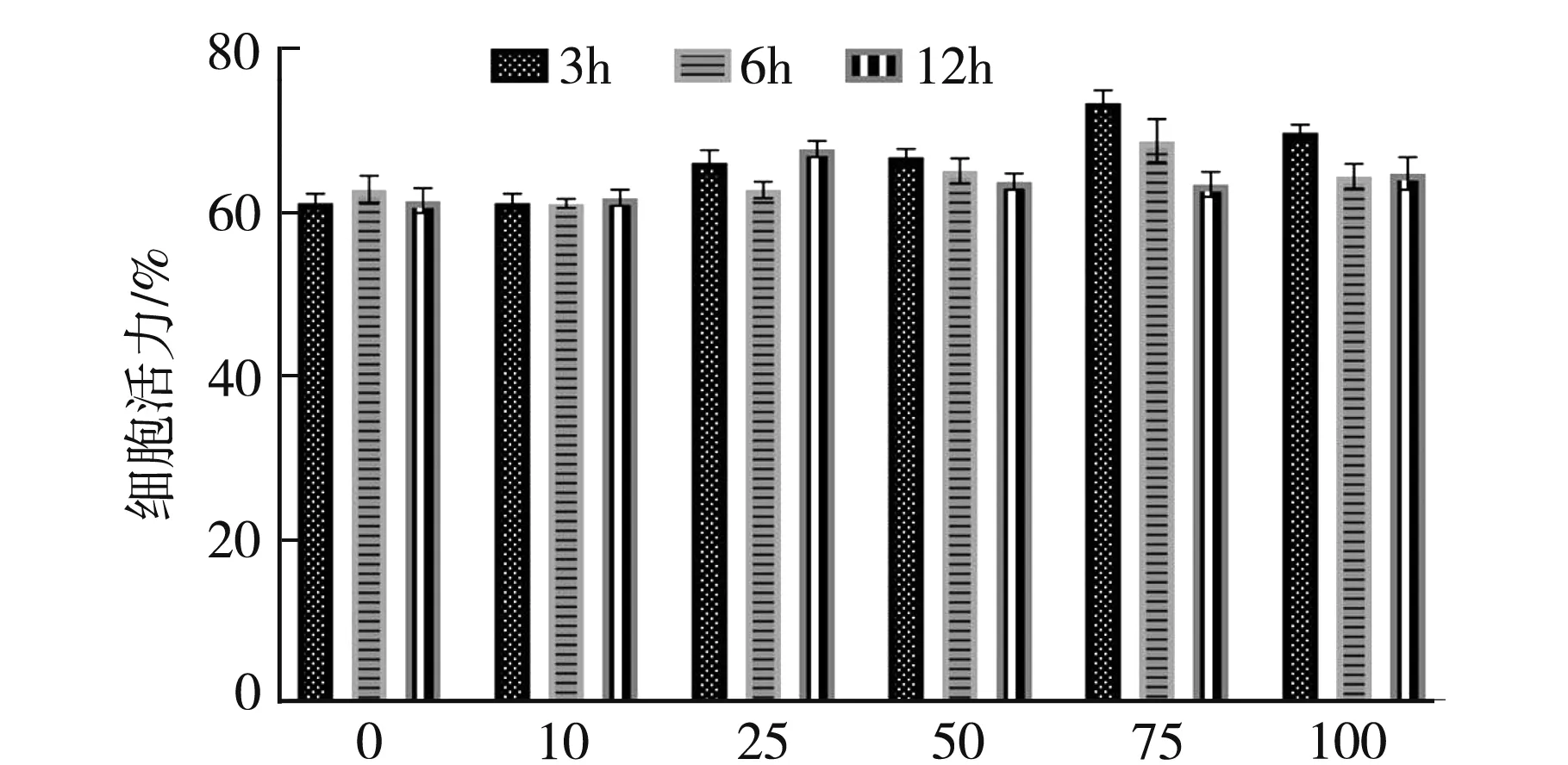
黄芪多糖浓度/(mg·mL-1)
3 结 论
任何产生未成对电子的原子或原子团就会成为自由基,而自由基在细胞内会损坏一些重要的生物大分子,从而引起一系列的疾病[9-11].因此寻找一些抗氧化清除自由基的天然药物很重要.在人体中,氧衍生的自由基是非常主要的自由基来源.例如超氧阴离子和羟基自由基[12],通常统称为活性氧(ROS),H2O2是活性氧(ROS)的主要成分之一,可以跨膜扩散进入到细胞内,是目前比较常用的细胞氧化应激的诱导剂,常用来诱导细胞氧化应激损伤模型的建立[13-14].现有的研究已经证明,黄芪多糖具有一定的抗氧化能力,同时认为在清除自由基方面高于公认的维生素C[15],在本文中黄芪多糖不仅能够降低细胞内的活性氧,而且能够对H2O2氧化损伤的细胞具有一定的保护力,这说明黄芪多糖具有开发成抗氧化清除自由基药物的潜力.
本试验对黄芪多糖在体外和细胞内的抗氧化清除自由基的能力进行了研究,研究表明黄芪多糖在体外抗氧化清除自由基的最佳浓度为75 mg/mL.在对H2O2损伤的SH-SY5Y细胞保护作用研究中,发现75 mg/mL 作用3 h保护作用最佳.
