水力空化对不同热处理后大豆球蛋白理化和乳化性质的影响
2020-10-18李春枝任仙娥杨锋黄永春闫柳娟
李春枝,任仙娥,杨锋,黄永春,闫柳娟
(广西科技大学生物与化学工程学院广西糖资源绿色加工重点实验室,广西高校糖资源加工重点实验室,广西柳州545006)
大豆蛋白因其良好的功能特性和丰富的营养价值等优点被广泛应用于食品工业中。大豆球蛋白(11S)和β-伴大豆球蛋白(7S)是大豆蛋白的两种主要组成成分,含量占70%以上,对大豆蛋白营养价值和功能性质起决定性作用[1]。乳化性是大豆蛋白的重要功能特性[2]。乳化性随着蛋白质构成的不同而产生差异,11S的乳化稳定性较7S差,乳化活性也显著低于7S[3]。由于蛋白质的理化和结构性质对其乳化性至关重要,很多方法(包括物理、化学和酶法等)都被用来改变蛋白质的理化和结构性质,以提高其乳化性和其他功能性质[4]。
超声波作为一种有效的物理改性手段,能改变大豆蛋白产品如大豆分离蛋白和大豆浓缩蛋白的理化性质,进而改善其功能性质,得到了国内外学者的广泛关注[5-8]。如Hu H等[9]研究发现,超声处理能降低β-伴大豆球蛋白(7S)的浊度和粒径、增加表面疏水性、溶解性、乳化活性和乳化稳定性。虽然水力空化和超声空化的方法不同,但它们产生的空化效应是相似的,即在空化过程中空化泡溃灭的瞬间会产生局部极端瞬时高温、高压,并伴有强烈的冲击波、微射流、湍流和高剪切力,同时还可以产生羟基自由基等空化效应[10]。与超声空化相比,水力空化更节能更适于放大处理[11]。本文前期的研究结果表明[12]基于涡流的水力空化在一定条件下能使大豆分离蛋白的粒径减小,表面疏水性增加,改善其溶解性、乳化活性、乳化稳定性和起泡性,并且和超声空化处理相比,处理大体积(2L)时,水力空化对大豆分离蛋白的理化和功能性质的影响更明显。
蛋白质的物理改性效果在很大程度上与蛋白质种类、浓度、pH值、离子强度、蛋白变性和聚集的程度等有关[9,13-16],关于水力空化对不同热处理后大豆球蛋白的改性还未见报道,因此本论文研究基于孔板的水力空化对经过不同热处理后大豆球蛋白理化和乳化性质的影响,为水力空化在大豆蛋白改性方面的应用提供一定的理论依据。
1 材料和方法
1.1 材料与试剂
脱脂豆粕:大海粮油工业(防城港)有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、1-苯胺-8-萘磺酸(1-aniline-8-naphthalene sulfonic acid,ANS)、对苯二甲酸、5,5'二硫代双(2-硝基苯甲酸)[5′,5-dithiobis(2-nitrobenzoic acid),DTNB]、福林酚:阿拉丁试剂有限公司;以上试剂均为分析纯。
1.2 仪器与设备
T6新世纪紫外可见分光光度计:北京普析通用仪器有限责任公司;F97Pro型荧光分光光度计:天津港东科技发展股份有限公司;Avanti J-26 XPI高速冷冻离心机:美国贝克曼库尔特有限公司;T25高剪切混合乳化机:上海鑫鲨机械设备有限公司。
1.3 试验方法
1.3.1 大豆球蛋白的制备
参照 Nagano 等[17]的方法,按 1 ∶15(g/mL)料液比将粉碎后过80目筛的脱脂大豆粉与去离子水混合,混合均匀后用2mol/LNaOH溶液将pH值调至8.0,恒温磁力搅拌2h后在4℃、10 000 g下离心20 min,得上清液,再向上清液中按0.01 mol/L的比例加入NaHSO3,搅拌均匀后用2 mol/L HCl将溶液调节pH值至6.4,放入冰箱(4℃)中冷藏过夜,然后在4℃、6 500 g下离心20 min,沉淀即为大豆球蛋白。用2mol/LNaOH将大豆球蛋白溶液pH值调节至7.0后透析脱盐(48 h),冻干备用。
1.3.2 水力空化处理大豆球蛋白
将大豆球蛋白配成质量分数为3%的蛋白溶液,室温(28℃)下磁力搅拌2 h,并将蛋白溶液pH值调至7.0,然后分别在不同的温度(70、80℃和90℃)下对蛋白溶液水浴加热30 min,热处理结束后迅速将蛋白溶液于冰水浴中冷却至室温(28℃),制备成不同温度热处理的大豆球蛋白溶液。
水力空化装置为广西科技大学广西糖资源绿色加工重点实验室自制[18]。将经过不同温度热处理后的大豆球蛋白溶液倒入水力空化装置的贮罐中(700 mL),开启冷凝水,启动装置,处理30 min后取样测定其理化和乳化性质。
1.3.3 内源荧光光谱的测定
将蛋白质样品稀释至0.06%,采用F97Pro型荧光分光光度计测定其内源荧光光谱,设置激发波长为290 nm,扫描发射波长范围为300 nm~400 nm,激发和发射狭缝均为5 nm。
1.3.4 表面疏水性的测定
参考Haskard等[19]的方法,以ANS为荧光探针,用0.2 mol/L pH值为8.0的磷酸盐缓冲液将蛋白质样品稀释至不同浓度(0.005 mg/mL~0.5 mg/mL),取 10 μL 8 mmol/L的ANS溶液加入4 mL稀释后的样品中,使用荧光分光光度计在设定激发波长为370 nm,发射波长470 nm,狭缝宽为5 nm的条件下测定荧光强度,以荧光强度对蛋白质浓度(mg/mL)的初始斜率(线性回归分析计算)作为表面疏水性(H0)的指标。
1.3.5 暴露巯基含量的测定
参考Yin等[20]的方法并稍加改动,取2 mL样品加入5 mL测试液(pH 8.0的Tris-甘氨酸缓冲液),添加100 μL DTNB 溶液(4 mg/mL),在 25℃恒温摇床中振荡1 h后,于10 000 r/min下离心10 min,得到上清液,以2 mL蒸馏水加5 mL测试液及100 μL DTNB为空白对照,然后在412 nm处测吸光度值。按下式计算:
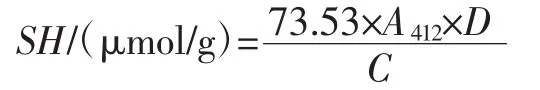
式中:A412为412 nm处的吸光度值;C为蛋白质浓度,mg/mL;D为稀释倍数;73.53为106/(1.36×104),1.36×104为摩尔消光系数。
1.3.6 二硫键含量的测定
根据Petruccelli等[21]的方法进行了2-硝基-5-硫代苯磺酸盐(2-nitro-5-thiosulfobenzoate,NTSB)溶液的配制和二硫键含量的测定。0.1 g DTNB分散于10 mL 1 mol/L Na2SO3溶液中,调节反应液pH值至7.5,添加50 μL 0.1 mol/L CuSO4的氨溶液,反应在38℃进行。通过412 nm吸光度值来监控反应液中残余的NTSB含量的变化,当超过99%的DTNB转化成NTSB后,终止反应。NTSB储液在-20℃下保存备用。用新配置的0.2 mol/L Tri-base缓冲液(含0.1 mol/L Na2SO3,10 mmol/L EDTA和3 mol/L异硫酸胍)和NTSB按体积比1∶100混合后调节pH值至9.5配制NTSB测试液。先将3%的蛋白质溶液稀释3倍,再取350 μL蛋白质样品至5 mL NTSB测试液中,避光静置20 min,在412 nm处测吸光度值。

式中:A412为412 nm处的吸光度值;C为蛋白质浓度,mg/mL;D为稀释倍数;73.53为106/(1.36×104),1.36×104为摩尔消光系数。
1.3.7 溶解性的测定
取经水力空化处理后的蛋白质溶液于10 000 r/min下离心10 min,上清液经适度稀释后,以牛血清蛋白为标准,采用Lowry法[22]测定稀释后上清液中蛋白质含量。蛋白质的溶解性表示为上清液中蛋白质含量与样品中总蛋白质含量的比值。溶解性按下式计算:

1.3.8 乳化活性(emulsifying activity index,EAI)和乳化稳定性(emulsifying stability index,ESI)指数的测定
参照Pearce等[23]的方法并稍作修改来测定EAI和ESI。经水力空化后的蛋白质溶液稀释10倍后,取稀释液15 mL缓慢加入5 mL玉米油,在高剪切混合乳化机中以10 000 r/min的转速剪切乳化1 min后,立刻将剪切结束10 min后从底部吸取的50 μL乳浊液加入到5 mL 0.1%的SDS中,于500 nm处测定吸光值。
EAI和ESI的值按下式计算:

式中:θ为形成乳状液的油所占的比例,本试验中为5/20=0.25;C为初始蛋白质浓度,mg/mL;L为比色杯厚度,1 cm;DF为稀释倍数;A0为0 min时取样测定的吸光度;A10为10 min时取样测定的吸光度。
1.4 数据处理
每个试验均重复3次,结果表示为平均值±标准差,采用SPSS Statistics 19.0软件对数据进行统计分析,采用LSD和Duncan进行差异显著性分析,P<0.05表示差异显著,相关性分析采用Pearson分析。
2 结果与分析
2.1 内源荧光光谱
蛋白质的发射荧光光谱主要由色氨酸(Trp)的环境极性决定,色氨酸是表征蛋白质构象的一种有效手段,因此可以通过色氨酸表征用于评价蛋白质三级结构的变化[24]。水力空化对大豆球蛋白内源荧光光谱的影响见图1。
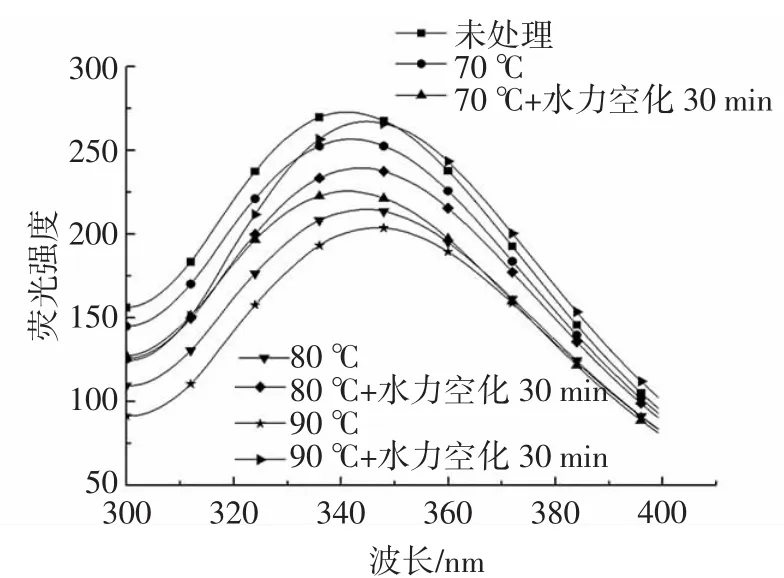
图1 水力空化对大豆球蛋白内源荧光光谱的影响Fig.1 Effect of hydrodynamic cavitation on intrinsic emission fluorescence spectra of soybean globulin
由图1可以看出,热处理后,大豆球蛋白的内源荧光光谱最大吸收峰(λmax)均向长波的方向发生了不同程度的位移(红移),且随着温度的增加,λmax位移的程度不断增加,3种温度热处理后λmax可分别由341.6 nm处移到341.8、344.8 nm和347.2 nm处。这说明大豆球蛋白结构发生改变,色氨酸残基暴露于更极性的微环境中。黄友如等[25]研究高温处理对从脱脂豆粕中提取的大豆分离蛋白结构的影响时得到了相同的结论,经过40、50、60℃处理后样品的λmax红移。在这种情况下,荧光强度的降低可以具体归因于暴露的色氨酸色团的分子间疏水相互作用的增加[16],这与热处理导致蛋白质聚集的事实是一致的,在更高的温度下聚集程度更高。
由图1还可以看出,经过水力空化处理后,3种蛋白质样品的λmax均向短波的方向发生了不同程度的位移(蓝移),且位移的程度和样品热处理的温度有关,热处理的温度越高,经水力空化后,蓝移的程度越大。前期的研究结果发现[18],未经过热处理的蛋白质在水力空化处理后,λmax红移,这说明水力空化对大豆球蛋白λmax的影响和蛋白质初始状态有关。3种样品经水力空化后λmax蓝移说明蛋白质发生聚集,色氨酸残基处于更加疏水的环境中,蓝移现象也可能是水力空化诱导了热处理后大豆球蛋白中变性蛋白的构象重排。另一方面,可以看出经水力空化处理后,荧光强度增加,这说明水力空化降低了色氨酸发色团与溶剂或蛋白质中猝灭剂的相互作用。
2.2 表面疏水性
蛋白质表面疏水性大小取决于蛋白质分子与极性水环境接触后表面疏水性基团的含量,与功能性质密切相关[9]。水力空化对大豆球蛋白表面疏水性的影响见图2。

图2 水力空化对大豆球蛋白表面疏水性的影响Fig.2 Effect of hydrodynamic cavitation on surface hydrophobicity of soybean globulin
由图2可以看出,70℃下热处理,大豆球蛋表面疏水性增加不明显(P>0.05),随着热处理温度的升高,大豆球蛋白的表面疏水性不断增加。90℃下热处理能使大豆球蛋白表面疏水性从1 076.5±51.7增加到5 488.7±264.7,是未加热时的 5 倍多。Tang等[26]和王中江[27]研究发现热处理能显著提高大豆分离蛋白表面疏水性。表面疏水性增加的原因是热诱导的蛋白质展开、变性,使最初埋藏在蛋白质内部的疏水结构域暴露于分子表面。70℃热处理后大豆球蛋白表面疏水性变化不明显和大豆球蛋白变性温度(约80℃)有关,在较低的温度下,蛋白质分子展开不明显,暴露出来的疏水性基团数量较少,所以70℃热处理后大豆球蛋白表面疏水性增加并不明显。
由图2还可以看出,经水力空化处理30 min后,70℃热处理后的蛋白质,表面疏水性显著增加(P<0.05),可由 1 128.55±59.89 增加到 1 555.3±56.28,而80℃和90℃热处理的蛋白质表面疏水性均显著降低(P<0.05),90℃热处理的蛋白质经水力空化30 min后表面疏水性可由5 488.7±264.7降低到4 568.1±180.2。这一现象说明水力空化对蛋白质的影响与蛋白质本身的状态有关。李杨等[13]研究发现11S球蛋白受射流空化腔体内的空化场、射流场、高压场、高温场等多重物理场的作用,导致蛋白质结构展开,内部包裹的疏水性基团暴露,表面疏水性提高,5%的蛋白质溶液经空化处理6 min后,表面疏水性可提高2倍多。前期的研究[28]也发现,经涡流空化处理后,大豆分离蛋白表面疏水性显著增加。本研究中70℃热处理后的大豆球蛋白经水力空化处理表面疏水性增加,说明蛋白质分子展开和疏水性基团暴露。而经过80℃和90℃热处理的蛋白质表面疏水性发生不同变化,原因在于,在蛋白质分子变性温度附近,高温已经使蛋白质分子展开,再经过水力空化处理,瞬时高温、高压、高剪切力、冲击波、微射流及湍流等空化效应使蛋白质分子运动加剧,在疏水相互作用下发生聚集,使暴露出来的疏水基团重新掩埋在分子内部,导致表面疏水性降低。
2.3 暴露巯基和二硫键含量
巯基和二硫键维持着蛋白质的结构,对蛋白质的功能性质有着重要的意义。水力空化对大豆球蛋白暴露巯基和二硫键的影响分别见图3A和图3B。

图3 水力空化对大豆球蛋白暴露巯基和二硫键含量的影响Fig.3 Effect of hydrodynamic cavitation on the exposed SH and SS contents of soybean globulin
由图3A可以看出,未处理的大豆球蛋白暴露巯基和二硫键含量分别为(5.20±0.01)μmol/g和(42.64±0.23)μmol/g。热处理导致暴露巯基和二硫键的含量发生变化,但是变化的程度与热处理温度有关。70℃热处理使暴露巯基含量降低但并不明显(P>0.05),80℃和90℃热处理使暴露巯基含量增加。陶汝青等[29]和马丹等[30]研究发现随着热处理温度增加,大豆分离蛋白暴露巯基含量不断增加。暴露巯基含量增加的原因一方面是热处理使蛋白质结构展开,部分掩埋的巯基暴露出来;另一方面,热处理使二硫键含量降低(图3B),二硫键和巯基的相互转变也会导致暴露巯基含量增加。
由图3还可以看出,经水力空化处理后,所有样品暴露巯基含量均显著降低(P<0.05),可分别由(5.11±0.06)、(5.56±0.25)μmol/g 和(6.89±0.23)μmol/g降低到(4.59±0.05)、(5.08±0.23)μmol/g 和(5.89±0.16)μmol/g。与此同时空化产生的极端高温、高压、高剪切力和湍流等作用会使二硫键断裂,二硫键的含量显著降低(P<0.05)(见图3B),所以游离巯基含量的降低并不是由巯基和二硫键含量相互转化引起的。另外,由图1和图2可以看出,水力空化会诱导蛋白质聚集体的形成,导致暴露巯基被重新掩埋在分子内部。另一方面,值得注意的是水力空化一个重要的空化效应是水分子断裂产生·H和·OH,·OH具有强氧化性,可以将巯基氧化成次磺酸或磺酸基,导致巯基含量降低[28]。
2.4 溶解性
蛋白质溶解性是决定蛋白质功能性质的重要因素,一般认为,溶解性良好的蛋白质往往具有较好的功能性质,如凝胶性、起泡性和乳化性等[31]。大豆蛋白经热处理后会在一定程度上形成可溶性或不溶性的聚集体,使其溶解性发生变化[32]。水力空化对大豆球蛋白溶解性的影响见图4。
由图4可以看出,未经过处理的大豆球蛋白表现出良好的溶解性(93.08±2.53)%,经过不同温度的热处理后,大豆球蛋白溶解性均降低,高于11S热变性温度(约80℃)处理明显降低了溶解性(P<0.05),90℃热处理下可使大豆球蛋白溶解性降低10.55%。说明热处理产生了不溶性聚集体。
由图4还可以看出,水力空化处理使大豆球蛋白的溶解性显著降低(P<0.05),其原因可能是水力空化产生的瞬时高温、高压、高剪切力、冲击波、微射流及湍流等空化效应使大豆球蛋白分子运动加剧,通过疏水相互作用形成聚集体导致大豆球蛋白溶解性降低,而水分子断裂产生的强氧化自由基(·OH)对大豆球蛋白的氧化作用可能是大豆球蛋白溶解性降低的另一原因。前期的研究发现[28]涡流空化处理大豆分离蛋白,可以有效地改善其溶解性,与本试验研究相反。这可能与水力空化产生的方式与所处理样品的不同有关系。

图4 水力空化对大豆球蛋白溶解性的影响Fig.4 Effect of hydrodynamic cavitation on solubility of soybean globulin
2.5 乳化活性和乳化稳定性
乳化活性(EAI)由最初形成的乳液在稀释的SDS溶液中的浑浊度决定,通常代表了蛋白质帮助油相分散到水相的能力[16],乳化稳定性(ESI)表示乳液保持稳定状态的能力,ESI越高,表示乳化性质越优[33]。水力空化对大豆球蛋白乳化活性和乳化稳定性的影响分别见图5A和图5B。
由图5A可以看出不同温度处理会导致大豆球蛋白乳化活性发生不同的变化,经70℃热处理后,大豆球蛋白乳化活性显著降低,而再继续增加处理温度大豆球蛋白乳化活性反而显著增加。有研究证明溶解性和表面疏水性对蛋白质的乳化性能非常重要[32,34],经热处理后,大豆球蛋白结构的展开(图1)和疏水性基团的暴露(图2)使蛋白质具有更好的吸附油水界面的潜力,使蛋白质乳化活性增加,经70℃热处理后,大豆球蛋白表面疏水性增加并不明显,与此同时经过热处理后,大豆球蛋白溶解性降低,这可能是导致大豆球蛋白乳化活性降低的原因。
经水力空化处理后,不同温度热再处理的蛋白质表现出不同的变化趋势,70℃热处理再经水力空化处理后大豆球蛋白乳化活性有轻微的增加,由(8.63±0.35)m2/g增加到(9.35±0.37)m2/g,而经过 80℃和 90℃热处理的大豆球蛋白经水力空化后乳化活性反而显著降低,可见水力空化在一定条件下能改善大豆球蛋白的乳化活性。经水力空化处理后大豆球蛋白表面疏水性降低(图2)且溶解性降低(图4)是导致经过80℃和90℃热处理大豆球蛋白乳化活性降低的原因,而在70℃热处理的蛋白经水力空化处理后表面疏水性显著增加(由 128.55±59.89增加到 1 555.3±56.28)是导致大豆球蛋白乳化活性增加的原因。

图5 水力空化对大豆球蛋白乳化活性和乳化稳定性的影响Fig.5 Effect of hydrodynamic cavitation on emulsion activity and emulsion stability of soybean globulin
由图5还可以看出,大豆球蛋白热处理温度越高乳化稳定性越差。而经过水力空化处理后,乳化稳定性均显著增加,增加的趋势和热处理温度有关,热处理温度越高,增加趋势越缓慢。70℃热处理后的蛋白质经水力空化处理后乳化稳定性可由(39.78±1.22)min增加到(103.1±0.64)min。可见水力空化处理在一定条件下能够有效改善大豆球蛋白的乳化稳定性。
3 结论
不同温度热处理后的大豆球蛋白经水力空化处理后,内源荧光光谱最大吸收峰蓝移,暴露巯基含量、二硫键含量和溶解性均降低,乳化稳定性增加,其中70℃热处理后的大豆球蛋白乳化稳定性可由(39.78±1.22)min增加到(103.1±0.64)min。70℃热处理后的大豆球蛋白表面疏水性和乳化活性增加,而80℃和90℃热处理后的大豆球蛋白表面疏水性和乳化活性均降低。可见,水力空化在一定条件下能诱导大豆球蛋白的理化性质发生变化,从而改善其乳化稳定性。关于水力空化在不同pH值和不同离子条件下对大豆球蛋白理化和功能性质的影响有待下一步研究。
