异食癖对哺乳期犊牛肠道黏膜通透性及免疫因子表达的影响
2020-10-17陈林杨靖崔巧荣徐晓锋
陈林,杨靖,崔巧荣,徐晓锋
(宁夏大学农学院,银川750021)
0 引 言
由于生活环境和营养物质的变化,新生犊牛的机体容易发生许多应激反应。异食癖可导致新生牛犊的代谢紊乱,味觉异常。异食癖犊牛容易咀嚼或食入非营养性物质,舔食牛毛、沙子等异物。异物进入消化道,导致消化系统紊乱,影响肠黏膜屏障,导致肠道通透性增加,增加犊牛腹泻率。根据研究报告,肠道是机体应激反应的中枢器官之一[1]。然而,随着分子生物学研究的发展,肠道不仅是营养物质消化吸收的主要场所,也是体内重要的免疫屏障。肠黏膜在维持肠道稳定中具有重要的作用,其结构和功能形成肠粘膜免疫系统,保护机体健康。肠黏膜屏障由肠黏膜机械屏障、化学屏障、生物屏障和免疫屏障组成[2];并且肠上皮细胞和肠紧密连接蛋白在肠黏膜屏障中起重要作用[3-5]。肠紧密连接蛋白与三种主要连接蛋白连接在一起,即肠道紧密连接蛋白-1(ZO-1)、咬合蛋白(Occludin)、闭合蛋白(Claudin)[6-9]。它们之间的紧密联系可以防止内毒素和其他有害细菌入侵肠道,维持肠道环境,保护机体健康。如果内毒素和有害细菌进入肠道,就会引起肠道细菌紊乱,使肠道黏膜屏障受损,肠道通透性增加。研究表明肠道通透性增加可能会影响氨基酸、蛋白质、脂类、碳水化合物和其他营养素的吸收和代谢,容易引发腹泻等疾病[10]。ZO-1与维持和调节上皮栅栏和屏障功能有关,还参与调节细胞物质转运,维持上皮极性等重要过程。Occludin功能涉及细胞间黏附、移动及通透性,一旦发生变异、减少和缺失可引起肠上皮细胞间隙通透性增加,故Occludin和ZO-1常被用来作为观察各种组织紧密连接屏障功能和通透性功能的指标[11]。研究显示,紧密连接蛋白的异常表达,直接影响肠黏膜屏障功能[12]。本试验通过Real-time PCR,探讨了异食癖对哺乳期犊牛肠道紧密连接蛋白表达的影响,为研究犊牛肠黏膜屏障的作用提供理论依据。
1 材料与方法
1.1 试验设计与动物
采用完全随机区组方差分析的试验方法,选择出生3天,体重相近的犊牛(54.7±5.83 kg)作为研究对象,根据犊牛舔食牛毛、沙子等症状,犊牛表现为被毛粗乱、消瘦,不做任何干预治疗,在犊牛出生后21 d选择持续具有异食癖的12头犊牛做为试验组(异食癖组),健康,无食牛毛、沙子等症状的12头犊牛作为对照组,整个试验周期持续到断奶(56 d)。
1.2 试验日粮及饲养管理
在犊牛出生后及时消除口腔和鼻孔内的黏液,用消毒的剪刀剪断脐带并进行药浴处理,擦干被毛,饲喂初乳。出生后1 h内饲喂1.5~2.0 kg的初乳,以后随着食欲的增加而逐渐提高饲喂量,于每日07:00和18:00饲喂混合牛奶,自由饮水和采食开食料,在犊牛能够站立时,将其移入犊牛岛(1.5 m×3.0 m)进行饲养,试验阶段对犊牛岛进行定期消毒处理。其中开食料组成及营养水平见表1。
1.3 犊牛样品采集
整个试验周期持续到断奶(56 d),试验结束后,每组随机选取5头进行屠宰,将犊牛的十二指肠组织取出,用冷却后的生理盐水冲洗肠段中的食糜,冲洗后将肠段剪成约2 cm的小段放入离心管内,液氮中过夜,-80℃保存备用。把保存的肠段组织样品放在用液氮预冷的研钵中研磨成白色粉末,取0.1 g研磨好的组织样品,加入0.9 mL的灭菌生理盐水,充分摇匀后,3 000 r/min离心10 min,吸取上清液,-80℃保存。使用时避免反复冻融。
1.4 引物设计与合成
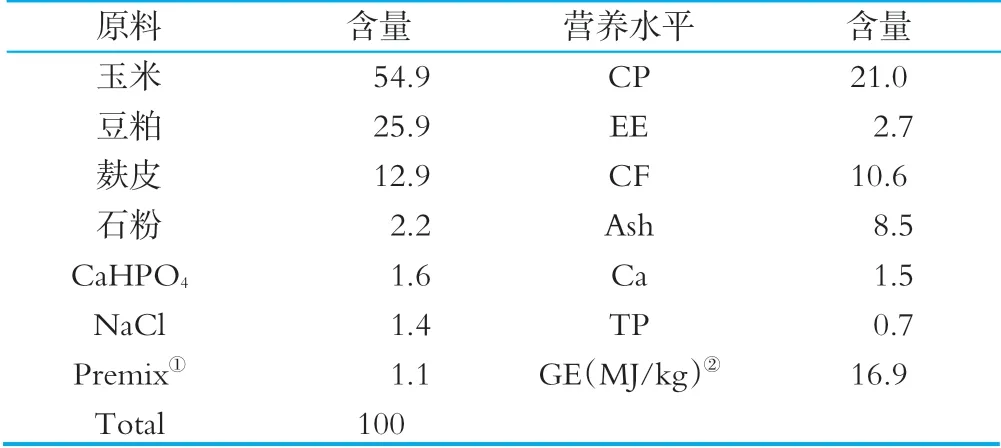
表1 开食料组成及营养水平(干物质基础) %
采用引物5.0引物设计软件对奶牛肠黏膜6个基因和β-内参基因序列进行引物设计,引物见表2。

表2 Real-time PCR所用引物
1.5 RNA提取
将采集的样品移出-80℃,然后用Trizol法提取RNA,步骤如下:
(1)取适量细胞/取适量组织在液氮中充分研磨,加入1 mL Trizol,震荡混匀室温放置5 min;
(2)加入0.2 mL氯仿,剧烈震荡15 s,静置3 min;
(3)4℃12 000 rpm离心10 min,把上层水相转移到新的管中;
(4)加入等体积异丙醇,混匀,静置20 min;4℃12 000 rpm离心10 min,去上清;
(5)用1mL 75%DEPC酒精洗涤沉淀;
(6)4℃8 000 rpm离心5 min,弃去液体;
(7)室温晾干后,加入30μL DEPC处理过的ddH2O水,溶解RNA,鉴定后于-80℃冻存备用;
(8)取样液2 uL于2%的琼脂糖凝胶中电泳。
1.6 cDNA合成的逆转录
以1μg总RNA为模板,按照Bestar qPCR RT Kit说明书配制逆转录反应体系,总体系为20μL,合成cDNA第一链。
1.7 Real-time PCR
用Agilent Stratagene荧光定量PCR仪Mx3000P进行荧光定量PCR试验,Real-time PCR扩增的反应体系为20μL(表4),PCR反应条件:94℃2 min,94℃20 s,58℃20 s,72℃20 s,40循环。

表3 cDNA合成反应体系

表4 Real-time PCR扩增的反应体系
1.8 统计分析
利用LIVAK和SCHMITTGEN[13]建立的2-△△Ct方法计算肠黏膜屏障蛋白和细胞因子靶向基因的相对表达量,Ct值表示荧光实时定量PCR循环阈值,即扩增过程中每管荧光信号值达到设定阈值时所经历的循环次数[14]。计算得到相对表达量=2-△△Ct,其中,△Ct=(目的基因Ct-内参Ct)的平均值±标准偏差;△△Ct=(待测样品中目的基因△Ct-参照样品中目的基因△Ct)的平均值±标准偏差(若无参照样品则选择Ct最大的样品为参照进行计算);相对样品初始模板量=(2-△△Ct)的平均值±标准偏差。肠道通透性指数统计分析采用EXCELL 2003和SAS 8.2完全随机分组方差分析,采用SNK最小显著性方法比较显著性差异,以P<0.05为显著性差异标准。
2 结 果
2.1 Real-time PCR的特异性
通过qRT-PCR扩增后,由图1可知目的基因和偏好基因的引物可扩增出特异产物,通过离解曲线分析发现,由图2可知肠黏膜屏障蛋白mRNA和β-肌动蛋白基因的荧光定量产物均为单峰,无其它杂峰,这表明几乎所有收集到的荧光信号都是用SYBR-GREEN扩增的PCR产物,无其它干扰。
2.2 mRNA的表达水平
通过Real-time PCR方法检测肠黏膜蛋白mRNA,计算其相对表达量,由表5可知异食癖组犊牛肠黏膜蛋白ZO-1相对表达量显著低于对照组(P<0.05),Occludin和Claudin相对表达量低于对照组,但差异不显著(P>0.05)。由表6可知异食癖组犊牛肠道免疫因子TLR 4相对表达量显著低于对照组(P<0.05),TNF-α和IL-1β相对表达量极显著高于对照组(P<0.01)。
3 讨 论
3.1 异食癖对哺乳期犊牛肠道紧密连接蛋白表达的影响
在本试验中异食癖组犊牛肠黏膜蛋白ZO-1相对表达量显著低于对照组,Occludin和Claudin相对表达量低于对照组,但差异不显著。而ZO-1、Occludin和Claudin是构成细胞间紧密连接的重要蛋白分子,在维持细胞极性和紧密连接屏障功能方面起着重要作用。肠道黏膜上皮屏障是抵抗肠道中病原微生物和有毒物质入侵的第一道防线[15]。紧密连接蛋白(tight junctions,TJ)是构成肠道黏膜屏障、决定肠壁通透性的重要蛋白质分子,对紧密连接的组成和功能发挥有很大影响[16]。
ZO-1,也称为紧密连接蛋白-1,该基因的编码位于细胞质膜表面的细胞紧密连接蛋白上。编码的蛋白质可能参与细胞-细胞连接处的信号转导。HK-2细胞中Claudin-2,Occludin和ZO-1的消耗对TER(Transepithelial electrical resistance)和大分子通量有不同的影响,证明了Claudin-2,Occludin和ZO-1的整合对于维持近端小管上皮的功能是必需的[17]。Zhang等[8]研究致病性大肠杆菌感染小鼠的模型,发现肠上皮细胞间TJ相关蛋白Occludin由胞膜区易位到胞质内,同时伴有肠上皮细胞旁路渗透性增加,推测Occludin的分布异常可能导致肠上皮屏障功能受损,进而参与腹泻的发生、发展过程。缺乏紧密连接蛋白Claudin的鼠模型,升高了细胞旁路的溶质流通量,促发了肠道的炎症发生[18],这些研究表明肠道紧密连接蛋白与肠道渗透性,肠道屏障功能关系密切。在本试验中异食癖组犊牛肠黏膜蛋白ZO-1相对表达量显著低于对照组,Occludin和Claudin相对表达量低于对照组,表明患有异食癖的哺乳期犊牛破坏了肠道的紧密连接蛋白的功能,造成了肠道黏膜屏障受损,进而使异食癖犊牛肠道通透性增加。
细胞外Ca2+浓度对TJ的影响与PKC信号通路有关。低钙条件下培养MDCK(madindarbycaninekindy,MDCK)细胞出现TJ破坏现象,加入PKC激动剂可观测到Occludin蛋白的磷酸化,并向TJ处移位,重建TJ。此作用可被PKC的抑制剂所抑制[19]。Kale等[20]发现Occludin的酪氨酸磷酸化降低了其结合ZO-1,ZO-2和ZO-3的能力,从而引起TJ的断裂。与细胞外Ca2+相比,细胞内Ca2+主要改变ZO-1与肌动蛋白的结合,并改变Occludin在细胞内的位置。低氧条件下细胞内Ca2+的短暂升高,钙调蛋白依赖的激酶等细胞外信号相关激酶的激活,引发级联反应,从而使Occludin蛋白等TJ相关蛋白在mRNA水平及蛋白表达层面上产生改变,最终引起细胞屏障功能破坏[21]。周景明等[22]研究发现当常量矿物质元素如钙、磷、钠、钾、硫以及微量元素如锌、钴、铁等供给量不足,或各种矿物元素彼此之间的比例失衡时,奶牛就会舔食泥沙、墙壁、饲槽以及啃食金属,长期喂给大量精料或酸性饲料过多,都可引起体内碱的消耗过多,而致钙、磷比例失调,也会形成异食癖。眭丹等[23]研究发现铜、锌、硒缺乏会引起舍饲滩羊异食癖的发生。目前关于动物异食癖的形成机理还不十分清楚,本研究发现异食癖犊牛肠黏膜蛋白ZO-1相对表达量显著低于对照组犊牛,Occludin和Claudin相对表达量低于对照组,但差异不显著,异食癖犊牛肠道通透性增加,对犊牛健康尤其肠道健康存在重要影响。
图1 目标基因和偏好基因的扩增图

表5 肠道黏膜紧密连接蛋白mRNA相对表达量

表6 肠道免疫因子mRNA相对表达量
3.2 异食癖对哺乳期犊牛肠道免疫因子表达的影响


图2 目标基因与偏好基因的解离曲线
在本试验中异食癖组犊牛肠道免疫因子TLR 4相对表达量显著低于对照组。在肠道中识别非特异的微生物抗原是通过类型识别受体如Toll样受体家族实现的,Toll样受体(Toll like receptor,TLR)是一类天然免疫受体,是先天免疫系统重要的组成部分[24],TLR 4是人类发现的第一个TLR相关蛋白,当TLR 4与相应配体结合后,信号转导到TLR区域,然后进一步激活核因子κB(nuclear factor-κB,NF-κB)和丝裂原活化蛋白激酶信号通路,从而促进各种炎性细胞因子基因表达的激活。TLR 4也是介导内毒素/脂多糖(lipopolysaccharide,LPS)应答的主要受体[25]。Shi等[26]发现,游离脂肪酸可以激活脂肪细胞和巨噬细胞的TLR 4受体,TLR 4缺乏的细胞则游离脂肪酸的炎性作用被阻断,TLR 4是营养脂类和炎症之间的分子联系,参与调节能量平衡和先天免疫系统,以应对营养环境的变化。有研究发现TLR 4缺陷破坏了肠道微生物群,降低了小鼠对肺炎链球菌耐药性[27]。而异食癖组犊牛肠道免疫因子TLR 4相对表达量显著低于对照组,表明患有异食癖的哺乳期犊牛肠道免疫机能下降。
本试验中异食癖组犊牛肠道免疫因子TNF-α和IL-1β相对表达量极显著高于对照组,异食癖犊牛发生肠黏膜炎症损伤时,炎症早期最先分泌的促炎细胞因子主要是IL-1β和TNF-α,这些细胞因子可以启动其他细胞因子的释放[28]。TNF-α是炎症反应过程中出现最早、最重要的炎性介质。TNF-α可通过多种方式促进系膜细胞的增殖与分化,并促使系膜细胞分泌多种细胞因子。TNF-α是参与全身性炎症的细胞信号传导蛋白(细胞因子),并且是构成急性期反应的细胞因子之一。它主要由活化的巨噬细胞产生,TNF的主要作用是调节免疫细胞。研究表明TNF-α可能通过激活NF-κB,增加肌球蛋白轻链激酶(myosin light chain kinae,MLCK)的转录及表达,MLCK又激活MLC,引起肌动和肌球蛋白收缩,进而增加Occludin等跨膜蛋白的内吞作用[29],减少其在TJ上的定位,导致屏障功能失调[30]。本试验中异食癖组犊牛肠道免疫因子TNF-α相对表达量极显著高于对照组,说明患有异食癖的哺乳期犊牛肠道通透性增加,降低了机体免疫能力。这与胡丹丹等[31]研究一致。
TNF-α还会消耗细胞内的抗氧化剂谷胱甘肽(GSH)[32]。转基因小鼠中TNF-α的过度表达通过消耗总细胞谷胱甘肽水平诱导氧化还原状态和谷胱甘肽调节酶的差异变化[33]。体外研究还证明TNF-α消耗细胞GSH水平。用TNF-α处理人肺动脉内皮细胞降低了细胞的GSH水平[34],这种谷胱甘肽的消耗增强了内皮细胞对氧中毒的易感性[35]。胡丹丹等[31]研究表明患有异食癖的犊牛抗氧化能力较弱。本试验中异食癖犊牛肠道免疫因子TNF-α相对表达量极显著高于对照组,表明异食癖犊牛TNF-α消耗了细胞内的GSH,患有异食癖的哺乳期犊牛抗氧化能力较弱。
TNF-α可促进IL-1β的分泌与释放,参与机体内的炎症反应和发热反应[36]。IL-1β是白介素1细胞因子家族的成员。该细胞因子由活化的巨噬细胞作为前蛋白产生,其通过半胱天冬酶1(CASP1/ICE)蛋白水解加工成其活性形式。该细胞因子是炎症反应的重要介质,参与多种细胞活动,包括细胞增殖、分化和凋亡。IL-1β的产生增加引起许多不同的自身炎症综合征,最明显的是由于炎性体受体NLRP3的突变引起IL-1β的加工而被称为Cryopyrin相关的周期综合征(CAPS)的单基因条件[37]。AlSadi等[19]发现IL-1β导致肠上皮TJ通透性增加,IL-1β可能通过降解I-κB,激活了NF-κB,进而抑制Occludin蛋白转录启动子的活性,导致Occludin的mRNA表达量下降,破坏了TJ的功能。本试验中异食癖组犊牛肠道免疫因子IL-1β相对表达量极显著高于对照组,表明患有异食癖的哺乳期犊牛引起了肠道的炎症反应,进而造成了机体免疫力下降。
4 结 论
患有异食癖的哺乳期犊牛肠黏膜蛋白ZO-1相对表达量显著低于对照组,肠道通透性增加。患有异食癖的哺乳期犊牛肠道免疫因子TLR 4相对表达量显著低于对照组,肠道免疫因子TNF-α和IL-1β相对表达量极显著高于对照组,异食癖犊牛肠道免疫因子表达下调,肠道黏膜炎症因子表达上调,肠道抗氧化能力减弱。
