免疫共沉淀联合质谱技术筛选柔嫩艾美耳球虫钙依赖蛋白激酶3互作蛋白
2020-10-17赵焕之赵其平朱顺海刘桂玲李志行韩红玉
赵焕之,赵其平,朱顺海,王 璐,刘桂玲,2,李志行,2,董 辉,黄 兵,韩红玉
(1.中国农业科学院上海兽医研究所 农业农村部动物寄生虫学重点开放实验室,上海 200241;2.上海师范大学生命与环境科学学院,上海 200234)
钙依赖蛋白激酶(calcium-dependent protein kinases,CDPKs)是钙离子信号通路中下游效应分子中的一类,由Hetherington等于1987年在大豆中首次发现,是一类丝氨酸/苏氨酸蛋白激酶,主要分布于植物、绿藻和一些原生生物中,目前在细菌、真菌、酵母、线虫和哺乳动物的细胞中尚未发现[1-3]。CDPKs由可变区、催化区、连接区和调控区四部分组成,其中调控区为钙离子结合区,连接区与调控区共同构成了该酶的活性域,当有Ca2+存在时,Ca2+与调控区结合导致构象改变,从而发挥效应[4-5]。
免疫共沉淀联合质谱技术是一种用于筛选互作蛋白的有效方法,已广泛应用于许多研究领域。Phee等[6]用该技术鉴定了拟南芥中的光敏色素相互作用蛋白的潜在互作蛋白,并发现共沉淀结合蛋白质组学分析是鉴定新的相互作用蛋白和确定细胞内蛋白-蛋白质相互作用的有效方法。在神经科学领域,Free等[7]应用该技术寻找与神经受体相互作用的蛋白质。丝氨酸/苏氨酸激酶Akt是细胞存活的关键蛋白,与多种蛋白质相互作用,Huang等[8]利用该技术鉴定出了2个潜在的与Akt存在相互作用的蛋白。国内研究人员利用该方法筛选获得了6个可能与羊亲环蛋白(cyclophilin B,CypB)相互作用的羊传染性脓疱病毒相关蛋白、10个绵羊α-生育酚(α-TTP)转移蛋白的潜在互作蛋白[9-10]。此外,与人类睾丸高迁移率蛋白4(high mobility group protein B4,HMGB4)相互作用的蛋白及与A型人流感病毒M2蛋白相互作用蛋白也是用该方法筛选获得的[11-12]。
研究发现,顶复门原虫CDPKs控制着虫体许多至关重要的Ca2+依赖的生理过程,包括微线体的分泌、细胞骨架的动力学和运动复合体的调控等,从而影响虫体的滑移运动、细胞入侵和逃逸、发育阶段的转化、分化繁殖等[13-14]。比如:疟原虫CDPK3与其穿透按蚊小肠上皮细胞屏障有关[15];弓形虫CDPK3与虫体移行有关,Gaji等[16]发现TgCDPK3可以通过磷酸化肌球蛋白马达使虫体逸出宿主细胞更加容易;韩红玉等[17]发现了柔嫩艾美尔球虫EtCDPK3与虫体入侵宿主细胞有关,王自文等[18]对柔嫩艾美耳球虫CDPK4进行了特性分析,发现EtCDPK4是一种完全依赖于Ca2+的蛋白激酶,且抗重组蛋白rEtCDPK4多克隆抗体对球虫子孢子入侵DF-1细胞的抑制率可达52%;吕凌等[19]筛选并验证了与EtCDPK4相互作用的柔嫩艾美耳球虫丝氨酸蛋白酶抑制蛋白(EtSerpin)。
蛋白质通过与一个或多个蛋白相互作用来执行许多的细胞功能。EtCDPK3是一种丝/苏氨酸激酶,其所接收的胞外信号必定传递给下游的效应分子,与下游作用底物的相互作用是其发挥作用的基础。因此,本研究以柔嫩艾美耳球虫子孢子为试验材料,利用免疫共沉淀技术筛选与EtCDPK3互作的蛋白,并结合质谱定性鉴定分析,初步筛选出6个可能与EtCDPK3相互作用的虫体相关蛋白,本研究结果为EtCDPK3在钙离子信号通路中的功能研究奠定了理论基础。
1 材料和方法
1.1 虫株与试剂E.tenella孢子化卵囊上海株(资源编号:CAAS21111601,中国农业科学院上海兽医研究所动物原虫病团队保存);EtCDPK3单克隆抗体与多克隆抗体均由本实验室制备与保存;免疫共沉淀试剂盒购自赛默飞世尔科技(中国)有限公司;银染试剂盒购自上海碧云天生物技术有限公司。
1.2 虫体总蛋白的提取取纯化好的储存在液氮中的柔嫩艾美耳球虫子孢子,PBS洗3遍,然后加入200 μL RIPA强裂解液重悬沉淀,再加入2 μL蛋白酶抑制剂和适量的玻璃珠,在涡旋振荡器上间或振荡。振荡2 min,冰上放置30 s,反复振荡45 min。然后12 000×g,4℃离心2 min,吸取上清液即为虫体总蛋白。取20 μL进行12% SDS-PAGE电泳,电泳结束后采用考马斯亮蓝进行染色、脱色。剩下的虫体蛋白保存至-20℃备用。
1.3 免疫共沉淀筛选步骤参照Pierce™Co-Immunoprecipitation Kit操作说明书进行。分别设置单克隆抗体样品组(Mb)和多克隆抗体样品组(Pb)及两个阴性对照组(Mb-N,Pb-N),采用试剂盒中推荐的未被激活的耦合树脂作为阴性对照,阴性对照组全部操作过程与正常试验耦合树脂组一致。抗体固定:加50 μL树脂于离心柱,1000×g,离心1 min;用交联缓冲液洗涤树脂2次;加稀释好的抗体,室温旋转孵育120 min;离心,用交联缓冲液洗涤2次;加入含有氰基硼化钠的淬灭缓冲液,室温旋转混匀15 min;用交联缓冲液洗涤1次,洗涤缓冲液洗涤6次。捕获目的蛋白:用裂解缓冲液洗涤树脂2次;加入稀释好的虫体蛋白,4℃旋转孵育过夜;离心,并用裂解缓冲液洗涤3次。洗脱:将离心柱置于新的收集管内,加入10 μL洗脱缓冲液,离心;再加入50 μL洗脱缓冲液,室温静置5 min;离心,收集流穿液,即为蛋白样品。
1.4 SDS-PAGE检测取1.3中的蛋白样品进行12%SDS-PAGE电泳,电泳结束后用硝酸银快速银染试剂盒进行凝胶染色。即先固定、乙醇洗涤、水洗、增敏、再水洗2次、银染、水洗,然后显色,最后终止显色。
1.5 质谱鉴定根据染色结果,对比样品组与对照组,找出两组之间的差异条带。将剩下的蛋白样品送至上海厚基生物科技有限公司进行质谱定性鉴定分析,以获得该差异蛋白条带的生物信息。即将溶液状态样品经胶内酶解后,采用毛细管高效液相色谱上样检测,之后用Q Exactive质谱仪进行质谱分析。
1.6 ESI质谱数据分析用Maxquant软件分析所获得的原始数据,最后得到鉴定的蛋白质结果。相关参数如下:Enzyme=Trypsin、Missed cleavage=2、Fixed modification:Carbamidomethyl(C),Variable modification:Oxidation(M)。样品搜索使用Uniprot数据库搜索使用Uniprot数据库:uniprot_Eimeria tenella 9318(数据库包含9318 条序列)。Peptides tolerance:20 ppm,MS/MS tolerance:0.1 Da,Maxquant结果过滤参数为:fdr≤0.01。
2 结果
2.1 虫体蛋白的SDS-PAGE分析取所提取的子孢子蛋白20 μL,混合5 μL 5×SDS-PAGE上样缓冲液,沸水中煮7 min至蛋白变性,然后用12% SDS-PAGE蛋白凝胶进行检测,经考马斯亮蓝染色2 h,脱色1 h,结果见图1,条带清晰,可用于后续实验。
图1 子孢子全蛋白的SDS-PAGE分析Fig.1 SDS-PAGE analysis of sporozoite proteins
2.2 免疫共沉淀产物的SDS-PAGE分析SDS-PAGE分析结果显示,与阴性对照组相比,单克隆抗体组与多克隆抗体组均有差异条带(图2)。
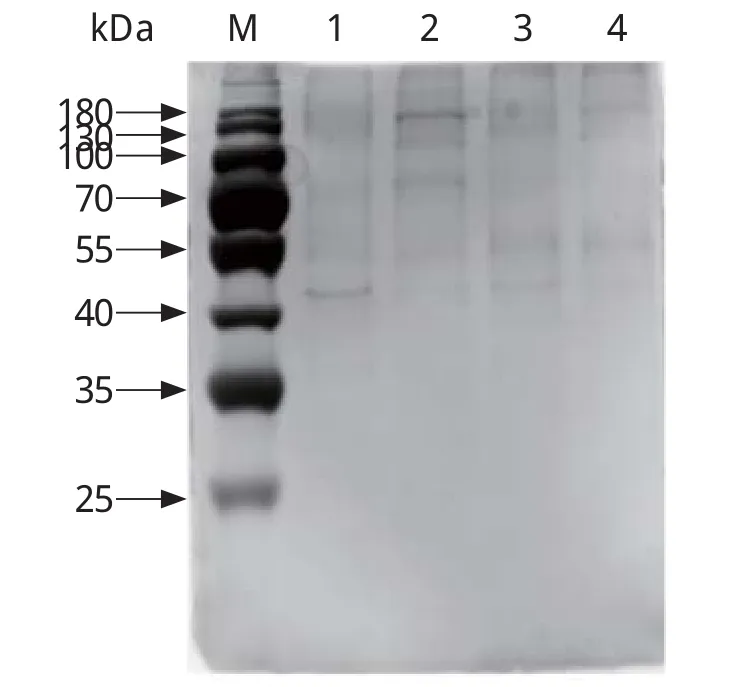
图2 免疫共沉淀洗脱液SDS-PAGE分析Fig.2 SDS-PAGE analysis of co-immunoprecipitation production
2.3 质谱鉴定结果分析取免疫共沉淀样品进行ESI质谱测试,鉴定结果见表1。共筛选出:Mb组145个、Mb-N组167个、Pb组227个、Pb-N组189个潜在蛋白。将筛选获得的数据进行整理,取两个样品组中有而阴性对照组中没有的,初步筛选获得6个可能与EtCDPK3相互作用的虫体相关蛋白(图3、表2),包括ATP合成酶γ链(ATP synthase gama chain)、葡萄糖磷酸变位酶1(phosphoglucomutase/parafusin related protein 1,PGM1)、核苷二磷酸激酶(nucleoside diphosphate kinase,NDK)、6-磷酸葡糖酸脱氢酶(6-phosphogluconate dehydrogenase,6PGDH)和2个未知保守蛋白。

表1 ESI质谱测试结果Table 1 ESI Mass Spectrometry results
图3 免疫共沉淀洗脱液ESI质谱测试结果Fig.3 ESI mass spectrometry analysis of co-immunoprecipitation production
3 讨论
柔嫩艾美耳球虫属于顶复门原虫,是鸡球虫病的主要病原体,其在7种感染鸡的球虫中致病力最强。柔嫩艾美耳球虫主要寄生于鸡的盲肠,因不断产生裂殖子而反复入侵肠道上皮细胞,从而导致上皮细胞受损,致使盲肠出血,造成感染鸡死亡,给世界养鸡业带来严重的经济损失。目前,鸡球虫病的防治主要依靠抗球虫药物预防和疫苗免疫[20-21]。然而,由于耐药性、药物残留、疫苗的成本较高等问题,迫切需要新的防治办法来控制球虫病。由于球虫生活史的复杂性,其感染和致病也是一个复杂的生物学过程,往往借助多种信号转导途径促进球虫入侵宿主细胞,从而介导球虫的侵袭过程。EtCDPK3是钙离子信号通路中的重要效应分子,在虫体入侵宿主细胞过程中发挥重要作用。然而,EtCDPK3对虫体入侵宿主细胞过程的详细调控机制和靶点仍不清楚。
对EtCDPK3前期研究发现,抗rEtCDPK3的抗体能抑制子孢子入侵。然而对于EtCDPK3是如何促进虫体入侵宿主细胞以及在细胞内的生长、发育、繁殖过程中发挥作用的,目前还不清楚。许多细胞过程利用蛋白质与蛋白质的相互作用来传递和控制如生长、增殖和分化等一系列复杂的生物功能的信号[22]。目前,随着蛋白质互作研究的深入,研究方法也日渐成熟,如酵母双杂交技术、免疫共沉淀技术、GST或His pull-down技术等。免疫共沉淀是研究蛋白和蛋白相互作用的一种常用方法,即用抗体去免疫沉淀特定抗原(诱饵蛋白)并且共沉淀任何与该抗原相互作用的蛋白(目标蛋白)。本研究以EtCDPK3作为诱饵蛋白,通过免疫共沉淀方法获取与其互作的蛋白。但由于虫体全蛋白样本量大,可能会造成假阳性或者非特异性吸附,而且传统的免疫共沉淀使用蛋白A或者蛋白G来固定抗体,因此最终洗脱液中会含有相应抗体的重链和轻链,二者迁移形成的条带可能和目标蛋白的条带重合从而掩盖重要的实验结果,采用Thermo Science Pierce免疫共沉淀(Co-IP)试剂盒可避免这一系列问题的产生。该方法是通过将纯化的抗体直接固定在琼脂糖基质上,从虫体全蛋白中分离天然蛋白复合体。通过共价偶联抗体至胺基活化树脂,从而避免假阳性和非特异性吸附的问题。此外,对抗体浓度以及反应条件进行反复摸索和优化,提高了实验的成功率。
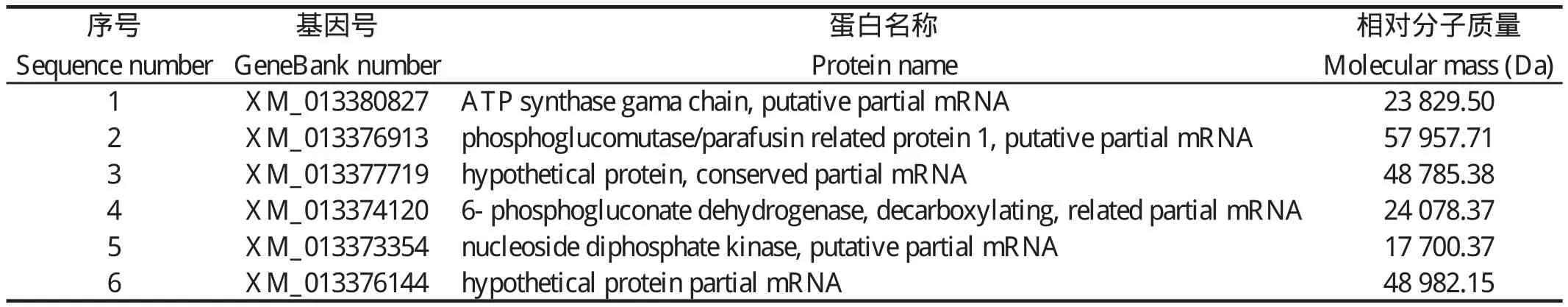
表2 EtCDPK3免疫共沉淀产物经质谱鉴定获得的潜在相互作用的蛋白质Table 2 Potential interaction proteins of EtCDPK3 obtained by mass spectrometry
筛选获得的6个蛋白中,有2个保守的未知蛋白,另外4个中在其他物种研究较多的是核苷二磷酸激酶(nucleoside diphosphate kinase,NDK),NDK是一种通过催化γ-磷酸从三磷酸核苷(nucleoside triphosphate,NTPs)转向二磷酸核苷(nucleoside diphosphate,NDPs)进而来平衡细胞内NTPs池的一种可逆转移酶[23]。NDK进化比较保守,在真核生物和原核生物中都有表达[23]。NDK除了在核苷酸代谢中起基础性作用外,还在蛋白质组氨酸磷酸化、DNA切割/修复和基因调控等方面发挥重要作用[24-26]。在寄生虫中,NDKs是锥虫嘌呤回收途径中的关键酶,参与维持宿主细胞的完整性,从而使得虫体受益[27-28]。Vieira等[29]发现吡咯-吲哚酮(pyrrole-indolinone)SU11652可以抑制利什曼原虫NDK从而起到药物治疗作用。在钙离子作为第二信使的信号通路中,cAMP通过对PKA的作用间接作用于离子通道(Ca2+、Na+等),进而传递胞外信号;cAMP的产生依赖于腺苷酸环化酶(AC)的作用,而NDK则是活化AC的关键分子[30],因此,推测EtCDPK3和NDK相互作用将信号传递给下游分子。另一种研究较多的是6-磷酸葡糖酸脱氢酶(脱羧)(6-phosphogluconate dehydrogenase,6PGDH),其主要参与糖代谢。在先前的报道中,6PGDH的活性可被葡萄糖1,6-二磷酸抑制,二者共同参与磷酸戊糖途径[31]。酿酒酵母6PGDH活性的变化与细胞间磷酸戊糖过程速率变化相似[32]。6PGDH是磷酸戊糖途径的第三种酶,是细胞NADPH的主要生成因子。而NADPH作为电子供体来还原抗氧化剂-硫氧还蛋白或谷胱甘肽(GSSG)。因此,6PGDH在保护细胞免受氧化应激方面起着至关重要的作用[33]。ATP合成酶γ链(ATP synthase gama chain)是组成ATP合成酶的关键部分,而线粒体ATP 合成酶是线粒体氧化磷酸化的关键酶。ATP合酶γ亚基转动时导致构象改变,然后合成ATP。ATP合成酶的活性受到代谢物(ADP;Ca2+;Mg2+等)和信号蛋白的调节[34-36]。我们推测,ATP合成酶在虫体能量合成和转运过程中是必须的。在研究cAMP与cGMP通路的关系时发现,ATP合成酶促进ATP的合成,ATP通过与AC及PKA调节着Ca2+通道[30]。在哺乳动物中,葡萄糖磷酸变位酶1(phosphoglucomutase 1,PGM1)是一种重要的代谢酶,通过葡萄糖1-磷酸和6-磷酸葡萄糖的相互转化来调节葡萄糖的稳态,介导糖酵解和糖异生之间的转换[37]。Stiersa等[38]发现,PGM1缺乏引起的结构紊乱是导致酶功能障碍的分子机制。以上4个潜在的可能与EtCDPK3发生相互作用的蛋白,多与糖代谢和能量转运有一定的关系,我们推测这些蛋白在钙离子信号通路中协助EtCDPK3执行信号的传递,参与糖类代谢,提供能量。这些蛋白在球虫生活史过程中发挥的功能目前还不清楚,推测这些蛋白在虫体入侵宿主细胞时与EtCDPK3协同发挥作用,提供虫体入侵宿主细胞时所需的能量。但他们是否是EtCDPK3的效应分子,以及在虫体入侵宿主细胞过程中是否发挥了一定的作用还有待于进一步研究。
本研究结果中,单克隆抗体(Mb)组筛选出145个潜在目的蛋白,而多克隆抗体(Pb)组则筛选出来227个潜在目的蛋白,这些蛋白数目并不一致,其中原因可能是多克隆抗体特异性较差,与非特异性抗体相互作用的蛋白也一同被沉淀和洗脱下来,因此其数目多于单克隆抗体组。单克隆抗体(Mb)组与其阴性对照(Mb-N)组相比,其阴性对照组有167个蛋白被检测到,可能是蛋白与树脂的非特异性结合造成的。
在获得EtCDPK3免疫共沉淀产物的基础上,利用SDS-PAGE进行分离,经硝酸银染色可见,与阴性对照组相比单克隆抗体样品组(Mb)和多克隆抗体样品组(Pb)的免疫共沉淀产物均有差异条带;对获得的差异蛋白带进行质谱鉴定分析,获得6个可能与EtCDPK3互作的蛋白。这些蛋白是否能够与EtCDPK3发生互作并参与子孢子入侵宿主细胞过程,将在今后的研究中进一步验证。上述研究结果为弄清EtCDPK3在虫体入侵宿主细胞过程中发挥作用的分子机制提供了一定的基础。
