替莫唑胺在恶性脑胶质瘤中的应用效果分析
2020-10-17涂博郭立岭王植海
涂博,郭立岭,王植海
新乡市第二人民医院神经外科,河南 新乡4530020
脑胶质瘤属于临床常见的颅内恶性肿瘤之一,进展速度快,恶性程度高,早期主要表现为头痛、癫痫、恶心呕吐等症状,手术是唯一可以根治的方案,但术后极易出现复发,影响患者脑组织功能,严重影响患者的生活质量和身心健康[1]。近年来,放射治疗已成为脑胶质的重要治疗方法,调强技术可以克服外照射的缺点,降低邻近器官的照射剂量并提高肿瘤部位的照射剂量,有助于控制肿瘤,减少重要器官的损伤,替莫唑胺则是新型的咪嗪类衍生药物,口服可以快速吸收,通过血脑屏障直接聚集在脑肿瘤组织中,通过让肿瘤细胞的DNA 发生烷基化达到控制肿瘤效果的作用[2]。本研究分析了放射治疗联合替莫唑胺治疗恶性脑胶质瘤的效果,旨在为临床脑胶质瘤的治疗提供指导依据,现报道如下。
1 资料与方法
1.1 一般资料
选取2017 年3 月至2020 年1 月新乡市第二人民医院收治的恶性脑胶质瘤患者。纳入标准:均经病理学证实为多形性胶质母细胞瘤或星形细胞瘤;世界卫生组织(WHO)分级为Ⅲ~Ⅳ级;年龄﹥18 岁;生存期﹥3 个月;卡氏功能状态(Karnofsky performance status,KPS)≥60 分。排除标准:合并肝肾功能障碍、免疫系统疾病、内分泌疾病等其他严重疾病;合并其他恶性肿瘤。依据纳入和排除标准,本研究共纳入85 例恶性脑胶质瘤患者,根据治疗方案分为观察组(n=42)和对照组(n=43),对照组患者接受放射治疗,观察组患者在此基础上联合替莫唑胺治疗。观察组中男24 例,女18 例;年龄(40.12±9.87)岁;KPS 评分为(70.15±9.64)分;病理类型:多形性胶质母细胞瘤25 例,星形细胞瘤17 例;WHO 分级:Ⅲ级30 例,Ⅳ级12 例。对照组中男26 例,女17 例;年龄(39.40±10.11)岁;KPS 评分为(69.48±10.11)分;病理类型:多形性胶质母细胞瘤24 例,星形细胞瘤19 例;WHO 分级:Ⅲ级29例,Ⅳ级14 例。两组患者性别、年龄和病理类型等临床特征比较,差异均无统计学意义(P﹥0.05),具有可比性。
1.2 治疗方法
对照组患者接受放疗,患者平卧,戴好头部固定面罩,采用CT 进行增强扫描,扫描范围从头顶至第二颈椎,将扫描图像输入计算机放疗系统,重建图像并勾画肿瘤靶区、临床靶区及可能受影响的器官,采用6MV X 线照射100%等剂量曲线完全包绕肿瘤区,每次剂量2.0~2.5 Gy,总剂量50~60 Gy,5 天为1 个疗程,每个疗程结束后休息2 d,治疗4~6 个疗程。观察组患者放疗期间给予替莫唑胺空腹口服,150 mg/m2,每天1 次,连续治疗5 天,间隔23 天,28 天为1 个疗程,治疗2 个疗程。所有患者在出院时留存好随访资料,包括微信、家庭住址、电话等,在患者出院后每2 周采取电话、家访等不同形式对患者进行随访,记录患者病情变化并录入计算机。
1.3 观察指标和评估标准
①抽取两组患者空腹静脉血3 ml,以2000 r/min离心30 min,分离血清,采用酶联免疫吸附测定检测两组患者TGF-b、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)水平,严格按照试剂盒说明书操作。②根据实体瘤疗效评价标准1.1(response evaluation criteria in solid tumour 1.1)[3]评估两组患者的临床疗效:完全缓解(complete response,CR),病灶完全消失;部分缓解(partial response,PR),病灶体积较治疗前缩小≥50%;疾病稳定(stable disease,SD),为病灶体积较治疗前缩小﹤50%或增大﹤25%;疾病进展(progressive disease,PD),病灶体积较治疗前增大≥25%或出现新病灶。总有效率(%)=(CR+PR)例数/总例数×100%。③治疗前后,比较两组患者的免疫功能指标比较,包括CD3+、CD4+和CD8+。④比较两组患者的不良反应发生情况,包括放射性脑水肿、胃肠道反应、骨髓抑制、肝肾功能受损和贫血。
1.4 统计学方法
采用SPSS 22.0 软件对所有数据进行统计分析,计量资料以均数±标准差(x-±s)表示,组间比较采用t 检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;等级资料的比较采用秩和检验;采用Kaplan-Meier 法绘制生存曲线,组间比较采用Log-rank 检验;以P﹤0.05 为差异有统计学意义。
2 结果
2.1 临床疗效的比较
观察组患者的临床疗效优于对照组患者,差异有统计学意义(Z=2.468,P=0.014);观察组患者临床总有效率为83.33%(35/42),高于对照组患者的62.79%(27/43),差异有统计学意义(χ2=4.543,P=0.033)。(表1)
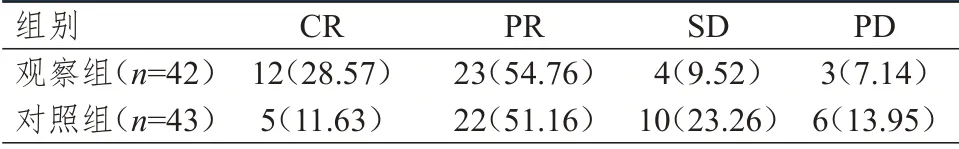
表1 两组患者的临床疗效[n(%)]*
2.2 血清TGF-b、GFAP 水平的比较
治疗前,两组患者清TGF-b、GFAP 水平比较,差异均无统计学意义(P﹥0.05);治疗后,两组患者血清TGF-b、GFAP 水平均低于本组治疗前,且观察组患者血清TGF-b、GFAP 水平均明显低于对照组患者,差异均有统计学意义(t=5.191、12.046,P﹤0.01)。(表2)
表2 两组患者治疗前后血清TGF-b、GFAP 水平的比较(ng/L,±s)
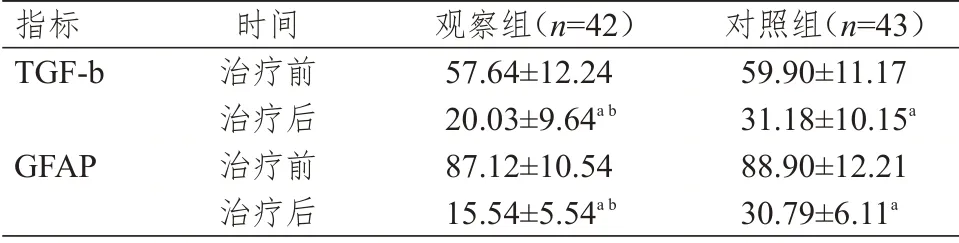
表2 两组患者治疗前后血清TGF-b、GFAP 水平的比较(ng/L,±s)
注:a与本组治疗前比较,P<0.01;b与对照组治疗后比较,P<0.01
指标TGF-b GFAP时间治疗前治疗后治疗前治疗后观察组(n=42)57.64±12.24 20.03±9.64a b 87.12±10.54 15.54±5.54a b对照组(n=43)59.90±11.17 31.18±10.15a 88.90±12.21 30.79±6.11a
2.3 免疫功能指标的比较
治疗前,两组患者CD3+、CD4+和CD8+水平比较,差异均无统计学意义(P﹥0.05)。治疗后,两组患者CD3+、CD4+水平均低于本组治疗前,CD8+水平高于本组治疗前,且观察组患者CD3+、CD4+水平均低于对照组患者,CD8+水平高于对照组患者,差异 均 有 统 计 学 意 义(t=2.201、2.703、2.684,P ﹤0.05)。(表3)
表3 两组患者治疗前后免疫功能指标的比较(%,±s)

表3 两组患者治疗前后免疫功能指标的比较(%,±s)
注:a与本组治疗前比较,P<0.01;b与对照组治疗后比较,P<0.01
指标CD3+CD4+CD8+时间治疗前治疗后治疗前治疗后治疗前治疗后观察组(n=42)66.10±11.40 60.20±9.99a b 34.40±8.29 27.39±7.14a b 23.12±7.20 26.33±6.20a b对照组(n=43)64.82±12.23 55.30±10.52a 33.72±9.40 23.30±6.81a 22.14±8.10 30.22±7.12a
2.4 不良反应比较
两组患者放射性脑水肿、胃肠道反应、骨髓抑制、肝肾功能受损和贫血发生率的比较,差异均无统计学意义(P﹥0.05)。(表4)
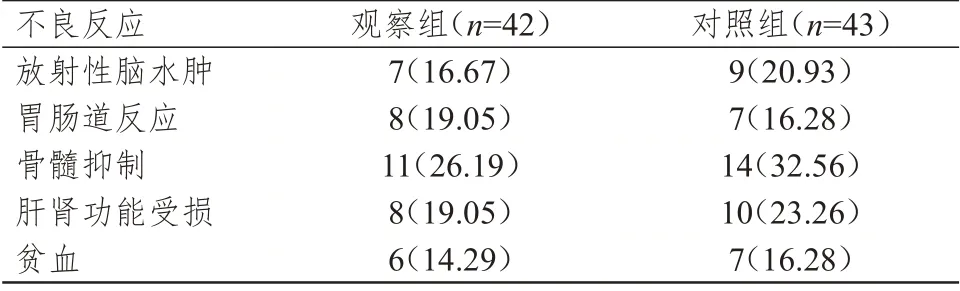
表4 两组患者不良反应发生情况[n(%)]
2.5 生存情况的比较
观察组患者中位总生存时间为14 个月(95%CI:13.16~14.84 个月),明显长于对照组患者的10个月(95%CI:8.97~11.03 个月),差异有统计学意义(χ2=10.169,P=0.001)。(图1)

图1 观察组(n=42)和对照组(n=43)脑胶质瘤患者的生存曲线
3 讨论
脑胶质瘤是颅脑常见的恶性肿瘤,占所有颅脑恶性肿瘤类型的40%,好发于28~41 岁成年人,男性发病率约为女性的1.2 倍,且以大脑半球白质内最为常见,随着病情进展,患者可出现神经功能障碍和颅内压力升高,肿瘤生长呈侵袭性和浸润性,可累及周边组织,严重影响患者的生活质量和生命安全[4]。目前认为,恶性肿瘤的发展是多种因素共同作用的结果,正常情况下,细胞的增殖和凋亡存在动态平衡,依赖多种因素调控,一旦原癌基因被激活,抑癌基因就会突变失活,导致肿瘤细胞增殖失去控制,从而发生恶性转化和远处转移[5-6]。目前,临床主要采取手术切除治疗脑胶质瘤,但由于脑胶质瘤呈现浸润性生长且多生长在脑部的重要结构,部分患者无法通过手术完全切除病灶,恶性脑胶质瘤手术患者术后5 年生存率仅为30%[7]。放射治疗一直是临床的重要治疗方法,可以通过放射线对人体细胞群与肿瘤细胞群修复能力的差别进行杀伤,但不同病理类型的恶性肿瘤对放射的敏感性不一,恶性程度越高的患者对放射治疗的相对敏感度越高,但放射治疗的不良反应也较明显,影响了患者治疗期间和后续的生活质量与生存时间[8-9]。因此,临床脑胶质瘤的治疗主要采取综合性治疗方案,通过各种途径为临床寻找更为有效且可以普及的方法,从而改善患者的预后。
本研究在放射治疗的基础上联合替莫唑胺开展综合治疗,替莫唑胺属于广谱二代烷化剂类抗肿瘤药物,口服可完全吸收并广泛分布于患者全身,穿透血脑屏障后在中枢神经系统达到有效的药物浓度,替莫唑胺作为前体药物本身不具有直接的抗肿瘤活性,可以在碱性条件下通过非酶催化迅速转化为活性化合物5-(3-甲基三氮烯-1-)咪唑-4-酰胺,导致肿瘤细胞DNA 发生甲基化,使鸟嘌呤06 点位甲基化并发挥细胞毒性作用,造成肿瘤细胞的DNA双链发生断裂,干扰肿瘤细胞的DNA 合成过程,诱导肿瘤细胞凋亡或自噬[10-11]。研究显示,肿瘤细胞中错配修复系统可以通过碱基配对原则识别错误配对,但鸟嘌呤第06 位上的氧原子甲基鸟嘌呤无法找到配对的碱基,在DNA 复制时子链DNA 中可形成一段缺失,随着细胞的不断分裂,缺失将不断变大,从而引起复制失败,使肿瘤细胞停留在G2/M 期,导致细胞凋亡[12]。有研究报道,替莫唑胺同步放疗一线治疗64例新诊断的Ⅳ级胶质瘤患者的1、2年生存率分别为58%和31%,中位生存期16 个月,均明显优于单纯放疗[13]。国内研究显示,放疗联合替莫唑胺治疗恶性胶质瘤的疗效优于单纯放疗,中位无复发生存期分别为8.8 个月和6.2 个月,1 年生存率分别为65.4%与30.8%,同样表明放疗联合替莫唑胺的临床疗效优于单纯放疗[14]。
本研究结果显示,观察组患者临床总有效率为83.33%,高于对照组患者的69.77%,表明替莫唑胺联合放疗治疗恶性脑胶质瘤的疗效优于单纯放射治疗。本研究还分析了胶质瘤患者体内细胞因子变化,TGF-b主要高表达于多种恶性肿瘤组织,且在肿瘤新生血管生成的过程中发挥关键作用,与肿瘤发生、发展密切相关。GFAP 则一般表达于神经系统组织,主要用于颅内肿瘤胶质起源的肿瘤,也是胶质细胞恶性程度的标志物,其表达水平与肿瘤恶性程度呈负相关,因此,一直作为胶质瘤恶性程度的良好标志物[15]。本研究结果显示,治疗后,两组患者血清TGF-b、GFAP 水平均低于本组治疗前,且观察组患者血清TGF-b、GFAP 水平均明显低于对照组患者,差异均有统计学意义(P﹤0.05)。表明替莫唑胺联合放疗治疗恶性脑胶质瘤可以抑制肿瘤新生血管生成,降低肿瘤恶性程度。此外,治疗后,两组患者CD3+、CD4+水平均低于本组治疗前,CD8+水平高于本组治疗前,且观察组患者CD3+、CD4+水平均低于对照组患者,CD8+水平高于对照组患者,差异均有统计学意义(P﹤0.05)。表明替莫唑胺联合放疗可提高恶性脑胶质瘤患者的免疫机能。两组患者放射性脑水肿、胃肠道反应、骨髓抑制、肝肾功能受损和贫血发生率的比较,差异均无统计学意义(P﹥0.05)。表明替莫唑胺联合放疗治疗恶性脑胶质瘤中不会增加不良反应,应用相对安全。观察组患者中位总生存时间为14 个月(95%CI:13.16~14.84 个月),明显长于对照组患者的10 个月(95%CI:8.97~11.03 个月),表明替莫唑胺联合放疗有助于延长恶性脑胶质瘤患者的生存时间。本研究观察了替莫唑胺在恶性胶质瘤中的辅助作用,证实了替莫唑胺联合放疗的优势,为临床合理选择综合治疗方案提供了依据,但由于本研究纳入的患者例数有限,而且随访时间相对较短,还需在今后工作扩大样本量、开展前瞻性、随机性试验深入分析。
综上所述,替莫唑胺治疗恶性脑胶质瘤疗效较好,可改善患者的预后,降低血清TGF-b、GFAP 水平,对免疫功能的影响较小。
