茶黄素激活Nrf2/HO-1通路保护血管内皮细胞氧化应激损伤
2020-10-16曾洁邓志慧付红娟刘畅古仪邹奕昕常徽
曾洁,邓志慧,付红娟,刘畅,古仪,邹奕昕,常徽
茶黄素激活Nrf2/HO-1通路保护血管内皮细胞氧化应激损伤
曾洁,邓志慧,付红娟,刘畅,古仪,邹奕昕,常徽*
西南大学食品科学学院,重庆 400715
为探讨茶黄素(Theaflavin,TF)对过氧化氢(H2O2)诱导的血管内皮细胞氧化应激损伤的保护效应及作用机制,将人脐静脉血管内皮细胞HUVEC分为对照组、损伤组(0.2 mmol·L-1H2O2处理)和TF预处理组(2.0、5.0、10.0 μmol·L-1TF和0.2 mmol·L-1H2O2处理)。损伤组和TF组均以H2O2处理24 h,其中TF组先以不同浓度TF预处理2 h,对照组均以定量溶剂处理。以MTT法测定细胞活力,DCFH-DA探针测定活性氧(ROS)水平,流式细胞术检测细胞凋亡,Western blot测定蛋白表达水平,相应试剂盒测定乳酸脱氢酶(LDH)、一氧化氮(NO)、丙二醛(MDA)含量及超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化氢酶(GSH-Px)活性。结果显示,与对照组相比,损伤组细胞活力显著降低,LDH释放量增加,NO水平降低,胞内ROS水平升高,MDA增加,抗氧化酶活力降低,细胞凋亡升高;TF预处理能够显著提高细胞活力,降低LDH水平,维持NO水平,降低胞内ROS水平及MDA的产生,提高抗氧化酶活力,并抑制细胞凋亡;进一步研究显示,TF能够激活Nrf2/HO-1通路,且Nrf2抑制剂会显著降低TF的内皮细胞保护效应。可见,TF能够有效抑制H2O2诱导的血管内皮细胞氧化应激损伤,其机制至少部分是通过激活Nrf2/HO-1通路实现的。
茶黄素;血管内皮细胞;氧化应激损伤;保护机制;动脉粥样硬化
随着我国社会经济的快速发展、人们生活方式的改变,以及人口老龄化和城镇化进程的加快,心血管病相关危险因素的流行趋势明显,心血管病发病人数和死亡人数均持续增高,且在未来10年还会继续升高。目前,我国心血管病患病人数约为2.9亿,其中脑卒中1 300多万,冠心病1 100多万,心血管病死亡率居我国居民疾病总死亡原因的首位,占疾病死亡构成的40%以上[1-3]。同时,心血管病住院总费用也在快速增加,增长速度远高于我国国民生产总值增速。心血管病的负担日渐加重,已经成为我国重大的公共卫生问题,有效防治心血管病刻不容缓。
饮食、营养与心血管病的发生发展密切相关,探讨通过膳食途径预防血管病变、脑卒中、心脏病等,具有十分重要的理论和现实意义。研究发现,长期饮用红茶能够显著降低血浆低密度脂蛋白(LDL)和总胆固醇水平,同时降低收缩压,还可抑制体重增加,降低腰围和腰臀比[4-5]。这表明,红茶对于心血管病可能具有良好的预防作用。茶黄素(Theaflavin,TF)是红茶中存在的一类重要的生物活性物质,对红茶的汤色、滋味和品质起着决定性的作用,是红茶具备生物学效应的物质基础[6-7]。目前,已从红茶中分离鉴定出20多种TF类化合物(TFs),这些TF衍生物与TF具有相似的结构和生物学活性,其中最主要的TFs有4种:TF、茶黄素-3-没食子酸酯(TF-3-G)、茶黄素-3'-没食子酸酯(TF-3'-G)和茶黄素-3,3'-双没食子酸酯(TFDG)[8-9]。研究显示,TFs具有抗氧化、抑菌、抗肿瘤、降脂等作用[10-14],但其对血管内皮细胞损伤的保护效应研究尚少,且机制不清。本研究以H2O2诱导内皮细胞氧化应激损伤为试验模型,观察TF对内皮细胞损伤的保护效应,并探讨相关作用机制。
1 材料与方法
1.1 试验材料
人脐静脉血管内皮细胞(HUVEC),购于上海盖宁生物科技有限公司。TF(纯度98%)购于南京草本源生物科技有限公司,用二甲基亚砜(DMSO)溶解–20℃避光分装保存备用。DMEM培养基、胎牛血清(FBS)、0.25%胰蛋白酶购于美国Gibco公司。DMSO、噻唑蓝(MTT)、乳酸脱氢酶(LDH)、一氧化氮(NO)、丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒均购于南京建成生物工程研究所。Annexin V-FITC/PI细胞凋亡检测试剂盒均购于北京众康志恒生物科技有限公司。RIPA细胞裂解液、BCA 蛋白含量测定试剂盒、一抗Nrf2、HO-1、-actin、二抗和DAB显色试剂盒均购于上海碧云天生物技术研究所。EpiQuik核蛋白提取试剂盒购于艾美捷科技有限公司。Nrf2抑制剂ML385购于Selleck Chemicals公司。
1.2 材料与方法
1.2.1 细胞培养与分组
采用10% FBS的高糖DMEM培养基,37℃、5% CO2条件下培养,常规换液和传代。将细胞分为3组:对照组(NC)、损伤组(MC)和TF预处理组(P-TF)(2.0、5.0、10.0 μmol·L-1处理组)。P-TF先以2.0、5.0、10.0 μmol·L-1的TF处理细胞2 h,然后以PBS清洗2次,加入新鲜培养基,再以0.2 mmol·L-1的H2O2处理细胞24 h;MC以等量溶剂处理2 h,PBS清洗2次,再以H2O2处理细胞24 h;NC均以等量溶剂做相应处理。
1.2.2 MTT法检测细胞活力水平
取对数生长期的第2~4代细胞,调整细胞浓度,以1×104个·mL-1接种于96孔板,每组6个复孔,每孔100 μL。细胞按前述分组处理,处理完成前4 h,每孔加20 μL 5 mg·mL-1MTT,弃上清液,以PBS洗2次,每孔加入150 μL DMSO溶解结晶颗粒,摇床低速振荡10 min(或37℃孵育15 min溶解结晶),在酶标仪490 nm处测定吸光度,设空白调零。

1.2.3 细胞上清液LDH和NO水平测定
将处于对数生长期的细胞接种于24孔板,按上述分组处理,然后分离细胞培养上清液,严格依照试剂盒说明书测定上清液中LDH活性水平和NO含量。
1.2.4 细胞内ROS测定
将细胞接种于6孔板,分组处理后弃上清液,用PBS洗涤细胞3次,然后加入10 μmol·L-1DCFH-DA,培养箱内孵育15 min;荧光显微镜下取相,使用多功能酶标仪在488 nm激发波长、525 nm发射波长下测定荧光强度。
1.2.5 细胞MDA水平及SOD、CAT和GSH-Px活性水平的测定
将细胞接种于6孔板,分组处理后消化、离心、弃上清液,加入500 μL PBS制成细胞悬浮液,超声裂解,严格依照相应检测试剂盒说明书测定。
1.2.6 细胞凋亡的测定
将细胞接种于6孔板,分组干预处理后,消化、离心、弃上清液,收集各组细胞,用500 μL结合缓冲液重悬细胞,而后分别加入10 μL Annexin V-FITC和10 μL PI染料,混匀后于室温避光条件下反应15 min,流式细胞仪检测细胞凋亡。
总凋亡细胞率=早期凋亡细胞率+晚期凋亡细胞率。
1.2.7 Western blot检测蛋白表达水平
收集细胞,利用RIPA裂解液裂解细胞提取总蛋白,同时按照核蛋白提取试剂盒操作说明提取核蛋白,采用BCA法进行蛋白浓度测定;根据蛋白浓度,以12%分离胶、5%浓缩胶SDS-PAGE电泳,上样量为20 μL(含40 μg蛋白)。用半干性转膜法将蛋白转移至PVDF膜上。5%的脱脂奶粉(TBST配制)封闭2 h。一抗Nrf2、HO-1(1︰1 000),4℃孵育过夜,TBST振摇洗膜3次后,各10 min,加入辣根过氧化酶标记的二抗(1︰5 000),室温振荡孵育1 h,再以TBST振摇洗膜3次后,加入ECL化学发光液,采用VILBER FUSION FX7成像系统自动曝光。利用Quantity One软件进行条带分析。
1.2.8 统计分析
2 结果与分析
2.1 TF对HUVEC细胞的细胞毒作用
以不同浓度的茶黄素(TF)处理HUVEC细胞24 h,观察茶黄素对细胞活力的影响。如图1所示,茶黄素在0~120 μmol·L-1浓度剂量内,与NC比较,对HUVEC细胞增殖活力无显著影响,未见明显细胞毒作用。
2.2 TF预处理对H2O2作用下HUVEC细胞活力及凋亡的影响
分别以2.0、5.0 μmol·L-1和10.0 μmol·L-1的TF预处理HUVEC细胞2 h,观察其对H2O2(0.2 mmol·L-1)作用下HUVEC细胞活力及凋亡的影响。结果如图2所示,H2O2处理细胞24 h,与空白对照组比较,细胞活力显著降低,细胞凋亡率明显升高;TF预处理能够显著抑制H2O2诱导的细胞毒性,提高细胞活力,并抑制细胞凋亡,其保护作用呈剂量依赖性效应关系。
2.3 TF预处理对氧化应激条件下内皮细胞LDH和NO释放水平的影响
分离细胞培养基上清液,检测各组细胞LDH和NO释放水平,结果如图3所示,H2O2作用下细胞LDH的释放水平显著升高,而NO释放水平明显降低,表明内皮细胞结构受到损害,导致胞内LDH外泄量增加,同时内皮细胞功能受损,分泌NO的能力降低;TF预处理能够有效抑制LDH水平的升高和NO水平的降低,表明TF可有效保护内皮细胞,减轻细胞损伤,维护内皮细胞结构和功能正常。
2.4 TF预处理对H2O2作用下内皮细胞ROS水平和MDA生成的影响
由图4中ROS水平的检测结果显示,H2O2作用下内皮细胞ROS水平显著升高,表明胞内氧化应激压力增大;与此一致,细胞氧化应激产物脂质过氧化物MDA水平显著升高;TF预处理能够有效降低胞内ROS水平,且显著抑制MDA的生成,这表明TF预处理可以有效减轻H2O2造成的内皮细胞氧化应激损伤。

图1 不同浓度TF处理HUVEC细胞24 h对细胞活力的影响
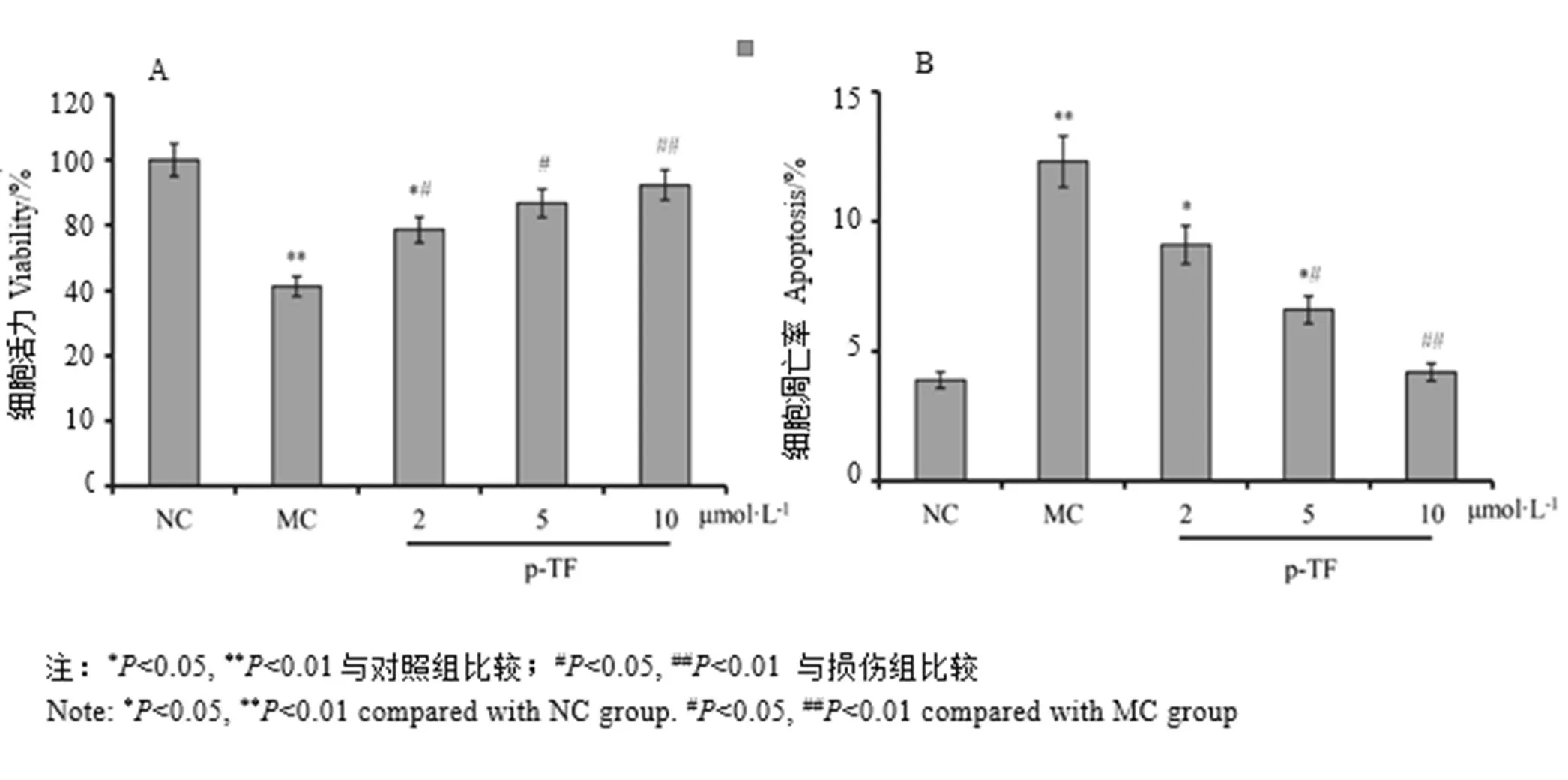
图2 TF预处理对H2O2作用下HUVEC细胞活力及凋亡的影响
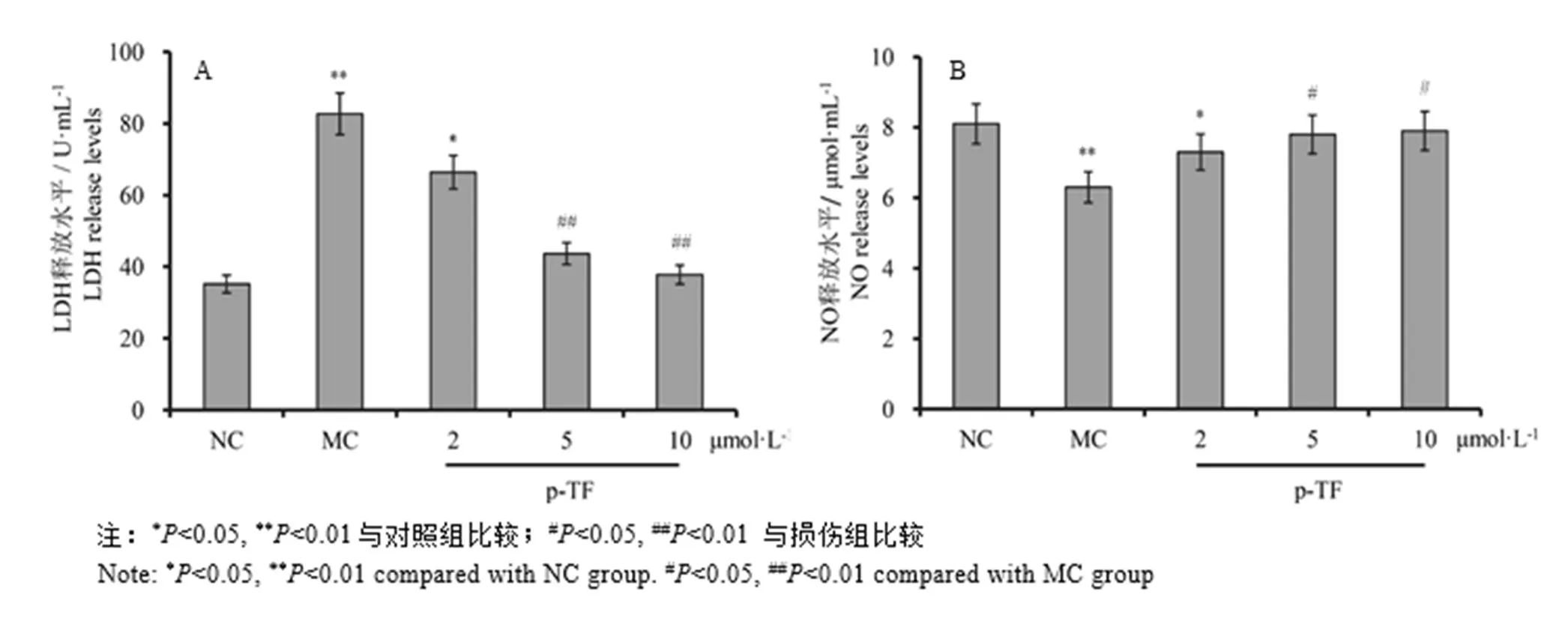
图3 TF预处理对H2O2作用下内皮细胞LDH和NO释放水平的影响
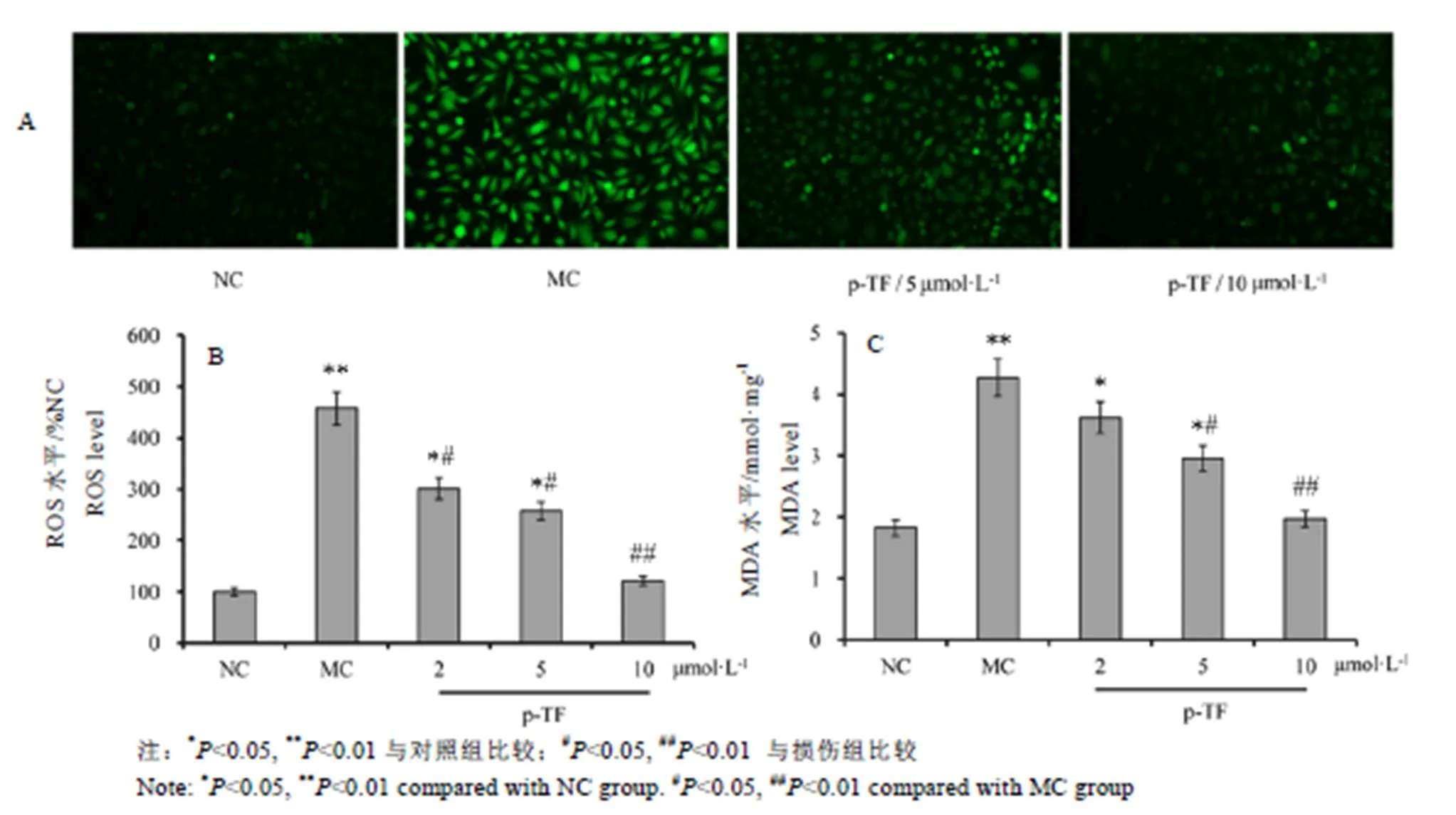
图4 TF预处理对H2O2作用下内皮细胞ROS水平和MDA生成的影响
2.5 TF预处理对氧化应激条件下内皮细胞抗氧化酶活性的影响
由图5可见,对内皮细胞抗氧化酶SOD、CAT和GSH-Px活性水平的检测结果显示,H2O2作用下细胞内SOD、CAT和GSH-Px活性水平均出现不同程度下降,表明细胞氧化-还原调节系统明显受损;TF预处理能够有效增强SOD、CAT和GSH-Px活性水平,维持细胞氧化-还原调节平衡,提高内皮细胞应对氧化应激的能力。
2.6 Nrf2/HO-1信号通路在TF抑制内皮细胞氧化应激损伤中的作用
Nrf2信号通路在氧化应激反应中发挥重要作用,本研究采用Western blot方法检测了Nrf2和HO-1的蛋白表达水平(图6)。由图6可见,H2O2作用后受损细胞Nrf2和HO-1的蛋白表达水平均显著降低,TF能够上调Nrf2的表达及核移位,激活Nrf2/HO-1信号通路。为了进一步验证Nrf2信号通路在TF抑制内皮细胞氧化应激损伤中的作用,以Nrf2的抑制剂ML385干预试验,观察其对TF保护效应的影响。可见,ML385会显著降低核内Nrf2的水平和HO-1表达水平,并减弱TF对氧化应激诱导细胞毒性和凋亡的抑制作用,说明TF至少部分是通过激活Nrf2信号通路发挥内皮细胞保护作用的。

图5 TF预处理对H2O2作用下内皮细胞抗氧化酶活性的影响

图6 Nrf2信号通路在TF抑制内皮细胞氧化应激损伤中的作用
3 讨论
TFs占红茶固形物的0.3%~1.5%,是红茶中一类重要的活性成分[15]。TFs是儿茶素类化合物(包括儿茶素、没食子儿茶素、表没食子儿茶素没食子酸酯等)在多酚氧化酶的催化下,通过与空气中氧气进行氧化缩合而形成,是一类苯骈䓬酚酮类衍生物,通过C2-C4、C2-C6键与2个苯骈二氢吡喃环相连接,形成特定的分子结构和空间构象[6-9]。研究表明,TFs无论在体外还是在体内,均具有优良的抗氧化、抑菌、抑癌等[10-14]生物学特性,作为一种天然的膳食活性成分,TFs在食品、医药保健等领域有着广阔的应用前景。
动脉粥样硬化是动脉内膜产生脂质等血液成分的沉积,同时血管平滑肌细胞增生和胶原纤维增多,形成血管壁硬化和粥糜样含脂坏死病灶,这样一系列血管病理变化的过程。血管内皮细胞是介于血流和血管壁组织之间的一层单核细胞,在动脉粥样硬化的发生环节中,血管内皮细胞损伤以及由此产生的炎症反应,扮演着关键角色,抑制内皮细胞损伤,维护内皮正常的结构和功能,对于抑制动脉粥样硬化的发生至关重要[16-19]。氧化应激损伤是血管内皮细胞常见的病理损伤,活性氧自由基、氧化型低密度脂蛋白(ox-LDL)、脂多糖、同型半胱氨酸、高血糖和高血脂等,均可诱导血管内皮细胞产生氧化应激,造成结构和功能损伤。氧化损伤会引起内皮细胞脂质过氧化物增多,细胞活力降低,细胞坏死和凋亡增加,引发血管内皮结构改变和功能障碍[20-21]。在本研究中,H2O2处理血管内皮细胞,会导致内皮细胞结构损伤,致使细胞外漏LDH水平显著升高,同时细胞NO分泌水平下降,表明细胞的内皮功能显著受损,而血管内皮损伤和功能障碍,是导致心血管发生的始动因素[22-23]。我们的研究显示,TF能够有效抑制H2O2对内皮细胞造成的氧化应激损伤,降低细胞ROS水平,减轻脂质过氧化物的产生,提高细胞活力,抑制细胞凋亡,增强细胞抗氧化酶系的活力,维护细胞内皮功能。这表明TF对于血管内皮细胞氧化应激损伤具有良好的保护效应,长期饮用红茶摄入TFs,可能对于预防动脉粥样硬化以及心血管病具有一定的积极作用。
值得注意的是,有研究发现茶黄素和茶多酚同样可以发挥促氧化作用。研究显示,高浓度条件下(>50 µmol·L-1)茶黄素能够显著诱导牙龈成纤维细胞和舌癌细胞发生氧化应激,导致细胞内GSH耗尽,进而诱导细胞凋亡,茶黄素的促氧化作用在肿瘤细胞中更加明显,因此对肿瘤细胞具有特异性杀伤作用[24]。另外,研究显示高浓度EGCG可对体外红细胞发挥促氧化作用,降低膜蛋白巯基含量水平,并诱导膜蛋白聚集[25]。可见,茶黄素发挥抗氧化或促氧化作用与其浓度、细胞类型、环境条件等密切相关。在本研究中TF浓度较低,对血管内皮细胞可发挥抗氧化保护作用,高浓度下或者对其他细胞会发挥何种作用尚需要进一步研究。
另外,绿茶和儿茶素生物学效应的研究广受关注,红茶和TFs由于成分复杂、含量较低等原因研究较少,近些年来随着食品分析技术的发展,人们对TFs的研究逐渐增多。研究显示,茶多酚能够通过抗炎、调节血脂水平、抑制LDL氧化修饰、改善内皮功能等不同途径抑制AS的发生发展[26-27];Huang等[28]研究显示,绿茶多酚EGCG能够激活Akt/eNOS信号途径,抑制高糖引起的内皮组织损伤,增强内皮细胞的NO分泌功能;另一项研究表明,绿茶多酚能够调节血管内皮细胞生长因子的表达,从而对血管内皮细胞的增殖和存活产生显著影响[29];不仅如此,绿茶多酚能够通过增强内皮细胞功能以降低血压,从而对心血管病起到良好的预防作用[30]。红茶和TFs对心血管病是否具有同样的保护效应,它们与绿茶多酚存在怎样的异同,这值得深入研究和对比。
本研究发现,TF能够通过激活Nrf2/HO-1信号通路进而增强抗氧化酶SOD、CAT和GSH-Px发挥保护作用,Nrf2/HO-1信号通路在细胞应对氧化应激过程中至关重要,TF是如何激活此信号通路增强细胞抗氧化反应能力的,其作用机制值得探究。研究显示,Nrf2受DNA甲基化调控,其基因启动子区的甲基化水平直接影响其表达水平[31];TF是否通过影响DNA甲基化调节Nrf2的表达,尚需要进一步的研究证实。
[1] 胡盛寿, 高润霖, 刘力生, 等. 《中国心血管病报告2018》概要[J]. 中国循环杂志, 2019, 34(3): 209-220. Hu S S, Gao R L, Liu L S, et al. Summary of the 2018 Report on Cardiovascular Diseases in China [J]. Chinese Circulation Journal, 2019, 34(3): 209-220.
[2] Du X, Patel A, Anderson C S, et al. Epidemiology of cardiovascular disease in China and opportunities for improvement: JACC international [J]. Journal of the American College of Cardiology, 2019, 73(24): 3135-3147.
[3] Whelton P K, Colantonio L D. Cardiovascular disease risk estimation in China [J]. Annals of Internal Medicine, 2019, 170(5): 340-341.
[4] Hartley L, Flowers N, Holmes J, et al. Green and black tea for the primary prevention of cardiovascular disease [J]. Cochrane Database of Systematic Reviews, 2013, 18(6): CD009934. doi: 10.1002/14651858.CD009934.pub2.
[5] Bøhn S K, Croft K D, Burrows S , et al. Effects of black tea on body composition and metabolic outcomes related to cardiovascular disease risk: a randomized controlled trial [J]. Food & Function, 2014, 5(7): 1613-1620.
[6] 祖勉, 刘艾林, 杜冠华. 茶黄素及其衍生物药理作用研究进展[J]. 中国药学杂志, 2011(20): 7-11. Zu M, Liu A L, Du. G H. Research progress in pharmacological effects of theaflavin and its derivatives [J]. Chinese Pharmaceutical Journal, 2011(20): 7-11.
[7] He H F. Research progress on theaflavins: efficacy, formation, and preparation [J]. Food & Nutrition Research, 2017, 61(1): 1344521. doi: 10.1080/16546628.2017.1344521.
[8] Takemoto M, Takemoto H. Synthesis of theaflavins and their functions [J]. Molecules, 2018, 23(4): 918.doi: 10.3390/molecules23040918.
[9] Pereira-Caro G, Moreno-Rojas J M, Brindani N, et al. Bioavailability of black tea theaflavins: absorption, metabolism and colonic catabolism [J]. Journal of Agricultural and Food Chemistry, 2017, 65(26): 5365-5374.
[10] Peluso I, Serafini M. Antioxidants from black and green tea: from dietary modulation of oxidative stress to pharmacological mechanisms [J]. British Journal of Pharmacology, 2017, 174(11): 1195-1208.
[11] Tan Q Y, Peng L J, Huang Y Y, et al. Structure-activity relationship analysis on antioxidant and anticancer actions of theaflavins on human colon cancer cells [J]. Journal of Agricultural and Food Chemistry, 2019, 67(1): 159-170.
[12] Imran A, Butt M S, Xiao H, et al. Inhibitory effect of black tea () theaflavins and thearubigins against HCT 116 colon cancer cells and HT 460 lung cancer cells [J]. Journal of Food Biochemistry, 2019, 43(5): e12822. doi: 10.1111/jfbc.12822.
[13] Khanum H, Faiza S, Sulochanamma G, et al. Quality, antioxidant activity and composition of Indian black teas [J]. Journal of Food Science and Technology, 2017, 54(5): 1266-1272.
[14] Lagha A B, Grenier D. Black tea theaflavins attenuate Porphyromonas gingivalis virulence properties, modulate gingival keratinocyte tight junction integrity and exert anti-inflammatory activity [J]. Journal of Periodontal Research, 2016, 52(3): 458-470.
[15] 王洪新, 孙军涛, 吕文平, 等. 茶黄素的制备、分析、分离及功能活性研究进展[J]. 食品与生物技术学报, 2011, 30(1): 12-19. Wang H X, Sun J T, LV W P, et al. Research progress on preparation, analysis, separation and function of theaflavins [J]. Journal of Food Science and Biotechnology, 2011, 30(1): 12-19.
[16] Huynh D T N, Kyung-Sun H. Therapeutic targets for endothelial dysfunction in vascular diseases [J]. Archives of Pharmacal Research, 2019, 42(10): 848-861.
[17] Zha S Y, Wang F, Li Z, et al. PJ34, a PARP1 inhibitor, promotes endothelial repair in a rabbit model of high fat diet-induced atherosclerosis [J]. Cell Cycle, 2019, 18(17): 2099-2109.
[18] Song C, Wang Y, Cui L, et al. Triptolide attenuates lipopolysaccharide-induced inflammatory responses in human endothelial cells: involvement of NF-κB pathway [J]. BMC Complementary and Alternative Medicine, 2019, 19(1): 198. doi: 10.1186/s12906-019-2616-3.
[19] Yamagata K. Soy isoflavones inhibit endothelial cell dysfunction and prevent cardiovascular disease [J]. Journal of Cardiovascular Pharmacology, 2019, 74(3): 201-209.
[20] Yan R, Yan J, Chen X, et al. Xanthoangelol prevents Ox-LDL-induced endothelial cell injury by activating Nrf2/ARE signaling [J]. Journal of Cardiovascular Pharmacology, 2019, 74(2): 162-171.
[21] Marchio P, Guerra-Ojeda S, Vila J M, et al. Targeting early atherosclerosis: a focus on oxidative stress and inflammation [J]. Oxidative Medicine and Cellular Longevity, 2019: 8563845. doi: 10.1155/2019/8563845.
[22] Tabaei S, Tabaee S S. DNA methylation abnormalities in atherosclerosis [J]. Artificial Cells, Nanomedicine, and Biotechnology, 2019, 47(1): 2031-2041.
[23] Uddin M S, Kabir M T, Jakaria M, et al. Endothelial PPARγ is crucial for averting age-related vascular dysfunction by stalling oxidative stress and ROCK [J]. Neurotoxicity Research, 2019, 36(3): 1-19.
[24] Babich H, Gottesman R T, Liebling E J, et al. Theaflavin-3-gallate and theaflavin-3'-gallate, polyphenols in black tea with prooxidant properties [J]. Basic Clin Pharmacol Toxicol, 2008, 103(1): 66-74.
[25] 任婧, 张献清, 邢艳菲, 等. 茶多酚表没食子儿茶素-3-没食子酸酯对红细胞膜的促氧化作用[J]. 第四军医大学学报, 2009, 30(19): 1947-1949. Ren J, Zhang X Q, Xing Y F, et al. Pro-oxidative effect of epigallocatechin 3-gallate on human erythrocyte membranes [J]. Journal of the Fourth Military Medical University, 2009, 30(19): 1947-1949.
[26] 张姝萍, 王岳飞, 徐平. 茶多酚对动脉粥样硬化的预防作用与机理研究进展[J]. 茶叶科学, 2019, 39(3): 231-246. Zhang S P, Wang Y F, Xu P. Prevention of tea polyphenols on atherosclerosis and relative mechanisms [J]. Journal of Tea Science, 2019, 39(3): 231-246.
[27] Chen X Q, Hu T, Han Y, et al. Preventive effects of catechins on cardiovascular disease [J]. Molecules, 2016, 21(12): e1759. doi: 10.3390/molecules21121759.
[28] Huang H, Jin C Y, Bi X K, et al. Green tea polyphenol epigallocatechin-3-gallate promotes reendothelialization in carotid artery of diabetic rabbits by reactivating Akt/eNOS pathway [J]. Frontiers in Pharmacology, 2018, 9: 1305.doi: 10.3389/fphar.2018.01305.
[29] Chu K O, Chan K P, Chan S O, et al. Metabolomics of green-tea catechins on vascular endothelial growth factor stimulated human endothelial cell survival [J]. Journal of Agricultural and Food Chemistry, 2018, 66(48): 12866-12875.
[30] Li D, Wang R, Huang J, et al. Effects and mechanisms of tea regulating blood pressure: evidences and promises [J]. Nutrients, 2019, 11(5): e1115.doi: 10.3390/nu11051115.
[31] Guo Y, Yu S, Zhang C, Kong A N. Epigenetic regulation of Keap1-Nrf2 signaling [J]. Free Radical Biology & Medicine, 2015, 88 (Part B): 337-349.
Theaflavin Activates Nrf2/HO-1 Pathway to Alleviate Oxidative Stress Injury in Vascular Endothelial Cells
ZENG Jie, DENG Zhihui, FU Hongjuan, LIU Chang, GU Yi, ZOU Yixin1, CHANG Hui*
College of Food Science, Southwest University, Chongqing, 400715, China
To investigate the protective effect of theaflavin (TF) on injury of human umbilical vein endothelial cells (HUVEC) induced by hydrogen peroxide (H2O2), HUVECs were divided into control group, injury group (0.2 mmol·L-1H2O2treatment) and TF pretreatment groups (2.0, 5.0, 10.0 μmol·L-1+0.2 mmol·L-1H2O2treatment). The TF pretreatment groups were pretreated with TF for 2 h. Then, both the injury group and the TF groups were treated with H2O2for 24 h, while the control group was treated with solvent. Cells activity was detected by the MTT method. The levels of lactic dehydrogenase (LDH), nitric oxide (NO), malondialdehyde (MDA) and the activities of superoxide dismutase (SOD), catalase (CAT), glutathione peroxidase (GSH-Px) were measured by corresponding detection kits. Reactive oxygen species (ROS), cells apoptosis and protein expression levels were detected using DCFH-DA dying, flow cytometer and Western blot. The results show that cells activity was dramatically decreased in the injury group, and the levels of LDH, cellular ROS, MDA and cells apoptosis increased, while the level of NO and the activities of antioxidant enzymes were declined. TF pretreatment could increase cells’ viability, decrease the level of LDH, maintain the level of NO, and inhibit the increments of ROS and MDA, as well as cells apoptosis. Further study indicated that TF treatment could activate Nrf2/HO-1 signaling pathway, and the inhibitor of Nrf2 could reduce the protective effects of TF on HUVEC cells. In conclusion, TF could alleviate oxidative stress injury in vascular endothelial cells induced by H2O2. The mechanism is at least partly associated with the activation of Nrf2/HO-1 pathway.
theaflavin, vascular endothelial cell, oxidative stress injury, protection mechanism, atherosclerosis
TS272.2;Q52
A
1000-369X(2020)05-632-09
2019-12-24
2020-06-08
中央高校基本科研业务费专项(XDJK2020D030)
曾洁,女,硕士研究生,主要从事植物化学物及其生物学活性的研究。*通信作者:changhui2017@swu.edu.cn
