长链非编码RNA PANDAR对骨肉瘤细胞阿霉素耐药的机制研究*
2020-10-15殷生良孙雅静侯婷婷
殷生良,孙雅静,侯婷婷
辽宁省沈阳市骨科医院小儿骨科,辽宁沈阳 110000
骨肉瘤是一种起源于间质细胞的肌肉-骨骼恶性肿瘤,骨肉瘤的发生率约为百万分之三,男性骨肉瘤的发生率高于女性[1]。骨肉瘤的易发部位为长骨的髓端,尤其是在膝关节周围的股骨远端和肱骨近端。骨肉瘤病程进展迅速,发病率和病死率高[2]。目前,骨肉瘤的治疗主要有手术、化疗、免疫治疗等。骨肉瘤细胞的强大增殖能力和耐药性是影响预后的重要因素[3]。尽管阿霉素是晚期骨肉瘤化疗的主要药物之一,但有40%~45%的骨肉瘤患者对阿霉素无反应,或仅部分反应,阿霉素耐药的发生是骨肉瘤化疗失败的主要原因。因此,为了开发更有效的治疗方法,探索骨肉瘤耐药的分子机制十分重要。
在过去的几十年里,研究者从表观遗传学、细胞周期和凋亡、自噬等方面进行了研究。诸如ABC转运蛋白家族基因及凋亡相关的重要通路[4],被证实在肿瘤细胞耐药中发挥重要作用。但是,骨肉瘤耐药的分子机制尚不完全清楚,相关靶向药物仍缺乏临床疗效。近年来,随着人类基因组计划的完成和高通量测序技术的进步,研究人员已逐渐将研究中心放在非编码RNA(ncRNA)的生物学功能上。ncRNA在调控基因表达中起着至关重要的作用[5]。其中,有一类长度超过200个核苷酸的长链非编码RNA(lncRNA),广泛参与生物体的生命过程,并发现多种lncRNA可参与肿瘤耐药的发生过程。因此,进一步明确lncRNA参与骨肉瘤阿霉素耐药的分子机制十分必要。
在本研究中,笔者发现lncRNA PANDAR在骨肉瘤细胞中过表达,抑制lncRNA PANDAR后可抑制骨肉瘤细胞增殖,促进凋亡,并可抑制骨肉瘤细胞对阿霉素的耐药性,现报道如下。
1 材料与方法
1.1材料 骨肉瘤细胞Saos-2、U2OS、MG-63,人正常成骨细胞NHOst,阿霉素耐药(DOX)骨肉瘤细胞MG-63/DOX购自美国菌种保藏中心;胎牛血清、DMEM培养基购自美国Gibico公司;无菌培养箱购自美国Thermo公司;PANDAR si-RNA、B淋巴细胞瘤-2基因(Bcl-2)过表达质粒及定量引物购自中国吉凯基因化学技术有限公司;PCR引物购自中国生工生物工程有限公司;Bcl-2抗体、SYRB Green染料及反转录试剂盒购自日本Takara公司;转染试剂Lipofectamine 2000购自美国Invitrogen公司;实时荧光定量PCR(qPCR)仪购自瑞士Roche公司。
1.2方法
1.2.1细胞培养 配制含10%胎牛血清的DMEM培养基,同时加入1%青、链霉素用于细胞培养;培养箱条件:37 ℃,5%CO2,细胞克隆至80%~90%更换培养基。
1.2.2qPCR 检测人正常成骨细胞NHOst和骨肉瘤细胞株中PANDAR的表达。TRIzol法提取总RNA,并检测纯度及浓度。依据Takara公司说明书进行反转录和qPCR反应。lncRNA PANDAR的上游引物序列为5′-TAA GGT GGT GGC ATT GAG-3′,下游引物序列为5′-CAG GTC TTG GAT TGA GGA A-3′;Bcl-2的上游引物序列为5′-TGT GGA TGA CTG AGT ACC T-3′,下游引物序列为5′-CAG AGA CAG CCA GGA GAA-3′;U6作为内参进行相对定量,U6的上游引物序列为5′-TTA TGG GTC CTA GCC TGA C-3′,下游引物序列为5′-CAC TAT TGC GGG CTG C-3′。2-ΔΔCt法计算两者的相对表达水平,重复3次。
1.2.3细胞转染 依据基因转染操作手册,Lipofectamine 2000将过表达和沉默载体转染至细胞。细胞转染48 h后,观察细胞生长情况,收集细胞用于进一步研究。
1.2.4蛋白质印迹法 提取细胞总蛋白,制备8%聚丙烯酰胺凝胶,每孔20 μg上样;80 V浓缩胶,120 V分离胶进行电泳,100 V转膜90 min,5%牛血清清蛋白封闭聚偏二氟乙烯膜1 h,加一抗,4 ℃振荡过夜。TBST洗涤后滴加二抗,37 ℃孵育1 h,显影成像。特异性条带灰度值由ImageJ 软件获取。
1.2.5CCK-8试验评估细胞增殖能力 遵照CCK-8试剂盒说明书进行。细胞接种于96孔培养板,于转染后24、48、72 h加入CCK-8试剂,37 ℃,5% CO2条件下培养2 h,多功能酶标仪测定吸光度值(A450),评估细胞增殖情况。每组设2个复孔,实验重复3次。
1.2.6Annexin V-FITC PI双染色流式细胞仪检测细胞凋亡 细胞处理后,用4 ℃磷酸盐缓冲液对细胞进行胰蛋白酶化和洗涤。根据操作手册,使用Annexin V-FITC PI检测试剂盒在黑暗中孵育细胞悬液15 min。流式细胞术检测细胞凋亡,实验重复3次。
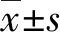
2 结 果
2.1lncRNA PANDAR在人正常成骨细胞、骨肉瘤细胞、MG-63/DOX中表达情况 qPCR检测lncRNA PANDAR在细胞株中的表达,骨肉瘤细胞Saos-2、U2OS、MG-63中lncRNA PANDAR的相对表达水平分别为(3.21±0.50)、(3.33±0.45)、(4.21±0.61),较人正常成骨细胞NHOst中的lncRNA PANDAR的相对表达水平(1.00±0.21)明显升高,差异有统计学意义(P<0.05)。同时与MG-63中相对表达水平(1.00±0.20)比较,lncRNA PANDAR在MG-63/DOX相对表达水平(2.03±0.33)明显升高,差异有统计学意义(P<0.05)。见图1。
2.2下调lncRNA PANDAR抑制Bcl-2的表达 将PANDAR的两条siRNA干扰序列分别转染进入MG-63细胞,qPCR结果显示,lncRNA PANDAR相对表达水平均明显降低,差异有统计学意义(P<0.05)。同时,在MG-63细胞中沉默lncRNA PANDAR后,Bcl-2的相对表达水平也随之下降(P<0.05)。其中第2条序列(si-lncRNA PANDAR2)具有更好的沉默效能,用于后续实验。经过转染si-lncRNA PANDAR2后,MG-63细胞中Bcl-2蛋白的相对表达水平也明显减低(P<0.05)。见图2。

注:图A表示lncRNA PANDAR在Saos-2、U2OS、MG-63和NHOst细胞中相对表达水平;图B表示lncRNA PANDAR在MG-63和MG-63/DOX细胞中相对表达水平。

注:图A表示转染si-lncRNA PANDAR前后MG-63细胞中lncRNA PANDAR相对表达水平;图B表示转染si-lncRNA PANDAR后MG-63细胞中Bcl-2的mRNA相对表达水平;图C表示转染si-lncRNA PANDAR后MG-63细胞中Bcl-2的蛋白表达情况。
2.3lncRNA PANDAR和Bcl-2对骨肉瘤细胞增殖、凋亡能力的影响 CCK-8和Annexin V-FITC PI检测PANDAR和Bcl-2对MG-63细胞增殖和凋亡的影响。将si-lncRNA PANDAR2转染MG-63细胞,细胞的增殖能力减弱,证明随着lncRNA PANDAR表达的减少,细胞的增殖能力随之下降。在此基础上过表达Bcl-2,被抑制的细胞增殖能力部分恢复(P<0.05)。将si-lncRNA PANDAR2转染MG-63细胞,细胞凋亡明显增加,从2.20%增加至18.89%,而过表达Bcl-2后,凋亡细胞降至2.03%(P<0.05),表明lncRNA PANDAR对MG-63细胞凋亡的影响依赖Bcl-2。见图3、4。
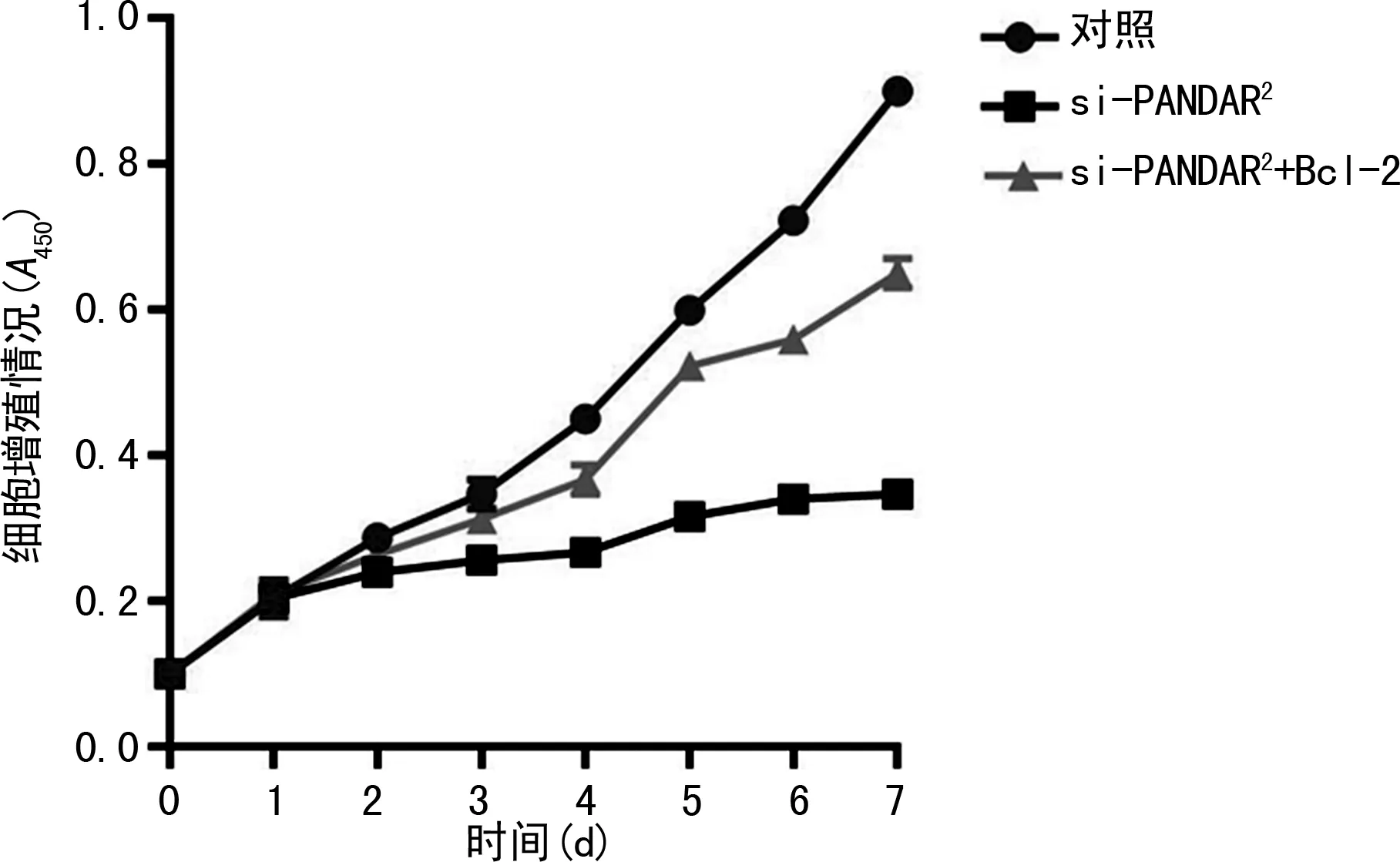
图3 lncRNA PANDAR和Bcl-2对MG-63细胞增殖能力的影响

注:图A表示转染前,MG-63细胞凋亡情况;图B表示转染后,MG-63细胞凋亡情况;图C表示过表达Bcl-2后,MG-63细胞凋亡情况;图D表示MG-63细胞凋亡率统计值。
2.4阿霉素共培养对不同转染组骨肉瘤细胞的影响 各组于培养基中加入0.1 μmol阿霉素联合培养,记录24 h后生存细胞百分比。抑制lncRNA PANDAR 表达后可抑制骨肉瘤细胞耐药(P<0.05),而过表达Bcl-2可拮抗si-lncRNA PANDAR 的作用(P<0.05);同样的现象在MG-63/DOX细胞中也得到了验证,但是在MG-63/DOX细胞中对细胞耐药的影响不如MG-63细胞明显(P<0.05)。见图5。
注:图A表示阿霉素共培养对不同转染组MG-63细胞的影响;图B表示阿霉素共培养对不同转染组MG-63/DOX细胞的影响。
3 讨 论
化疗耐药是骨肉瘤治疗的主要难点之一。阿霉素是标准的一线骨肉瘤化疗药物,一旦发生耐药,无有效的二线化疗药物可供选择。耐药性的发展是与一个或多个基因的异常表达和相关信号通路的激活密切相关。近年来,许多研究证实lncRNA可通过影响细胞周期、凋亡,调控耐药基因或信号转导途径来调节各种肿瘤的化疗耐药[6-8]。例如,SI等[6]报道H19可通过抑制激活BIK启动子,调控ERα阳性乳腺癌的化疗耐药;CHEN等[7]发现lncRNA CCAT1作为致癌基因,通过竞争性内源性RNA机制上调Bcl-xl表达,促进肺腺癌的阿霉素化疗耐药;LI等[8]报道lncRNA HOTTIP通过促进HOXA13表达介导胰腺癌吉西他滨耐药。因此,研究耐药细胞与敏感细胞之间lncRNA表达的变化,以及在诱导耐药过程中lncRNA参与表观遗传修饰和转录调控的机制,可能为克服肿瘤化疗耐药提供新的视角和可能的治疗方案。
lncRNA PANDAR的功能于2011年由HUNG等[9]首次报道,作为p53依赖的lncRNA,同转录因子NF-YA相互作用,参与细胞凋亡表型。并且lncRNA PANDAR也在多种恶性肿瘤中过表达。lncRNA PANDAR可通过调节p53的磷酸化,参与卵巢癌的铂类耐药[10];lncRNA PANDAR也可通过阻止CDKN1A的转录,参与胃癌的发生、发展[11],同时血清中过表达的lncRNA PANDAR也可能是胃癌的分子诊断标志物;lncRNA PANDAR的过表达可能同结肠癌和口腔鳞状细胞癌的不良预后密切相关[12];但目前,lncRNA PANDAR在骨肉瘤化疗耐药中的作用相关报道较少。
化疗药物是诱导肿瘤细胞凋亡,抑制肿瘤发生、发展的核心事件之一。内源性凋亡主要受Bcl-2家族蛋白调控。Bcl-2在人滤泡性淋巴瘤中通过染色体易位激活[13-14],过表达的Bcl-2使抗凋亡蛋白和促凋亡蛋白表达失衡,抵消了促凋亡蛋白的功能。本研究发现,lncRNA PANDAR在骨肉瘤细胞中过表达,抑制lncRNA PANDAR表达后,Bcl-2的表达也随之下降。同时,在抑制lncRNA PANDAR的表达后,细胞的增殖能力减弱,凋亡增加,在与阿霉素共培养的条件下,细胞活力明显减弱。而在抑制lncRNA PANDAR表达,同时过表达Bcl-2,骨肉瘤细胞的上述恶性表型部分恢复。笔者推测,lncRNA PANDAR参与骨肉瘤的耐药机制可能是通过Bcl-2实现的。
综上所述,lncRNA PANDAR在骨肉瘤细胞中过表达,通过调控Bcl-2的表达影响骨肉瘤阿霉素化疗耐药。但其具体分子结合位点及转录调控机制,仍需在后续研究中进一步探讨。
