肝硬化食管静脉曲张破裂出血的影响因素分析
2020-10-15李晶江泳张旭
李晶,江泳,张旭
每年3%~12%的肝硬化患者出现食管静脉曲张,8%~12%的患者由小静脉曲张发展为大静脉曲张[1]。食管静脉曲张一旦形成后,出血的风险为10%~30%[2]。由于食管静脉曲张破裂出血仍然是肝硬化患者最常见的致死并发症[3],因此须对患者出血风险进行评估,以期对其进行早期干预。肝静脉压力梯度(hepatic venous pressure gradient,HVPG)是判断门静脉高压及其并发症的金标准[4]。HVPG通常在1~5 mmHg范围内,当它达到10 mmHg及以上时具有临床意义[5];超过10 mmHg可观察到腹水、食管静脉曲张、肝肾综合征的发生[6];HVPG大于12 mmHg时,患者有食管静脉曲张破裂出血和难治性腹水的风险[7]。但HVPG测定是有创性检查,价格昂贵、耗时较长,同时需要医生具有较强的专业知识,因此目前没有广泛的应用。故采用无创或微创的指标来评估出血风险非常重要。内镜检查是评价食管静脉曲张存在与否的金标准[8],它可以了解患者静脉曲张大小以及部位,有无红色征。因此我们通过分析患者的内镜特征、实验室及影像学检查来探讨食管静脉曲张破裂出血的相关危险因素,以便采取适当的预防性治疗来减少食管静脉曲张破裂出血的发生,提高患者的生存率。
1 资料与方法
1.1 一般资料 选择2018年1月—2019年10月在蚌埠市第三人民医院消化内科诊断为肝硬化食管静脉曲张患者108例。根据患者是否发生食管静脉曲张破裂出血,分为未出血组50例和出血组58例。纳入标准:(1)经临床表现、实验室检查、影像检查或肝穿刺诊断为肝硬化患者;(2)内镜证实为食管静脉曲张患者。排除标准:(1)合并肝癌或其他恶性肿瘤的患者;(2)本研究之前已行脾切除术、经颈静脉肝内门体分流术(TIPS)、内镜下套扎或硬化治疗的患者;(3)合并肝肾综合征、肝衰竭等严重并发症的患者;(4)呼吸循环衰竭、肾功能衰竭或多器官衰竭的患者;(5)有服用阿司匹林、氯吡格雷的患者;(6)严重的凝血功能障碍的患者。食管静脉曲张破裂出血的评价标准:(1)患者既往有呕血、黑便史,且经内镜诊断为食管静脉曲张;(2)内镜下观察食管静脉曲张活动性出血。2组患者一般资料比较差异无统计学意义(P>0.05)。见表1。

表1 2组患者一般资料比较
1.2 方法 采用回顾性调查分析方法,记录2组患者一般资料(年龄、性别、肝硬化病因),实验室检查结果(血常规、肝肾功能、凝血功能等),内镜特征(静脉曲张大小、有无红色征、有无门脉高压性胃病)及影像学检查结果。
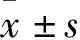
2 结果
2.1 肝硬化食管静脉曲张破裂出血单因素分析 2组患者WBC、PLT、ALT、AST、ALP、ALB、BUN、血糖比较差异均无统计学意义(P>0.05);2组患者HB、TBIL、Cr、PT、Child分级、食管静脉曲张程度、门脉高压性胃病、红色征、腹水、门静脉血栓情况比较差异有统计学意义(P<0.05)。说明HB、TBIL、Cr、PT、Child分级、食管静脉曲张程度、门脉高压性胃病、红色征、腹水、门静脉血栓均与肝硬化食管静脉曲张破裂出血有一定的相关性。见表2。

表2 肝硬化食管静脉曲张破裂出血危险因素单因素分析
2.2 肝硬化食管静脉曲张破裂出血多因素Logistic回归分析 对有统计学意义的单因素进行非条件Logistic回归分析,结果显示:总胆红素、食管静脉曲张大小、红色征、Child分级是肝硬化食管静脉曲张破裂出血的独立影响因素(P<0.05)。见表3。

表3 肝硬化食管静脉曲张破裂出血多因素非条件Logistic回归分析
2.3 肝硬化食管静脉曲张破裂出血独立影响因素的ROC曲线预测价值 绘制总胆红素、食管静脉曲张大小、红色征、Child分级对肝硬化食管静脉曲张破裂出血预测的ROC曲线,ROC曲线下面积分别为0.655、0.640、0.753、0.632。曲线下面积比较差异有统计学意义(P<0.05)。见表4。
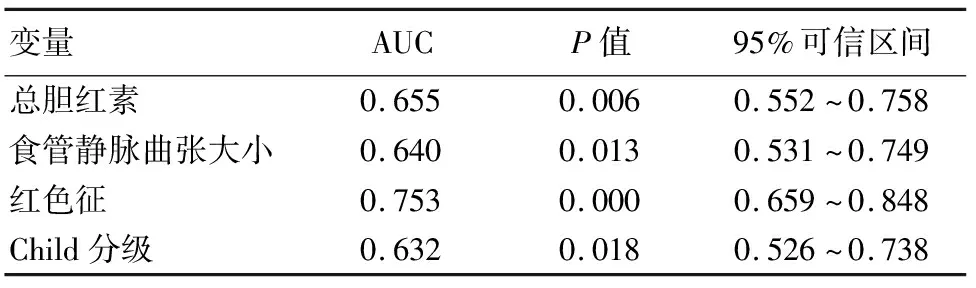
表4 肝硬化食管静脉曲张破裂出血独立危险因素的ROC曲线
3 讨论
食管静脉曲张破裂出血是肝硬化门脉高压最常见、最严重的并发症之一,同时有着较高的死亡率[9]。大约35%~80%的肝硬化患者出现食管静脉曲张,其中20%~40%的患者在2年内会发生食管静脉曲张破裂出血,且30%~40%的患者在出血后的两到三天内发生再出血,而高达60%的患者会在一周内发生再出血[10]。因此,预防食管静脉曲张破裂出血仍然是肝硬化患者长期治疗的重点。血流动力学研究表明,HVPG与食管静脉曲张出血风险密切相关[11]。当HVPG超过12 mmHg时,食管静脉曲张破裂出血的风险将增加[7,12],但HVPG检测是侵入性的,临床上未广泛使用。本研究旨在应用临床上常用指标来评估食管静脉曲张破裂出血的风险。
本研究进行单因素、多因素Logistic回归分析,结果显示肝硬化食管静脉曲张破裂出血的独立预测指标按OR值大小依次为:Child分级、红色征、食管静脉曲张大小、总胆红素。绘制其对肝硬化食管静脉曲张破裂出血预测的ROC曲线,红色征的ROC曲线下面积最大,表明其预测食管静脉曲张出血具有显著的价值。
食管静脉曲张是门静脉与食管静脉之间通过胃左静脉或胃短静脉自发形成的侧支血管[13],因此食管静脉曲张的存在反映了门脉高压的严重程度[14]。研究表明食管静脉曲张破裂出血与它的大小有关[15],较大的食管静脉曲张出血得风险更大,这可能是由于食管静脉曲张壁内压力不断增加,当达到临界水平时静脉曲张发生破裂出血并危及生命[16]。本研究也证实了食管静脉曲张大小是出血的影响因素。
随着门静脉压力的增高,侧支循环的建立,食管静脉曲张不断形成,然而在静脉曲张破裂出血之前,静脉曲张壁内压力的升高,会使食管上皮的正常结构和血管壁先遭到破坏,局部静脉壁变得薄弱,从而形成内镜下可见的红色征[17]。因此,食管静脉曲张壁内压力越高,静脉壁越薄弱,红色征的程度越明显,更易发生破裂出血。本研究表明红色征阳性患者的出血风险较阴性患者升高9.897倍,而静脉曲张大小的OR值为6.425,因此红色征比静脉曲张大小能更早期、更准确的预测出血。
Grothaus等[18]研究显示,Child分级为出血的独立危险因素,与当前研究结果一致。Child分级是反映肝脏功能的综合性指标,能全面反映肝功能损害的程度。研究表明随着肝功能受损程度不断增加,肝细胞及肝脏正常结构被破坏,从而引起门静脉血液回流障碍,引起门静脉压力的增高,最终发生食管静脉曲张破裂出血[19]。一项研究显示肝病的严重程度与食管静脉曲张的分级相关,大约85%的Child-Pugh C级肝硬化患者有静脉曲张,而只有45%的Child-Pugh A级肝硬化患者有静脉曲张[20],即晚期肝病患者更容易发生食管静脉曲张[21],因此食管静脉曲张出血的风险将增大。
总之,在首次出血前探索食管静脉曲张破裂出血的危险因素是至关重要的。研究表明对于出血风险较大的患者,给予非β受体阻滞剂进行初级预防,可使出血风险从50%降到15%[22]。综上所述,本研究证实总胆红素、食管静脉曲张大小、红色征、Child分级是食管静脉曲张破裂出血可靠的预测指标,临床工作中应对其进行早期干预,预防及减少食管静脉曲张出血的发生,改善患者的预后。
