细胞色素P450基因AsCYP6Z2在中华按蚊溴氰菊酯抗性维持中的作用
2020-10-15韩宝珠车林茸陈晓洁闫振天
韩宝珠, 车林茸, 陈晓洁, 闫振天, 乔 梁, 陈 斌
(重庆师范大学昆虫与分子生物学研究所, 媒介昆虫重庆市重点实验室, 重庆 401331)
细胞色素P450是一类含有血红素结构的超基因家族的末端氧化酶,主要分布在内质网和线粒体内膜上,还原态的该蛋白酶与CO结合,利用紫外分光光谱检测,其在450 nm处具有最大吸收峰值。昆虫细胞色素P450通常包含5个保守基序:螺旋C(WxxxR)、螺旋I(GxE/DTT/S)、螺旋K(ExLR)、PERF区(PxxFxPE/DRE)和血红素结合区(PFxxGxRxCxG/A)(Crooksetal., 2004)。细胞色素P450广泛存在于生物体中,能够催化至少60多种化学反应,参与多种内源性化合物(类固醇激素、血脂等)的合成代谢和外源性化合物(药物、农药、天然产物等)的代谢解毒(Fuchsetal., 1994; Harrisonetal., 2001; Feyereisen, 2012)。其中,CYP6家族被认为能够代谢外源化合物和植物毒素(Feyereisen, 1999)。已有研究表明CYP6家族与杀虫剂的抗性有关,研究发现赤拟谷盗TriboliumcastaneumQTC279品系脑中特异高表达的TcCYP6BQ9基因是其对溴氰菊酯高度抗性的分子基础(Zhuetal., 2010);AmCYP6AA2在耐溴氰菊酯的矮小疟蚊Anophelesminimus中的表达与对溴氰菊酯的抗性的发展密切相关(Rongnoparutetal., 2003);AgCYP6P3和AgCYP6M2被证实与冈比亚按蚊Anophelesgambiae耐拟除虫菊酯类杀虫剂的抗药性紧密关联(Matowoetal., 2014)。
中华按蚊Anophelessinensis是我国及东南亚地区重要的传疟媒介(Changetal., 2014)。在本实验室的前期研究中,通过基因组鉴定和比较转录组差异分析,筛选出16个可能与溴氰菊酯抗性相关的P450基因,其中9个基因属于CYP6亚家族(Yanetal., 2016)。在本研究之前,还没有关于中华按蚊P450基因参与拟除虫菊酯抗性的直接功能例证的报道。
本研究以中华按蚊为研究对象,结合前期的研究基础,从溴氰菊酯抗性品系(YN-LR)的表达谱中筛选出细胞色素P450基因AsCYP6Z2,通过对该基因进行生物信息学分析、分子克隆、时空表达模式分析、诱导表达检测、RNAi干扰及分子对接等研究手段,初步证实了AsCYP6Z2基因与中华按蚊对拟除虫菊酯类杀虫剂的耐受性相关,这对于进一步探讨其表达调控和在溴氰菊酯代谢机制方面的研究奠定了前期基础。
1 材料与方法
1.1 供试蚊虫
实验室敏感品系(WX-LS)为多世代自交系。抗性品系(YN-LR)是以采集自云南元阳的抗性个体作为供体亲本,并与实验室敏感品系进行多世代(不少于10代)回交而构建的近等位基因系。抗性品系的筛选检测方法是将羽化3 d的雌蚊移入WHO接触桶(含0.05%溴氰菊酯)中,60 min后将接触桶蚊虫移到恢复筒中,统计死亡率(World Health Organization, 2016)。抗感品系均于室内同样条件(27℃、相对湿度75%、光周期12L∶12D)下饲养,每天给幼虫和蛹换两次清水和鱼苗食物,用10%葡萄糖溶液饲养成虫。
1.2 主要试剂与耗材
DNA片段扩增所使用的TransStart® FastPfu Fly DNA Polymerase购自北京全式金公司;DNA片段纯化使用的E.Z.N.A.® Gel Extraction Kit购自Omega公司;大肠杆菌EscherichiacoliDH5α感受态细胞购自TaKaRa公司;RNA提取使用的高纯度总RNA快速提取试剂盒(离心柱型)购自北京百泰克生物技术有限公司;反转录试剂PrimeScriptTMRT Reagent Kit with gDNA Eraser(Perfect Real Time)购自TaKaRa公司;荧光定量PCR所使用的试剂iTaqTMUniversal SYBR® Green Supermix及相关耗材购自BIO-RAD公司。
1.3 中华按蚊AsCYP6Z2基因克隆及生物信息学分析
AsCYP6Z2基因的预测序列来源于本实验室闫正文等的前期分析(Yanetal., 2016)。将该基因的预测序列作为问询序列,比对中华按蚊转录组数据库,获得其转录组序列,以此作为模板序列,利用Primer Premier 5.0软件设计1对引物(表1),以溴氰菊酯抗性品系羽化0 h的成蚊和敏感品系雌蛹的腹部分别作为cDNA的模板,克隆其开放阅读框序列。基因克隆实验中的PCR反应体系(25 μL): 5×Buffer 5 μL, dNTPs(2.5 mmol/L)2 μL, 上下游引物(10 μmol/L)各0.5 μL, Fastpfu酶(2.5 U/μL)0.5 μL, ddH2O 15.5 μL。PCR反应条件: 95℃预变性2 min; 95℃ 20 s, 58℃ 20 s, 72℃ 35 s, 共35个循环; 最后72℃延伸5 min。引物合成及基因测序由北京擎科新业生物技术有限公司完成。

表1 本研究所用引物
利用在线软件ExPASy中ProtParam(http:∥web.expasy.org/protparam/)对AsCYP6Z2蛋白进行分子量、吸光值、等电点等理化性质的预测;AsCYP6Z2蛋白的信号肽预测使用在线软件(http:∥www.cbs.dtu.dk/services/SignalP);AsCYP6Z2蛋白的跨膜区域预测使用TMHMM在线软件(http:∥www.cbs.dtu.dk/services/TMHMM);使用NCBI和Vectorbase提供的BLASTP在蛋白序列数据库中搜索同源序列,物种和基因登录号如下:赤拟谷盗T.castaneum(XP_015834511.1),家蚕Bombyxmori(NP_001073135.1),黑腹果蝇Drosophilamelanogaster(NP_651082.1),埃及伊蚊Aedesaegypti(AAEL009123),致倦库蚊Culexquinquefasciatus(CPIJ019587),冈比亚按蚊An.gambiae(AGAP008218),小菜蛾Plutellaxylostella(XP_011569123.1)。MEGA-X构建进化树(Tamuraetal., 2013),ClustalW比对序列,预测氨基酸序列的最佳进化模型为LG+G,基于最大似然法(maximum likelihood, ML)计算AsCYP6Z2基因的系统发育关系,重复计算1 000次。同时,采用在线比对工具CLUSTALW(https:∥www.genome.jp/tools-bin/clustalw)及GENEDOC软件完成多序列比对分析。
1.4 AsCYP6Z2基因的时空表达谱分析
从溴氰菊酯敏感品系(WX-LS)和抗性品系(YN-LR)中华按蚊雌性个体的蛹期和成蚊期的不同发育阶段进行取样,共计12个时间点(蛹期0, 10, 20和30 h,蛹末期,成蚊期0, 3, 6, 9, 24,48和72 h),每组3个生物学重复。同样地,对溴氰菊酯敏感品系雌蛹的各区段进行取样,包括头部、胸部、腹部前3节(腹部前端)和腹部剩余部分(腹部后端)。取样使用TRizol试剂(Invitrogen, 美国)400~500 μL置于1.5 mL离心管中,保存于-80℃。液氮研磨,Trizol法提取总RNA,利用TaKaRa RR047A反转录试剂盒制备cDNA,以此cDNA为模板用于qPCR检测。使用Primer Premier 5.0设计AsCYP6Z2的定量引物,以核糖体蛋白基因L49(RPL49)用作内参基因(Yanetal., 2016)。qPCR反应体系及操作参考本实验室乔梁等先前建立的方法(Qiaoetal., 2016)。引物序列如表1所示。
由表2可以看出,复合混沌序列有均衡的0-1比,并且满足E<0.02的要求,满足Golomb伪随机假设的第一条件。
1.5 溴氰菊酯对AsCYP6Z2基因的诱导表达分析
选取化蛹3 h,健康活泼的溴氰菊酯敏感品系(WX-LS)雌蛹个体,将蛹置于装有灭菌超纯水(含5 μg/mL氨苄青霉素)的培养皿里清洗3次。清洗后用蘸有70%酒精的脱脂棉轻轻擦拭蛹体表,再将蛹放置于1×PBS的培养皿清洗。于灭菌载玻片上对蛹进行迅速解剖,将蛹腹部后端置于1×PBS中洗涤5次,之后用无菌滤纸吸走液体。将3~6个腹部后端材料放入1.5 mL离心管中,离心管中加入Grace培养基(GIBCO BRL)且加入6 μg/mL苯硫脲以防止酚氧化酶活性;同时加入青霉素-链霉素;青霉素的工作浓度为100 U/mL,链霉素为0.1 mg/mL)。处理组材料样本中加入25 mg/mL过滤灭菌的溴氰菊酯溶液(25 mg/mL溴氰菊酯溶液的配制:1 mL纯丙酮溶液加入中1 μL的溴氰菊酯原药),对照组中加入等量过滤灭菌的纯丙酮溶液(World Health Organization, 1981)。用锡箔纸包裹离心管后放置在水平摇床上,以25 r/min的速率和倾斜30°的角度进行孵育,并设置4个生物学重复。孵育温度为24℃,在孵育时间分别为12 h和24 h时,通过qPCR检测处理组和对照组中AsCYP6Z2基因的表达情况,检测和分析方法同1.4节。引物序列如表1所示。
1.6 AsCYP6Z2基因的RNAi实验
使用P1700 T7 RiboMAXTMExpress RNAi试剂盒(美国Promega)合成dsAsCYP6Z2和对照dsEGFP双链RNA。合成的双链RNA溶解于无RNase的水,测定纯度和浓度,并电泳检测。合成dsRNA所需引物如表1所示。
在进行击倒率和死亡率表型量化前,提前选取先批次化蛹的雌蛹,注射dsAsCYP6Z2(RNAi组)和dsEGFP(对照组),每组不少于20头,注射剂量为800 ng,RNAi组和对照组各进行两次平行实验,如表2所示。选取RNAi组和对照组蛹羽化1 h大小齐一、健康活泼且飞行良好的个体,按照每个生物学重复混合5头雌蚊的标准进行取样,并设置3个生物学重复。利用Trizol法提取样本的总RNA,并使用TaKaRa RR047反转录试剂盒合成cDNA样本。通过qPCR检测RNAi组和对照组中AsCYP6Z2基因的表达量,以评估RNAi对靶基因表达的抑制效果。qPCR分析中,以中华按蚊核糖体蛋白L49基因(AsRPL49)为内参。qPCR反应体系及操作参考本实验室乔梁等先前建立的方法(Qiaoetal., 2016)。所需引物见表1。
在量化击倒率和死亡率时,依据AsCYP6Z2基因时期和部位的表达模式,我们在化蛹10 h期间向蛹的腹部后端注入dsRNA(RNAi组注射dsAsCYP6Z2,对照组注射dsEGFP)。RNAi组两组共计注射81头雌蚊,对照组两组共计注射73头雌蚊。将注射后的RNAi组和对照组的蛹吸入含5 μg/mL氨苄青霉素的超纯水中,于实验室常规饲养条件下饲养,并统计羽化率。待RNAi组和对照组中成蚊羽化至1 h,选取大小齐一、活泼健康且具有良好飞行能力的个体,按照WHO接触桶法进行溴氰菊酯生测实验。详细操作为:将RNAi组和对照组的雌蚊以25头/筒轻轻吹入放置有0.05%溴氰菊酯药膜的接触桶中,吹入后立即计时,并记录蚊虫在接触溴氰菊酯药膜10, 20, 30, 40, 50和60 min时的击倒情况,利用SPSS 25.0对RNAi组和对照组个体的进行半数击倒时间(KT50)分析。在60 min后将接触桶中的雌蚊转移至恢复桶内,待其恢复24 h 后统计死亡率。生测实验均进行2次生物学重复。
1.7 同源建模与分子对接
使用在线同源建模服务器Swiss-Model(http:∥swissmodel.expasy.org/)对AsCYP6Z2进行同源建模。验证所建模型立体化学性质的合理性用Proheck程序(Laskowskietal., 1993);对所建蛋白模型中的氨基酸残基的相容性评估使用Verify-3D程序;三维构象的显示与分析用PDBview。
利用ChemBioDraw Ultra 12.0绘制化合物溴氰菊酯的结构,然后用ChemBio3D Ultra 12.0转化为3D结构并使用程序内置的MMFF94立场对化合物的构象进行优化。对接所需的蛋白以及化合物溴氰菊酯使用AutoDockTools 1.5.6转化为PDBQT格式后,使用AutoDock 4.2.6进行对子对接研究(Morrisetal., 2009)。AsCYP6Z2蛋白的对接活性位点的坐标设置为: center_x=55.847, center_y=77.138, center_z=12.205; size_x=8, size_y=8, size_z=8; 参数exhaustiveness设置为20,其余参数均使用默认值,对接后选取得分最高的构象,使用PyMol 2.3.4(http:∥www.pymol.org/)进行作图与结果分析。
2 结果
2.1 AsCYP6Z2基因的克隆和序列特征
AsCPY6Z2(GenBank登录号: MT840336)基因的开放阅读框(ORF)长1 251 bp,编码416个氨基酸(图1)。该基因氨基酸编码序列在抗感品系间没有差异。其氨基酸组成中,亮氨酸(Leu)所占比例最高,为10.6%。运用SingalP5.0对AsCYP6Z2的氨基酸序列进行信号肽分析,结果表明AsCYP6Z2无信号肽。同时对AsCYP6Z2的氨基酸序列运用TMHMM 2.0软件进行跨膜结构域分析,结果表明该蛋白无跨膜结构域。

图1 中华按蚊AsCYP6Z2基因的cDNA序列及推导的氨基酸序列
系统发生结果显示(图3):AsCYP6Z2基因与冈比亚按蚊AgCYP6Z2基因的亲缘关系最近。氨基酸联配分析结果表明(图2),AsCYP6Z2蛋白含有5个保守基序,分别为:螺旋C(WxxxR),螺旋I(GxE/DTT/S),螺旋K(ExLR),PERF区(PxxFxPE/DRE)和血红素结合区(PFxxGxRxCxG/A)。
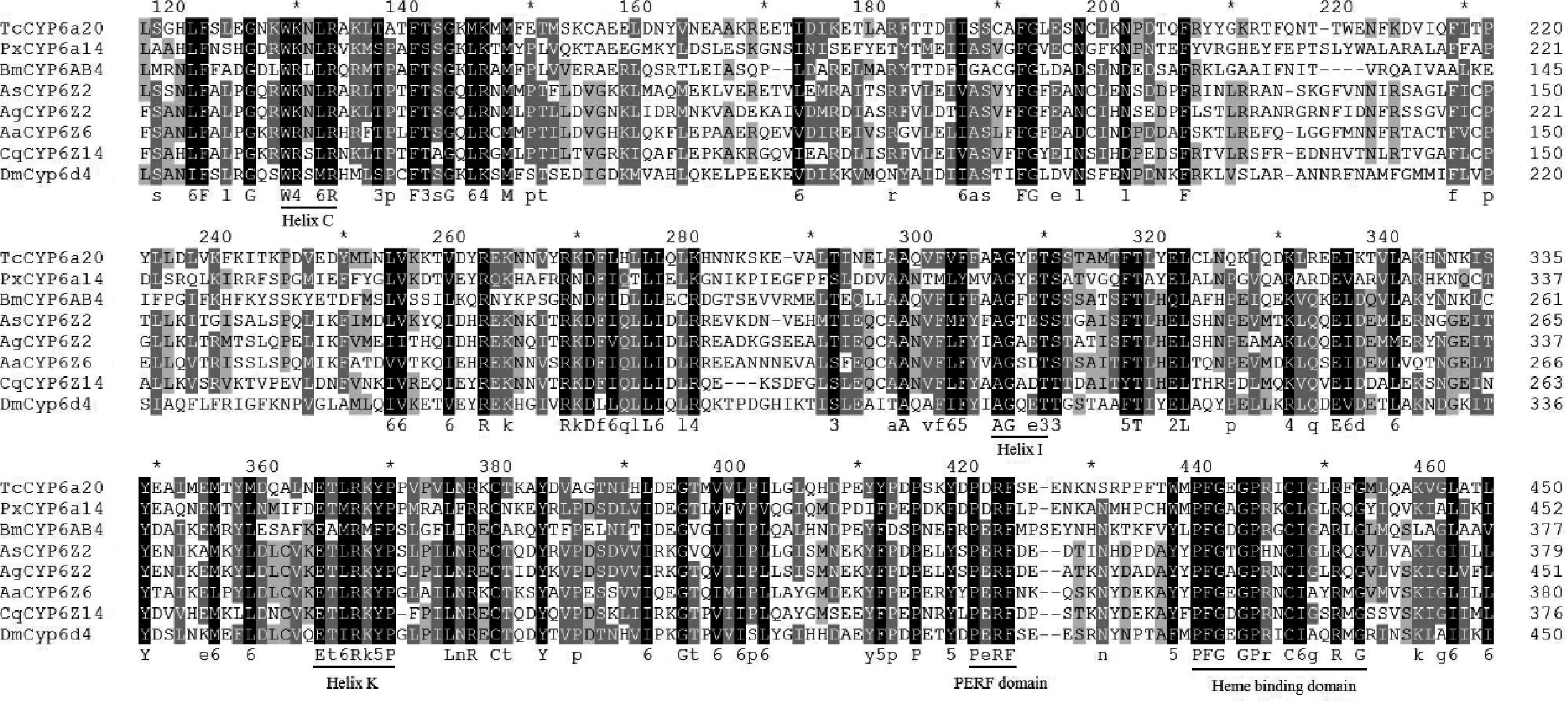
图2 中华按蚊AsCYP6Z2与其他昆虫同源蛋白的序列比对

图3 中华按蚊AsCYP6Z2与其他昆虫CYP6基因的系统发育进化关系
2.2 AsCYP6Z2基因的时空表达模式
不同发育阶段的表达分析结果显示:在化蛹0 h,AsCYP6Z2基因的表达量非常低,且在抗感品系(YN-LR和WX-LS)间没有明显的表达差异。在敏感品系中,尽管AsCYP6Z2基因的表达量随着发育变化上调,但上调变化并不剧烈。而在抗性品系中,该基因在化蛹末期至成蚊羽化3 h间的表达量明显上调,其程度以蛹末期和刚羽化时最为显著。此外,在蛹末期、羽化0, 3和72 h,抗性品系中该基因的表达量显著高于敏感品系(P<0.05)。雌蛹不同部位的表达分析结果显示:AsCYP6Z2基因在蛹腹部后端的表达量最高,其次是腹部前端和胸部,而头部中的表达量最低。依据发育阶段和组织表达模式结果,将化蛹10 h作为RNAi注射的时间点,注射部位为雌蛹腹部后端。

图4 AsCYP6Z2基因在中华按蚊溴氰菊酯抗感品系不同发育阶段(A)和溴氰菊酯敏感品系雌蛹不同组织(B)中的表达模式
2.3 溴氰菊酯对AsCYP6Z2基因的诱导表达
中华按蚊雌蛹腹部后端在25 mg/mL溴氰菊酯溶液中培养后的结果显示:12 h后,处理组中AsCYP6Z2的表达量较对照组(纯丙酮溶液培养)上调了4倍(P<0.01);而在24 h后,处理组中AsCYP6Z2的表达量较对照组则上调了13倍(P<0.001)。这些结果表明溴氰菊酯能够诱导AsCYP6Z2基因的显著上调表达。

图5 中华按蚊雌蛹腹部后端经溴氰菊酯处理12 h(A)和24 h(B)后AsCYP6Z2基因的表达量变化
2.4 RNAi干扰AsCYP6Z2后中华按蚊对溴氰菊酯敏感性的变化
在RNAi实验中,蚊虫羽化率均在90%以上(表2)。通过RNAi沉默AsCYP6Z2基因后,结合qPCR检测该基因的表达量。结果表明,与对照组相比,RNAi组中AsCYP6Z2表达量下调了约80%(P<0.0001)(图6: A),说明通过RNAi有效地抑制了AsCYP6Z2基因的表达。

表2 RNAi实验数据统计
RNAi后雌成蚊接触0.05%溴氰菊酯药膜1 h内的击倒曲线显示:RNAi组从生测10 min开始即出现击倒现象;而对照组则是从30 min时才开始出现击倒现象。两者间呈现出明显的击倒差异(Log-rankP<0.01)(图6: B)。根据蚊虫在生测期间的击倒个数(表3),所计算的半数击倒时间(KT50)显示:RNAi组中溴氰菊酯对雌成蚊的KT50=31.789±3.459 min,对照组中溴氰菊酯对雌成蚊的KT50=41.107±3.716 min。此外,接触0.05%溴氰菊酯药膜1 h并经24 h恢复后,RNAi组中蚊虫的死亡率比照组增加了17%(P<0.05)(图6: C)。RNAi结果说明,沉默AsCYP6Z2基因后中华按蚊对溴氰菊酯的敏感性显著增加,表明AsCYP6Z2基因在蚊虫对溴氰菊酯的抗性上有重要作用。

图6 RNAi干扰AsCYP6Z2后中华按蚊雌成蚊对溴氰菊酯敏感性的变化

表3 RNAi干扰AsCYP6Z2后生测期间中华按蚊雌成蚊击倒个数
2.5 AsCYP6Z2与溴氰菊酯的分子对接分析
以AsCYP6Z2的氨基酸序列为模板,RCSB Protein Data Bank网站中在线搜索,比对出智人HomosapiensCYP3A5(PDB:6MJM)蛋白序列与AsCYP6Z2的同源性最高,序列一致性为39%。选取CYP3A5的三维结构作为同源建模的模板,对AsCYP6Z2进行同源建模,得到AsCYP6Z2的二聚体三维结构模型图(图7: A)。将溴氰菊酯对接至AsCYP6Z2,溴氰菊酯以互补的方式结合在AsCYP6Z2的结合口袋,分子对接预测结果显示:溴氰菊酯的母核苯环以及侧链的酯羰基分别与Cys-155形成Pi-硫相互作用以及稳定的氢键,侧链的二溴乙烯基片段与二甲基环丙基片段则可以与口袋两侧的Ala-165, Val-72, Leu-76, Leu-82和Ala-24形成稳定的疏水相互作用网络(图7: B)。根据对接结果推测,溴氰菊酯与AsCYP6Z2在疏水作用和氢键等的相互作用下可能形成稳定复合物。

图7 AsCYP6Z2蛋白与溴氰菊酯的分子对接模型
3 讨论
有研究报道表明,转录水平的上调表达可能是细胞色素P450酶系活性增强的重要因素之一(Liu and Scott, 1998; Lietal., 2006)。例如,在家蝇Muscadomestica的抗性品系中,CYP6D1,CYP6A24和CYP6D3v2基因存在过量表达现象,家蝇拟除虫菊酯的抗性可能与上述P450基因的过表达有关(Kamiyaetal., 2001)。在冈比亚按蚊Anophelesgambiae中,CYP6M2和CYP6P3能够代谢氯菊酯和溴氰菊酯,并且在野外抗性种群中上调表达(Djouakaetal., 2008);CYP6P9,CYP6P4,CYP6Z1,CYP6Z3和CYP6M7被报道在催命按蚊Anophelesfunestus中与拟除虫菊酯杀虫剂的抗性密切相关(Davidetal., 2013; Riveronetal., 2013)。在冈比亚按蚊Anophelesgambiae与阿拉伯按蚊Anophelesarabiensis中,CYP6Z1,CYP6Z2和CYP6M2等显著上调表达后,可能增强上述基因编码产物在氯菊酯代谢过程中的作用(Chiuetal., 2011; Munhenga and Koekemoer, 2011)。研究表明,上调基因中的CYP6, CYP9和CYP4亚家族成员,与蚊虫对杀虫剂的抗性有关,其中CYP6家族被认为与抗药性关系最为密切的家族(Feyereisenetal., 2006; Yanetal., 2016)。AsCYP6Z2基因属于CYP6家族,其表达量在抗性品系中明显上调。我们推测,AsCYP6Z2基因的上调表达可能是YN-LR品系中维持溴氰菊酯抗性的因素之一。在昆虫中,中肠、脂肪体和马氏管等器官中P450的活性通常较高,并且被认为是主要的解毒代谢器官(Brunetal., 1996)。飞蝗细胞色素P450基因LmCYP6FD3在马氏管、中肠中高表达,显示出该基因在外源物质解毒过程中发挥重要作用(朱文雅等, 2017)。AsCYP6Z2基因在腹部的表达量明显高于在其他部位,而腹部是重要的代谢组织如中肠、马氏管所在的场所。因此,腹部可能是AsCYP6Z2蛋白行使生物学功能的主要部位。在后续的研究中,在全面调查AsCYP6Z2基因全发育和全组织表达模式的基础上,将研究该基因在不同品系与不同组织间表达调控差异的分子基础。
已有大量证据表明,多种昆虫中的P450基因家族成员在杀虫剂抗性方面有重要功能。例如,沉默小菜蛾CYP321E1基因后,幼虫对氯虫酰胺杀虫剂的抵抗能力明显减弱,而引起其死亡率明显增加(Huetal., 2014);沉默抗性品系小菜蛾P.xylostella幼虫体内过量表达的CYP6BG1基因后,导致幼虫对苄氯菊酯杀虫剂的抗性显著降低(Bautistaetal., 2008);淡色库蚊CulexpipienspallensCYP6AA9基因随着溴氰菊酯抗性水平的提高,其表达水平也不断提高,利用RNAi技术沉默抗性品系(Lab-DR2)CYP6AA9基因,导致淡色库蚊的死亡率显著增加(Lvetal., 2016)。本研究中,AsCYP6Z2基因被沉默后,蚊虫对溴氰菊酯的敏感度显著增加,死亡率明显升高,这初步证实了AsCYP6Z2基因在溴氰菊酯抗性表型维持中的功能。这也为今后建立该基因的突变敲除系,并更全面系统评估其功能表型提供了参考。
现有的研究发现,溴氰菊酯可被细胞色素P450羟基化。例如,在油菜花露尾甲Meligethesaeneus中,CYP6BQ23在抗拟除虫菊酯类杀虫剂的幼虫和成虫中过量表达,且重组表达的CYP6BQ23表现出对溴氰菊酯的羟基化催化活性(Zimmeretal., 2014)。在埃及伊蚊Aedesaegypti中,重组表达的CYP6Z8能够代谢拟除虫菊酯,产生3-苯氧基苯甲醇和3-苯氧基苯甲醛(Chandor-Proustetal., 2013)。在我们的研究中,分子对接预测结果暗示AsCYP6Z2与溴氰菊酯间可能存在互作,推测其可能参与催化溴氰菊酯代谢。在此基础上,今后将会探究AsCYP6Z2的酶学性质与杀虫剂代谢机理。
