甜菜夜蛾谷氧还蛋白SeGrx1原核表达、纯化及酶学性质分析
2020-10-15杨付来赵真真王月华张燕宁毛连纲蒋红云
杨付来, 赵真真, 王月华, 张 兰, 张燕宁, 毛连纲, 蒋红云
(中国农业科学院植物保护研究所, 北京 100193)
甜菜夜蛾Spodopteraexigua隶属于鳞翅目(Lepidoptera)夜蛾科(Noctuidae),在世界范围内均有分布,可取食130余种农作物和蔬菜,食源性广、繁殖能力强、具有很强的抗逆能力和成虫迁飞能力,是极难防治的害虫之一(Sunetal., 2015)。因此,研发以甜菜夜蛾蛋白酶为特异杀虫药剂作用靶标的环境和谐性农药对于有效控制该虫为害具有重要意义。
谷氧还蛋白(glutaredoxin, Grx)是生物体内依赖硫醇的抗氧化酶,因为依赖谷胱甘肽才能还原核苷酸还原酶的二硫键被鉴定出来(Mössneretal., 1998),广泛存在于各种生物体内且功能高度保守(Holmgren, 1976)。Grx通过可逆性谷胱甘肽化修饰蛋白质上特定的氨基酸残基调节蛋白质功能,维持和调控细胞内氧化还原状态及相关的信号途径,参与生物体内电子传递以及铁代谢等重要生理活动,在生物氧化胁迫、细胞调亡等许多重要的生命活动中发挥作用,目前是国内外信号转导及疾病治疗靶蛋白的研究热点。至今为止,在酿酒酵母Saccharomycescerevisiae中共发现8个Grxs,以数字分别命名为Grx1-8(Abdallaetal., 2018)。通过χ射线晶体学和核磁共振光谱方法解析其晶体结构,发现Grx1具有典型的CPYC双巯基活性位点,只有一个谷氧还蛋白结构域,N端无信号肽结构,主要由5个α螺旋包围4个β折叠组成(Coppoetal., 2019; Sousaetal., 2019)。其中研究发现Grx1对氧化剂高度敏感,特异性地催化还原特定的靶标蛋白质,具有保护细胞、抗氧化的重要功能(Yeetal., 2014; Mantaetal., 2019)。如哺乳动物细胞毒性试验表明, Grx1可以用来降解除草剂2,4-二氯苯氧基乙酸的毒性,产生羟基自由基,防止2,4-二氯苯氧基乙酸的危害(Liuetal., 2013)。在人类及哺乳动物模型中,Grx1作为细胞内氧化还原态势的重要调节蛋白功能已经得到一定明确,并发现其对人类重大疾病如阿尔茨海默病,血色素沉着病、帕金森病和癌症具有调控功能(Sabensetal., 2010; Levinetal., 2018; Lietal., 2018; Brancoetal., 2020)。随着蛋白修饰、信号转导以及蛋白质组学等方面研究的深入,结合各种技术挖掘Grx1对细胞氧化还原态势调节作用及机理,对于深刻认识 Grx1对人类疾病的调控以及药物开发都十分重要。
国内外关于昆虫Grx的研究较少,仅有几种昆虫的Grx基因被分类鉴定,并初步研究了其在氧化胁迫中的抗氧化功能(Lietal., 2018)。在模式昆虫黑腹果蝇Drosophilamelanogaster中有报道人类Grx1直系同源基因CG6852在果蝇血液重金属铜平衡中具有重要的调节作用(Mercer and Burke, 2016)。在棉铃虫Helicoverpaarmigera中,共有3个Grx基因(HaGrx,HaGrx3和HaGrx5)被鉴定,当棉铃虫受到非正常温度胁迫和H2O2处理时,HaGrx,HaGrx3和HaGrx5表达量发生改变,作者推测其在棉铃虫保护组织免受氧化胁迫损伤中发挥重要作用(Zhangetal., 2016)。但这些研究中,关于昆虫Grx基础生物学特性及抗氧化机制并没有得到系统深入的研究。
本研究中,利用本课题组前期已经获得甜菜夜蛾脂肪体细胞IOZCAS-Spex-Ⅱ转录组数据,克隆甜菜夜蛾谷氧还蛋白1基因SeGrx1,构建原核蛋白表达系统,纯化SeGrx1蛋白,并测定SeGrx1蛋白酶活性和催化动力学参数,以期为明确谷氧还蛋白在昆虫氧化胁迫及凋亡等生命活动中的作用机理提供理论基础。
1 材料与方法
1.1 昆虫细胞
甜菜夜蛾中肠脂肪体细胞IOZCAS-Spex-Ⅱ,由中国科学院动物研究所提供(Zhangetal., 2012)。细胞培养于Grace昆虫培养基(10%胎牛血清,Invitrogen, CA, 美国),其培养条件为26±1℃,RH 70%~80%,每6 d传代1次。
1.2 实验材料
大肠杆菌EscherichiacoliDH5α感受态细胞和BL21(E3)菌株,购自天根生化(北京)有限公司;原核表达载体(pET-16b)和基因克隆载体(pGEM-T Easy Vector System),购自Promega公司;RACE试剂盒(SMARTer® RACE cDNA Amplification Kit)、DNA聚合酶(Ex Taq®)、DNA Marker(DL1000和DL2000),购自TaKaRa公司;HindⅢ,XhoⅠ内切酶以及T4 DNA连接酶,购自New England Biolabs公司;RNA提取试剂盒(RNeasy®Mini Kit),购自QIAGEN公司;DNA纯化提取试剂盒(EasyPure® Quick Gel Extraction Kit)和反转录试剂盒(TransScript One-step gDNA Removal and cDNA Synthesis SuperMix),购自全式金公司;镍-琼脂糖凝胶 HP和分子筛(Superdex75和Superdex200),购自GE Healthcare公司;荧光谷氧还蛋白分析试剂盒(Fluorescent Glutaredoxin Assay Kit 96 Well),IMCO Corporation Ltd AB公司产品;异丙基β-D-硫代半乳糖苷(IPTG)等常用分子和生化试剂,均购自北京博奥拓达科技有限公司。
1.3 甜菜夜蛾SeGrx1基因序列克隆
分别按照RNA提取试剂盒(RNeasy®Mini Kit)和反转录试剂盒(TransScript One-step gDNA Removal and cDNA Synthesis SuperMix)说明书方法进行甜菜夜蛾中肠脂肪体细胞IOZCAS-Spex-Ⅱ总RNA提取和cDNA合成。根据本课题组前期已获得的甜菜夜蛾转录组数据,利用Primer Premier 6.0软件和RACE试剂盒说明书分别设计特异性引物和RACE扩增引物(表1),RACE试剂盒(SMARTer® RACE cDNA Amplification Kit)和DNA聚合酶(Ex Taq®)进行PCR和RACE扩增。针对获得的SeGrx1部分序列及其5′和3′端序列,使用DNAMAN软件进行拼接,获得甜菜夜蛾SeGrx1基因全长。通过NCBI数据库的Open Reading Frame Finder预测开放阅读框(ORF),并设计特异性引物进行ORF扩增(Ex Taq®),PCR产物纯化后连接至pGEM-T Easy Vector System载体,转化大肠杆菌DH5α感受态细胞,挑取阳性克隆进行PCR检测并送公司进行测序。

表1 引物信息
1.4 生物信息学分析
将获得的SeGrx1基因利用DNAMAN 翻译的相应氨基酸序列进行分子量大小和等电点以及多序列对比,通过NCBI Conserved Domains Search在线数据库预测蛋白质家族和活性位点(https:∥www.ncbi.nlm.nih.gov/)。用MEGA7.0软件构建系统发育树。使用Phyre2在线工具预测蛋白质的三维结构(http:∥www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)。
1.5 SeGrx1原核表达
将克隆质粒pGEM-T Easy-SeGrx1和原核表达载体pET-16b分别进行HindⅢ和XhoⅠ双酶切后纯化回收目的产物,T4 DNA连接酶连接转化至大肠杆菌BL21(E3),涂布含氨苄青霉素(Amp)的固体LB培养基37℃过夜培养,挑取阳性克隆,进行菌落PCR和质粒酶切鉴定。将阳性克隆接种于含氨苄青霉素(100 μg/mL)的LB液体培养基中,恒温培养至OD600为0.6~0.8时加入IPTG至其终浓度为0.4~1.0 mmol/L, 25~37℃ 220 r/min诱导4~8 h。离心收集重组菌体后,SDS-PAGE检测蛋白表达,确定最佳诱导表达条件为IPTG终浓度0.5 mmol/L,30℃,220 r/min诱导4 h。
1.6 SeGrx1融合蛋白纯化
按照1.5节获得的最佳诱导表达条件将阳性克隆菌株大量诱导表达后,收获菌体,冰中超声破碎后离心收集上清与提前平衡好的Ni柱相结合,用含0, 20, 50和100 mmol/L咪唑的平衡液洗脱杂蛋白,用含200, 300和500 mmol/L咪唑的平衡液来梯度洗脱目的融合蛋白,SDS-PAGE检测蛋白纯化效果。合并纯化融合蛋白样品,TEV酶切除标签,TEV酶切His标签蛋白与TEV酶质量比分别为4∶1, 2∶1, 1∶1, 1∶1.25, 1∶2.5和1∶5进行酶切比例筛选。然后,将含有融合蛋白的洗脱液,在含有0.5 mmol/L EDTA和1 mmol/L DTT的反应体系中按照质量比为2∶5(融合蛋白∶TEV)加入TEV酶,30℃酶切2 h切除融合蛋白HIS标签。用超滤管浓缩除盐除气,Superdex 75/200分子筛进一步纯化SeGrx1蛋白,纯化蛋白进行Western blot验证,其中SeGrx1多克隆抗体为山东济南安博特生物科技有限公司制备。
1.7 酶活性及酶促反应动力学参数测定
按照试剂盒说明书进行谷氧还蛋白比活力及酶动力学参数测定。酶促反应体系(100 μL):反应缓冲液10 μL, β-NADPH 0.5 μL, GSH 50 mmol/L, 酵母谷胱甘肽还原酶10 nmol/L, 酶液样品50 μL。在标准酶促反应条件下,使用全波长多功能酶标仪记录反应液30 min在520 nm激发光下的545 nm发射光值。以人类谷氧还蛋白酶1(hGrx1)标准品测定标准曲线,计算SeGrx1比活力。酶动力学测定时,荧光底物酵母谷胱甘肽还原酶浓度设置为100, 50, 25, 12.5, 6.25, 3.12和1.56 nmol/L。实验设3次重复,采用双倒数作图法计算Vmax和Km。
2 结果
2.1 甜菜夜蛾SeGrx1基因克隆与生物信息学分析
通过对甜菜夜蛾转录组数据分析获得的甜菜夜蛾Grx1基因片段进行克隆,获得SeGrx1部分序列及其5′和3′端序列。结果显示甜菜夜蛾SeGrx1基因cDNA全长为738 bp(GenBank登录号: MK318813),其中5′非编码区长40 bp,3′非编码区长347 bp,开放阅读框(ORF)全长为351 bp(图1),编码116个氨基酸。预测蛋白分子质量为12.57 kD,等电点(pI)为8.45,不含信号肽序列。

图1 甜菜夜蛾SeGrx1基因序列扩增
NCBI Blast数据显示获得的甜菜夜蛾谷氧还蛋白氨基酸序列隶属于人类GRX human class 1 and 2(h_1_2)-like亚家族,与酿酒酵母SaccharomycescerevisiaeGrx1和Grx2氨基酸序列一致性分别为33.06%和31.47%,但是酿酒酵母Grx2在N端含有信号肽序列。因此,我们确认本研究中获得的甜菜夜蛾胱天蛋白酶为Grx1。甜菜夜蛾SeGrx1与鳞翅目昆虫家蚕Bombyxmori, 棉铃虫Helicoverpaarmigera和斜纹夜蛾Spodopteralitura的同源氨基酸序列进行多重比对,与家蚕BmGrx1同源性最高,序列一致性为81.03%,与斜纹夜蛾SlGrx1-like氨基酸序列一致性最低,为67.80%。它们都具有5个α螺旋4个β折叠等保守序列,含有经典的KXXCPYC催化位点特征残基,CPYC为双巯基活性位点,且只有这一个谷氧还蛋白结构域,为双巯基谷氧还蛋白(图2)。

图2 4种昆虫Grx1蛋白氨基酸序列比对
利用Phyre2在线工具预测甜菜夜蛾SeGrx1蛋白的三维结构。预测结果显示甜菜夜蛾SeGrx1在数据库中与人类Grx2氨基酸序列覆盖度为93%,一致性为40%,三维结构预测结果可信度100%。预测结果为SeGrx1中心由4个平行的和反向平行的β折叠混合组成,外围被5个α螺旋包围。
2.2 SeGrx1系统发育和蛋白相互作用网络预测
应用MEGA7.0中的邻接法,对甜菜夜蛾SeGrx1和其他11种昆虫的Grx1基因构建系统发育树(图3)。如图所示,脐橙螟蛾Amyeloistransitella和丛林斜眼褐蝶BicyclusanynanaGrxs聚为一个分支,同时又和甜菜夜蛾SeGrx1聚为同一分支,表明这3个物种在进化上距离较近。

图3 邻接法构建的基于氨基酸序列的甜菜夜蛾SeGrx1与其他11种昆虫Grx1蛋白系统发育树(1 000次重复)
利用DNAMAN翻译的相应氨基酸序列,输入到STRING在线工具,预测蛋白相互作用网络。因昆虫谷氧还蛋白研究本身较少,在选择分类时,我们选择人类基因组进行,输入甜菜夜蛾SeGrx1的氨基酸序列,bit score最高的是人类谷氧还蛋白2(GLRX2),与2.1节中三维结构预测选择人类谷氧还蛋白2作为模板相一致。因此,以人类谷氧还蛋白2作为模板进行相互作用网络预测。预测结果表明与目标蛋白人类谷氧还蛋白2存在已知、预测或其他相互作用关系的蛋白有硫氧还蛋白(TXN),谷氧还蛋白酶3和5(GLR3和GLR5),谷胱甘肽还原酶(GSR),磷脂过氧化氢谷胱甘肽过氧化物酶4(GPX4),硫氧化还蛋白2(TXN2),过氧化氢酶(CAT),超氧化物歧化酶(SOD),以及过氧化物还原酶3和6(PRDX3和PRDX6),这些蛋白的主要功能具有相似性,通过调节细胞内氧化还原状态而参与多种细胞生理过程,表明SeGrx2在保护昆虫组织免受氧化胁迫损伤中可能发挥重要作用。
2.3 重组质粒pET-16b-SeGrx1构建及原核表达
图4所示,相比空载体,携带重组质粒pET-16b-SeGrx1菌株在OD值为0.6, 0.8和1.0时经IPTG诱导后,裂解液上清中呈现明显多出蛋白条带,大小约为16 kD,与预期重组蛋白大小相符合,且当菌液OD600=0.6时,诱导表达目的蛋白条带相对OD值为0.8和1.0时较为明显,且在上清液总蛋白含量比率较高。因此,诱导表达条件为当菌液OD600=0.6时加入终浓度为0.5 mmol/L的IPTG在30℃下诱导4 h。

图4 甜菜夜蛾SeGrx1融合蛋白的诱导表达
2.4 融合蛋白纯化及验证
SDS-PAGE结果(图5)显示,含有目的融合蛋白的上清液过Ni-TNA柱后,目的融合蛋白能够有效挂柱,用含有0, 20和50 mmol/L咪唑的洗脱液能够洗脱杂蛋白,而含有200和300 mmol/L咪唑的洗脱液能够洗脱目的融合蛋白,融合蛋白条带清晰,分子量大小约16 kD左右,与预测目标蛋白大小一致。因此,融合蛋白纯化条件为先用含有0, 20和50 mmol/L咪唑洗脱液能够洗脱杂蛋白,而后用含有200 mmol/L咪唑的洗脱液洗脱目的融合蛋白。

图5 SDS-PAGE检测纯化的His-SeGrx1融合蛋白
图6(A)显示切除His标签后的目的蛋白分子量大小在13 kD左右。用Superdex 75/200分子筛进一步纯化目的蛋白。纯化样品SDS-PAGE电泳检测(图6: A, 泳道8和9)及Western blot验证纯化搜集的蛋白就是SeGrx1,同时目的蛋白纯度可达95%以上(图6: B)。
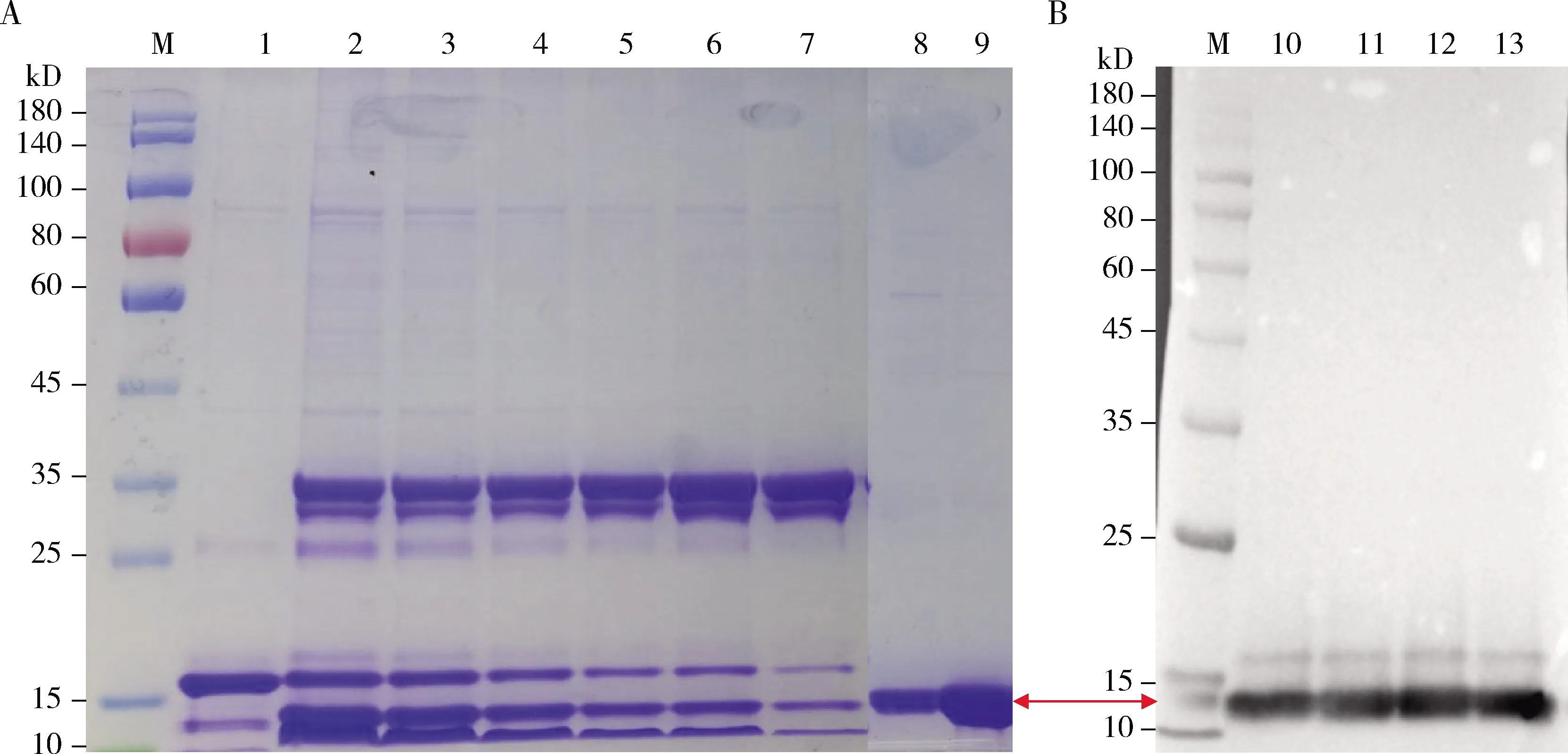
图6 His-SeGrx1融合蛋白His标签切除与纯化的SDS-PAGE(A)和Western blot(B)验证
2.5 SeGrx1蛋白的酶活力和酶动力学常数
根据试剂盒说明书测定纯化SeGrx1酶比活力和动力学常数,用人类谷氧还蛋白1(hGrx1)标准品建立标准曲线可求出SeGrx1酶比活力为0.577 U/mg pro(根据试剂盒说明,1 U定义为在20℃,pH 7.5条件下,1 nmol/L hGrx1对荧光底物酵母谷胱甘肽还原酶的催化能力)(图7: A)。通过建立的双倒数曲线,得到动力学常数最大反应速度Vmax为20.5 U/mg pro,米氏常数Km为14.3 nmol/L(图7: B)。

图7 SeGrx1蛋白酶活力和酶动力学常数
3 讨论
本研究以甜菜夜蛾转录组数据为基础,克隆了SeGrx1基因全长(GenBank登录号: MK318813),开放阅读框(ORF)长351 bp,编码116个氨基酸。在结构上,SeGrx1蛋白中心含有4个平行和反向平行的β折叠,外围被5个α螺旋包围,含有经典的KXXCPYC催化位点特征残基,CXXC为双巯基活性位点,即SeGrx1属于双巯基谷氧还蛋白(图2)。双巯基谷氧还蛋白在生物体内有多种功能,通常都是通过CXXC催化位点催化可逆的二硫键还原和氧化反应来执行(Foloppe and Nilsson, 2007)。这些预测结果表明, SeGrx1的结构与其他已知谷氧还蛋白在结构上明显相似,具有典型的谷氧还蛋白折叠。同时催化位点和GSH结合口袋氨基酸的保守性也表明SeGrx1具有典型的谷氧还蛋白酶活性功能。
为了进一步探究谷氧还蛋白的基础生物学特性,我们构建了pET-16b-SeGrx1蛋白表达质粒。通过优化诱导条件,在250 r/min培养大肠杆菌至OD600为0.6时,加入终浓度为0.5 mmol/L的IPTG,30℃继续培养4 h诱导融合蛋白表达(图4)。可溶性SeGrx1-6 His融合蛋白被Ni-TNA柱吸附结合后,通过优化洗脱条件,融合蛋白条带清晰,分子量大小为16 kD左右,切除标签后的目的蛋白大小在13 kD左右(图5),和理论SeGrx1蛋白的分子量12.57 kD相符。经过Superdex 75/200分子筛进一步纯化目的蛋白,可以得到基本无杂蛋白、纯度在95%以上的目的蛋白,其状态均一,折叠良好,Western blot进一步验证收集的目的蛋白就是SeGrx1(图6)。谷氧还蛋白催化的氧化还原反应主要是通过Grx中的半胱氨酸(C)基团催化GSH的巯基(-SH-)与二硫键(-S-S-)的交换反应,从而调节蛋白质的氧化与还原态,维持细胞内氧化平衡(Galloglvetal., 2008, 2009)。体外测定了甜菜夜蛾SeGrx1对GSH依赖的还原酶的氧化能力,SeGrx1酶比活力为0.577 U/mg pro,最大反应速度Vmax为20.5 U/mg pro,米氏常数Km为14.3 nmol/L(图7)。
本研究克隆了甜菜夜蛾谷氧还蛋白基因SeGrx1,在通过不断优化诱导和纯化条件获得了高纯度和高活性的SeGrx1蛋白,并发现酶活性和催化活性都比较高,为深入研究谷氧还蛋白在昆虫氧化胁迫及凋亡等生命活动中的功能提供了理论基础。
