低渗破红法在非小细胞肺癌患者血性胸水中的应用
2020-10-15刘芳芳陈智伟祁晓育
刘芳芳, 陈智伟, 祁晓育
血性胸水产生的病因多种多样,而血性胸水的产生以恶性肿瘤多见[1]。常规的细胞块技术常因红细胞过多,掩盖肿瘤细胞[2],或者因肿瘤细胞丰度过低,使免疫组织化学、靶向治疗相关位点的基因检测无法进行,影响病理诊断和临床治疗。肺癌是临床上最常见的肿瘤,现已居癌症死亡原因的第一位,其中约85%为非小细胞肺癌(non-small-cell carcinoma,NSCLC)[3]。胸水样本通常成为失去手术和穿刺指征或靶向治疗后产生耐药的NSCLC患者首选的检测样本。本实验通过低渗破红法制备肿瘤细胞富集的细胞蜡块,探讨低渗破红法对NSCLC患者血性胸水中肿瘤细胞形态的影响及其在分子病理检测前评估中的应用。
1 材料与方法
1.1材料
1.1.1样本 收集2018年3月-2019年3月送检的经免疫组织化学染色确诊为NSCLC的血性胸水样本24例,男性10例,女性14例,年龄(69.25±10.98)岁(53~90岁)。所有样本均由病理科副主任医师提供明确病理诊断与细胞形态判定。
1.1.2主要试剂 体积分数为10%的中性缓冲甲醛;蒸馏水;体积分数为50%的乙醇+10%中性缓冲甲醛混合液(临用前按1∶1混合);DNA提取试剂盒(批号:12219082501X)、RNA提取试剂盒(批号:02218110501X)、人类EGFR基因突变检测试剂盒(批号:11219081401X)、人类EML4-ALK融合基因检测试剂盒(批号:01218081703X)、人类ROS1基因融合检测试剂盒(批号:11219020201X)(厦门艾德生物医药科技股份有限公司)。
1.1.3主要仪器 台式高速离心机(TG16-WS,湖南湘仪实验室仪器开发有限公司);PCR仪(LightCycler 480,罗氏医学仪器公司);紫外分光光度计(SMA4000,Amoydx-Gimffe厦门艾德生物医药科技股份有限公司)。
1.2方法
1.2.1实验分组 根据前期对血性胸水不同的处理方法将实验分为3组,即A组(常规组),胸水样本直接离心后取沉淀,悬浮固定制备成细胞块;B组(混合液破红组),采用50%乙醇+10%中性缓冲甲醛混合液破红后[4],悬浮固定制备成细胞块;C组(低渗破红组),采用蒸馏水低渗破红后,悬浮固定,制备成细胞块。
1.2.2细胞块的制备及H-E染色 收集血性胸水,静置30 min,弃部分清澈的上清液,将剩余部分摇匀。用3支50 mL离心管分别取45 mL血性胸水,3 000 r/min离心5 min,弃上清。A组加入10%中性缓冲甲醛15 mL悬浮固定2 h;B组加入50%乙醇+10%中性缓冲甲醛混合液45 mL;C组加入蒸馏水45 mL。B,C两组在振荡器中1 500 r/min充分混匀后,3 000 r/min离心5 min,弃上清,再加入10%中性缓冲甲醛15 mL悬浮固定30 min。3组样本均于3 000 r/min下离心5 min,弃上清,取出细胞团,棉纸包裹后脱水包埋制成细胞块,切片厚度为4 μm,行H-E染色。
1.2.3核酸提取及相关基因检测 取3种不同方法所获得的细胞块,各切取厚度为5 μm的石蜡卷5卷于1.5 mL的EP管中。加入1 mL二甲苯,1 500 r/min震荡至石蜡完全溶解,12 000 r/min离心2 min,弃上清。加入1 mL无水乙醇,1 500 r/min震荡,12 000 r/min离心2 min,去除残余二甲苯,弃上清。按照石蜡组织标本DNA和RNA提取试剂盒说明书提取细胞块基因组DNA和RNA。紫外分光光度计检测DNA及RNA的浓度和质量。对C组样本采用ARMS-PCR法进行肺癌靶向治疗相关的基因检测,包括EGFR基因突变检测、EML4-ALK融合基因检测及ROS1融合基因检测。按照说明书于Light-cycler 480 PCR仪上机检验。
1.2.4结果判断 H-E染色结果由病理科副主任医师显微镜镜检后,按照既定的评定标准进行判读(表1)。对所获取的DNA和RNA样本通过紫外分光光度计检测浓度和纯度,浓度≥2 ng/μL、且DNR/RNA和蛋白质含量的比值(OD260/280)在1.8~2.1视为核酸样本合格。基因突变检测结果由两名分子病理诊断医师对PCR反应扩增曲线进行判读。

表1 细胞块石蜡切片H-E染色结果评价标准
1.3统计学处理 采用SPSS 19.0软件进行统计分析,χ2检验分析H-E染色结果评分差异和核酸质量合格率,P<0.05为差别具有统计学意义。
2 结 果
2.1H-E染色 A组切片红细胞含量多,肿瘤细胞丰度低、轮廓结构模糊,并且存在细胞重叠、掉片等情况(图1A);B,C组切片红细胞含量低,肿瘤细胞丰度高,细胞结构轮廓清楚,背景清晰,较少出现细胞重叠、掉片情况(图1B,C)。经统计学分析显示,H-E染色评分A组与B组及C组比较,差别均具有统计学意义(P<0.05),而B组与C组间差别则无统计学意义(P>0.05,表2)。
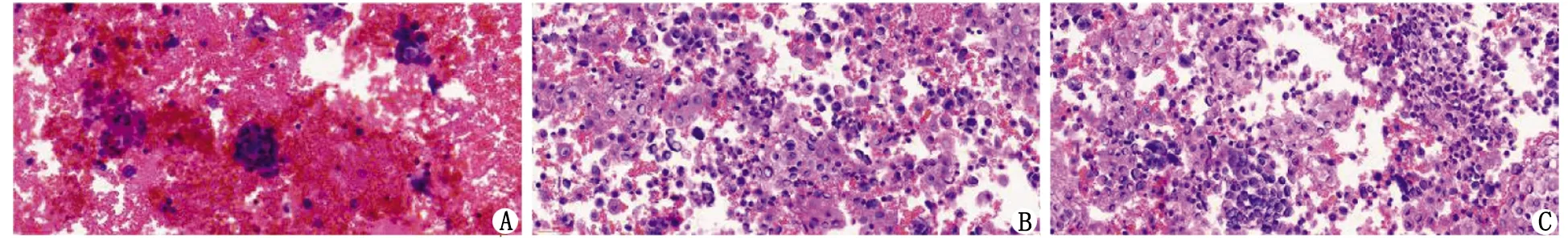
A:A组常规细胞块技术制备的切片;B:B组50%乙醇+10%中性缓冲甲醛混合液破红后制备的切片;C:C组低渗破红法破红后制备的切片.图1 细胞块石蜡切片H-E染色结果( ×400)Fig 1 The results of H-E staining( ×400)
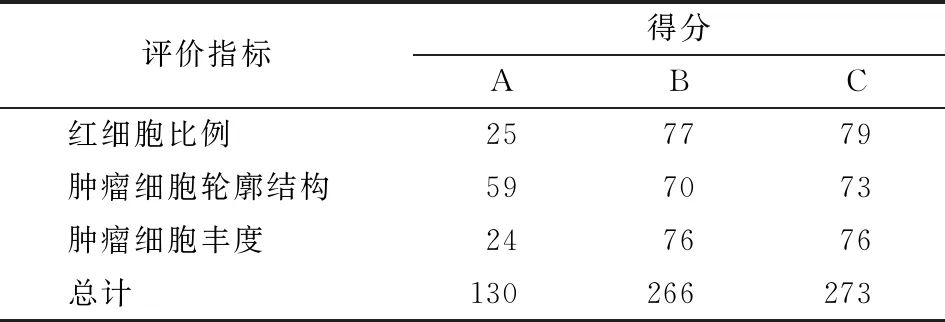
表2 细胞块石蜡切片H-E染色评价结果
2.2核酸检测结果 经紫外分光光度计检测A,B,C 3组细胞块所提取DNA浓度和纯度(图2),所提取的DNA合格率分别为54.2%,95.8%和100%,C组明显高于A组,两者差别有统计学意义(P<0.05),而B组与C组间差别则无统计学意义(P>0.05,表3)。
经紫外分光光度计检测A,B,C 3组细胞块所提取RNA浓度和纯度(图2),所提取的RNA合格率分别为29.2%,75%和79.2%,C组明显高于A组,差别有统计学意义(P<0.05),而B组与C组间差别则无统计学意义(P>0.05,表3)。
2.3基因检测结果 将C组所提取的核酸进行肺癌靶向治疗相关的基因检测,其中13例检测到EGFR基因突变,11例为野生型。24例样本均未检测到EML4-ALK和ROS1融合基因(图3)。所有检测结果均符合厦门艾德生物医药科技股份有限公司所提供相应试剂盒说明书判读标准。实验结果表明低渗破红法细胞制备的细胞块提取的基因组核酸合格率高,且适用于相应的肺癌靶向治疗相关的基因检测。
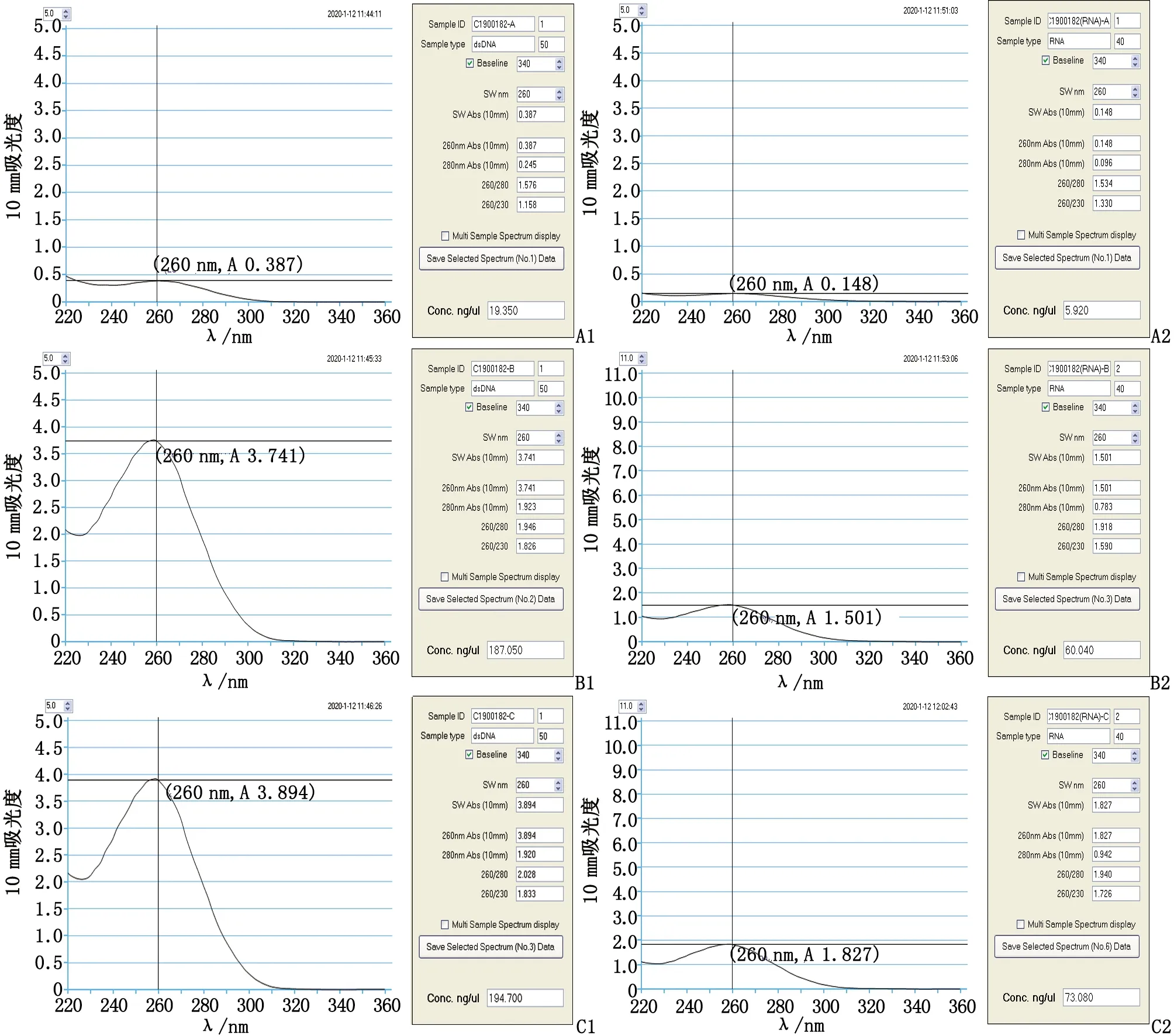
A1及A2:A组常规细胞块技术所获DNA和RNA;B1及B2:B组50%乙醇+10%中性缓冲甲醛混合液破红所获DNA和RNA;C1及C2:C组低渗破红法所获DNA和RNA.图2 核酸样本DNA或RNA的浓度及质量检测结果Fig 2 The detection results of DNA or RNA concentration and purity
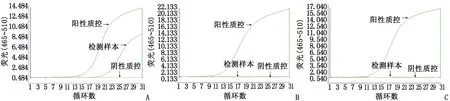
A:EGFR基因突变检测结果;B:EML4-ALK融合基因检测结果;C:ROS1融合基因检测结果.图3 低渗破红法所获核酸ARMS-PCR检测结果Fig 3 The results of ARMS-PCR

表3 不同方法获得细胞块所提取核酸合格率比较
3 讨 论
近年来,肺癌的发病率和死亡率逐年增加,现已成为临床最常见的死亡原因[5],大部分患者就诊时已是晚期[6],其中,多数为NSCLC。随着精准医疗概念的提出以及NSCLC驱动基因的靶向治疗取得明显的疗效,基因突变的分子检测成为NSCLC靶向治疗的指向性指标[7]。驱动基因包括EGFR基因突变、ALK基因融合/重排、c-ROS-1融合/重排、c-MET基因突变、KRAS基因突变、BRAF基因突变及免疫治疗指标PD-1和PD-L1等[8-9]。对于红细胞富集的血性胸水直接离心收集脱落的肿瘤细胞,无论是直接取沉淀拉片或制备成细胞块进行切片,均因红细胞过多而掩盖肿瘤细胞,造成肿瘤细胞检出率低,导致相应靶向基因突变检测无法进行,使这部分患者失去精准靶向治疗的机会。然而破红处理经常会对血性胸水中的肿瘤细胞造成一定的影响,如结构不够清晰,细胞形态不够清楚,给NSCLC的诊断造成困难。现已有文献报道多种去红细胞法,如氯化铵去红细胞法、乙酸去红细胞法等对胸水中的肿瘤细胞形态影响较小,但其对NSCLC患者血性胸水中肿瘤细胞分子检测的影响尚未可知[10]。
低渗破红法是通过不同细胞对渗透压的渗透脆性不同达到分离细胞的目的,其关键技术是最大限度的破坏红细胞而又最大程度保护目的细胞。低渗破红法制备细胞块操作简便、经济。根据本研究获得的经验,低渗破红法的破红时间过长或反复破红甚至离心次数及离心速率亦会对肿瘤细胞造成损伤,在实验过程中应减少破红次数,缩短破红时间,采用低速离心方法制备细胞块。核酸的质量是驱动基因状态检测的基础,需对制备的细胞块切片进行H-E染色,显微镜下评估肿瘤细胞丰度与状态。切取适当数量的细胞蜡卷,保证足够数量的肿瘤细胞,达到肺癌靶向治疗相关的基因检测的要求。常规方法处理获得的细胞块红细胞丰度较高,所提取的核酸浓度低、质量差,且血红素为PCR反应的抑制物,常常使驱动基因状态检测出现假阴性结果甚至检测失败。低渗破红法和50%乙醇+10%中性缓冲甲醛混合液破红所获得的细胞块红细胞量明显减少,核酸浓度和质量合格率明显提高,增加了肺癌靶向基因检测的成功率和可信度。50%乙醇+10%中性缓冲甲醛混合液破红法是目前常用的破红方法,低渗破红法与之相比较无明显差异。
本研究结果表明,低渗破红法去除NSCLC患者血性胸水中的红细胞,使H-E切片染色背景清晰,红细胞含量显著降低,肿瘤细胞丰度明显升高,细胞结构轮廓清楚,有效减少细胞重叠、掉片等情况,明显提高肿瘤细胞的检出率。肺癌驱动基因检测13例为EGFR基因突变型,11例为野生型,突变率为54.2%。文献报道在ⅢB和Ⅳ期的NSCLC组织学标本中,EGFR基因突变检出率为51.4%[11],ALK和ROS1基因突变的检出率分别为4.65%和1.0%[12-13],本研究结果与上述结果基本一致。综上所述,低渗破红法不仅是处理NSCLC患者血性胸水的有效方法,且该方法制备的细胞块能够支持肺癌靶向治疗相关的基因检测。
