2种显色培养法与PCR法检测B族链球菌的效能比较
2020-10-14杜海燕谭延国杜金龙唐春燕刘淑梅
杜海燕,钟 欣,谭延国,张 岩,杜金龙,唐春燕,刘淑梅
(首都医科大学附属复兴医院检验科,北京 100038)
B族链球菌(GBS),也称无乳链球菌,以其细胞壁多糖类C物质属于Lancefield抗原结构分类中的B群而得名[1]。GBS为寄生于人类下消化道或泌尿生殖道的条件致病菌,在围生期常导致孕产妇生殖道感染、严重的新生儿感染甚至死亡,因此围生期妇女需要产前常规筛查GBS,以保证母婴的健康,且此建议已被写入相关学科的指南和专家共识。目前,常用筛查GBS的方法有传统微生物学培养法、显色培养法和分子生物学方法等,但只有对这些检测方法的效能有了深入的认知,方可做出正确地选择,以便更有效地筛查出GBS感染者。本文使用GBS标准菌株和临床分离株,对2种显色培养法及PCR法检测GBS的效能进行了评估,现报道如下。
1 材料与方法
1.1菌株及试剂
1.1.1GBS菌株 GBS国际标准菌株(ATCC 12386)及从临床患者分离并经质谱仪鉴定的20株GBS测试菌株。
1.1.2干扰试验菌株 白色念珠菌(ATCC 24433)、大肠埃希菌(ATCC 25922)、粪肠球菌(ATCC 29212)共3株。
1.1.3GBS显色增菌培养基 凯必利GBS显色培养基(杭州创新生物技术有限公司,A试剂)、贝索GBS显色培养基(珠海贝索生物技术有限公司,B试剂),按说明书要求,以培养18~24 h出现橘红色的颜色变化为阳性。
1.1.4PCR法GBS检测系统 中山大学达安基因股份有限公司的GBS核酸检测试剂盒和扩增仪(DA-7600),结果判读以循环阈值(Ct)<38为阳性,Ct≥38为阴性。增菌后的GBS使用哥伦比亚培养基(英国OXOID)进行分离培养。
1.2方法 主要评估各种方法能够检测出GBS的最低菌落数(即检测下限)、对20株临床GBS分离株的检出能力、抗模拟肠道菌干扰的能力等。
1.2.1各种方法能够检测出GBS的最低菌落数 (1)以系列稀释的GBS标准菌株评估。首先,将标准菌株转种到哥伦比亚培养基,于35 ℃培养18~24 h。挑取菌落配成0.5麦氏浊度菌液(1.5×108CFU/mL)。用无菌生理盐水10倍系列稀释为8个浓度,见表1。(2)稀释后的各浓度菌悬液分别按表1中的吸取量接种到哥伦比亚培养平板(每个浓度菌液平行接种3个平板),置35 ℃培养18~24 h计数菌落,以验证加入的菌落数是否符合预期。(3)分别取上述各浓度的菌液0.01 mL,接种在A、B显色培养基,于35 ℃分别培养6、12、18、24、30 h,于每个时间点观察培养基的颜色变化并记录,每个浓度重复3次;同步使用PCR方法,测定上述各浓度菌液。(4)于每个观察时间点从两种显色培养基中吸取0.01 mL菌液接种于哥伦比亚培养平板,观察是否出现GBS的典型菌落。
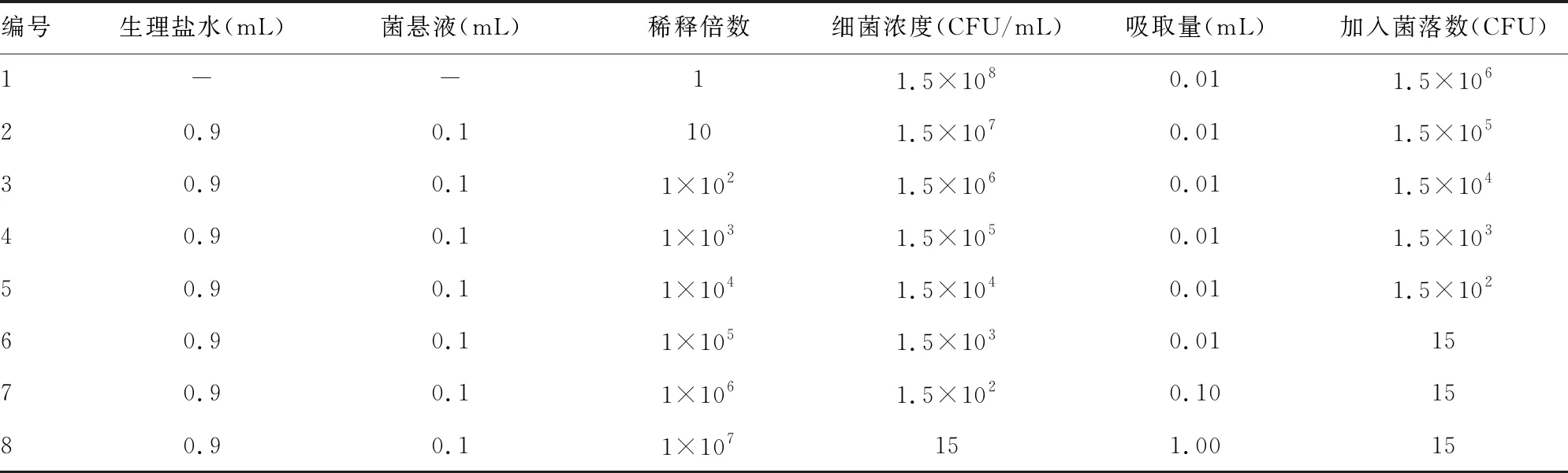
表1 标准菌株稀释表
1.2.2各种方法对20株临床GBS分离株的检出能力 将20株GBS临床分离株分别配置成1.5×106CFU/mL的菌悬液。每个菌株分别加入0.01 mL(实际加入菌落数为1.5×104CFU)上述菌悬液于A、B(A试剂、B试剂)2种显色培养基,35 ℃培养18~24 h观察颜色变化。同时使用PCR法测定上述菌悬液,并观察3种方法的检出情况。显色法培养18~24 h,观察颜色变化后,再吸取0.01 mL,接种于哥伦比亚平板,用以确认有无GBS生长。
1.2.3各种方法检测GBS的抗干扰能力 使用模拟的肠道菌悬液,观察是否能够干扰几种方法对GBS的检测。分别取白色念珠菌(ATCC 24433)、大肠埃希菌(ATCC 25922)、粪肠球菌(ATCC 29212)标准菌株,按菌量为1∶1∶1的比例,配置成1.5×103CFU/mL模拟肠道菌悬液。取1.5×103CFU/mL的上述菌液0.1 mL,分别加入A、B 2种显色培养管中培养(分别已接种有1.5×103CFU、1.5×102CFU和15 CFU的GBS标准菌株)。置35 ℃培养,并分别于6、12、18、24、30 h观察颜色变化和记录结果。本实验重复测定3次。
1.3统计学处理 应用SPSS19.0统计软件进行数据分析,计数资料以率表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1几种方法能够检测出GBS的最低菌落数
2.1.1预期加入的菌落数验证 6号菌液预期加入菌落数为15 CFU,实际加入菌落数为50 CFU左右,而7号和8号菌液与预期菌落数接近。见表2。
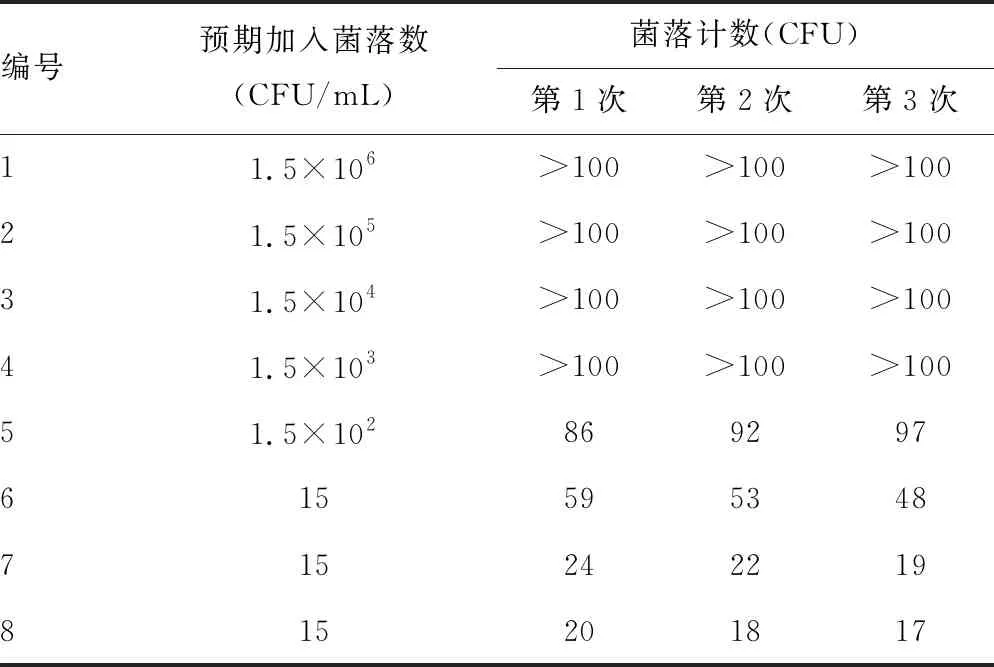
表2 系列稀释的标准菌株菌悬液菌落计数验证试验
2.1.2几种方法检出GBS的最低菌落数 (1)A试剂显色培养法:8个浓度的标准菌液分别接种到8个增菌培养管中,培养18 h,第1次试验1~8号均为阳性;重复第2次培养18 h时,1~6号均为阳性,7~8号培养30 h时,仍为阴性;重复第3次培养18 h时,1~6号均为阳性,7~8号为弱阳性,培养24 h和30 h时,7~8号均转为阳性。(2)B试剂显色培养法:第1次试验培养18 h时,1~7号均为阳性,8号培养30 h时,仍为阴性;第2次培养18 h时,1~8号菌液均为阳性;第3次培养18 h时,1~8号均为阳性。随后对7~8号标准菌液加做了补充试验,每个浓度A、B两种增菌培养试剂均分别做10管,结果7、8号标准菌液的10个测试管培养18 h时,均判定为阳性。故可得出A、B两种显色培养基可检出GBS的最低加入菌量为15 CFU。(3)PCR法检测 3次重复试验显示,1~3号标准菌液均为阳性;4号标准菌液仅1次Ct值超出cut-off值(Ct值=38.11>38),判定为阴性,5~8号标准菌液均无扩增信号。故可得出PCR法可检出GBS的最低加入菌量为1.5×104CFU。见表3。
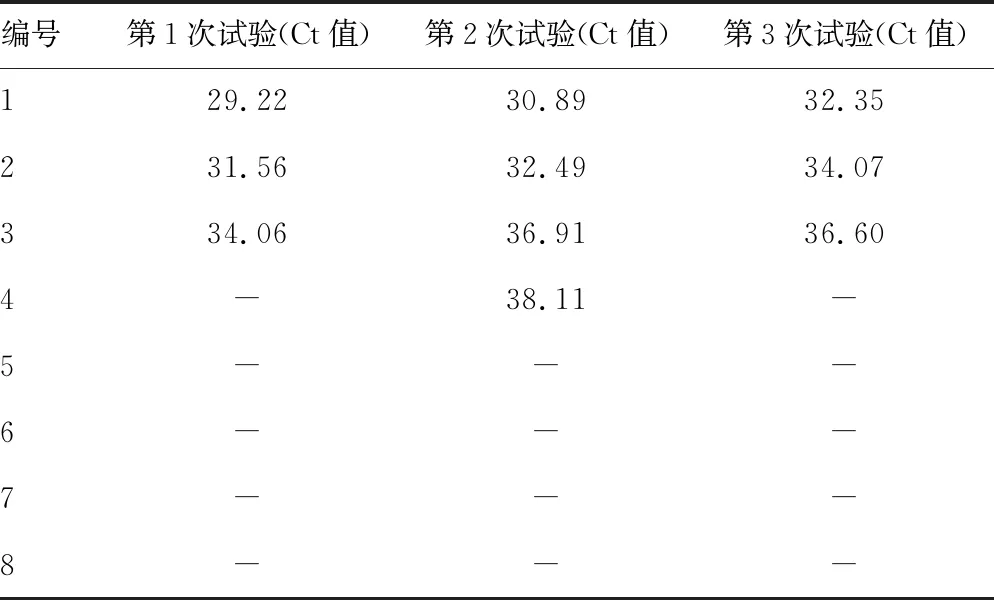
表3 PCR法能够检出GBS的最低菌量
2.2各种方法对20株临床GBS分离株的检出能力 20株临床GBS分离株在加入3种检测试剂时,加入菌落数为1.5×104CFU时,A、B两种显色培养基所接种的20株菌均为阳性;PCR法仅有11株菌为阳性,另3株虽小于cut-off值,但仍有扩增信号。经χ2检验,两种显色法的检出率均明显高于PCR法,差异有统计学意义(P<0.05)。见表4。
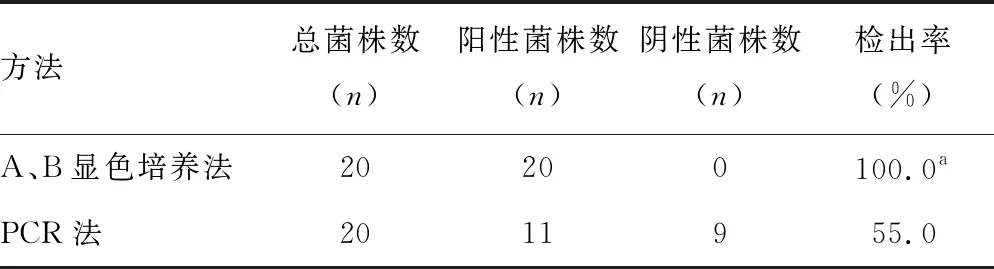
表4 显色培养法和PCR法对20株临床GBS分离株检出能力比较(加入菌量为1.5×104 CFU时)
2.3模拟肠道菌对3种方法的干扰 A、B试剂(分别加入1.5×103、1.5×102、15 CFU的GBS菌液),在分别加入1.5×102CFU模拟肠道菌后所重复的3次试验中,2种试剂仅加入15 CFU的GBS时出现1次显色被延迟至24~30 h,而未加干扰菌时,该浓度均在增菌培养18 h后出现清晰的显色反应。而2种试剂其余各浓度均于培养18 h显色明显,而仅加入模拟菌液的对照组则均呈阴性反应。由于上述GBS加入菌液浓度过低,使用PCR法检测时均为阴性反应。
3 讨 论
GBS多定植于健康成年人的下消化道和泌尿生殖道,人群定植率为15%~30%。当免疫力低下或缺陷时,易发生GBS感染[2-3]。对于围生期孕妇来说,GBS的危害远高于非妊娠女性。孕妇一经感染,除可引起孕妇胎膜早破、早产和产后产褥感染外,还会导致新生儿发生肺炎、败血症、脑膜炎、神经系统后遗症,甚至死亡[4-5]。此外,GBS具有较强的绒毛膜穿透力,可感染胎盘绒毛膜,从而进一步感染新生儿[6-9]。因此,选择可靠的GBS检测方法,尽可能地发现携带GBS的孕妇具有重要意义。
本研究使用的两种GBS增菌显色培养法,经过18~24 h的增菌培养,均可检出最低达15 CFU的加入量,具有较高的灵敏度。该方法利用的是GBS具有产生橙色(橘红色)类胡萝卜素的独有特性,液体培养基相对于固体培养基,微生物接种的成活率和繁殖效率均较高,培养基从白色到橙色的变化表示GBS的存在,菌落数量培养基中还加入了促进GBS快速生长和抑制其他杂菌生长的物质,这也是这种方法能够测出较少菌落数量和较短培养时间的关键所在。PCR法可以通过检测标本中GBS特定基因,从而判断GBS的存在,理论上具有较高的灵敏度和准确度及报告时间快等,但本研究显示其最低只能够检测出1.5×104CFU的加入量。这可能与不同厂商的生产工艺有关,故无论使用任何一种方法,投入使用前均需进行必要的性能验证。
GBS增菌显色培养法对20株临床分离株的检出能力较为稳定,受所加入菌落数影响较小;显色培养12 h时,各种GBS加入量的培养基便陆续出现轻微的颜色变化,在18 h后均能出现稳定颜色反应,而PCR法则随着加入GBS 菌落数的降低,检出能力降低很明显,这会明显影响临床孕产妇GBS的检出率,但对处于未知GBS定植状态且没有其他危险因素的足月孕妇,可能更适用PCR法[10-13]。
本研究结果还显示,仅加入15 CFU的GBS时,模拟肠道菌会偶尔导致显色时间被延迟的现象,故建议在18~24 h未出现显色反应的标本,可适当增加判读时间至30 h。
4 结 论
综上所述,显色培养法能够检测出更少菌落数的GBS,有助于提高孕妇产前GBS的检出率,由于其操作简便、结果易于判读,值得推广应用。
