BSA-葡聚糖-叶黄素纳米颗粒的制备及其抗氧化活性
2020-10-14侯惠静张晓燕陈建波柳昊杰孟令莉石振鹏吴子健赵伟
侯惠静,张晓燕,陈建波,柳昊杰,孟令莉,石振鹏,吴子健,*,赵伟
(1.天津天狮学院食品工程学院,天津 301700;2.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;3.天津商业大学国有资产与实验室管理处,天津300134;4.江南大学食品学院,江苏无锡214122)
叶黄素(lutein)是已知的600种类胡萝卜素物质之一,广泛存在于绿叶植物中,如菠菜、甘蓝、黄胡萝卜以及万寿菊花瓣[1]。其主链含有胡萝卜素物质典型的9个共轭双键,而其分子的两端含有羟基[2-3],因而也属于胡萝卜醇的一种[4]。叶黄素具有很好的抗氧化性能[5-6];也是构成人类视网膜的主要黄斑色素,其多烯链的共轭长度决定了其最大吸收峰波长在蓝光波谱范围内[7-8],使其能有效吸收和过滤高能量且损伤视网膜细胞的蓝光,进而减少视网膜的光氧化损伤[9-10],改善视觉功能;此外,它还具有比β-胡萝卜素更强的抗癌活性(如乳腺癌、前列腺癌等)[11-12]。然而,叶黄素分子结构中的多不饱和双键导致其在光照、氧气、高温等作用下易发生降解和异构化,并且其水溶性也较差,因而其在人体中的生物利用率低[13],这些都极大地限制了叶黄素在食品和医药等领域的应用。叶黄素的分子结构[14]如图1所示。
图1 叶黄素的分子结构Fig.1 Molecular structure of lutein
纳米颗粒因其能够通过囊封作用提高小分子活性物质的化学稳定性、水溶度以及生物利用率,被广泛用于食品及医药工业中[15]。美拉德反应将蛋白与糖共价结合形成的接枝产物可成为纳米颗粒的壁材,用于活性物质的包埋,进而提高活性物质的理化稳定性和水溶性[16]。Fan Y等[17]利用干热法制备得到的BSA-葡聚糖共聚物,通过自组装可与姜黄素形成纳米颗粒,进而明显提高姜黄素的化学稳定性及细胞抗氧化活性;宋江峰等[18]使用辛烯基琥珀酸酯化淀粉和蔗糖为壁材,并通过单因素试验和正交试验优化了包埋叶黄素的工艺;曾治平等[19]以明胶和阿拉伯胶为壁材,采用复凝聚法制备叶黄素纳米颗粒,对叶黄素纳米颗粒的制备工艺、理化性质以及贮藏稳定性进行了研究,徐建中等[20]优化了叶黄素纳米颗粒的工艺条件,解决了叶黄素在高含量条件下的稳定性问题。
本研究拟通过制备牛血清白蛋白V与葡聚糖共聚物对叶黄素进行包埋形成纳米颗粒。测定叶黄素纳米颗粒的包封率,粒径及Zeta电势,分析纳米颗粒的稳定性;同时也检测了叶黄素纳米颗粒的体外及细胞抗氧化性能。
1 材料与方法
1.1 材料与试剂
叶黄素(纯度≥90%):上海源叶生物科技有限公司;葡聚糖(分子量20 kDa):MACKLIN公司;过硫酸钾(纯度99.5%):上海阿拉丁生化科技股份有限公司;牛血清白蛋白Ⅴ(分子量 68 kDa)、2',7'-二氯二氢荧 光 素 二 乙 酯 (2',7'-dichlorofluorescin diacetate,DCFH-DA)、2,2'-偶氮二异丁基脒二盐酸盐(2,2'-azobis[2-methylpropionamidine]dihydrochloride ,ABAP)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(methylthiazolyldiphenyl-tetrazolium bromide,MTT):Sigma-Aldrich公司;平衡盐溶液、胎牛血清等:赛默飞世尔科技;其余试剂均为国产分析纯。
1.2 仪器与设备
R-200旋转蒸发仪、NTS-4000C恒温振荡水浴摇床:日本EYELA公司;Zetasizer Nano-ZS 90型纳米粒度分析仪:英国Malvern公司;Apreo扫描电镜:美国FEI公司;HERAcell vios 160i CO2培养箱、VARIOSKAN LUX微孔板检测器:美国Thermo公司。
1.3 方法
1.3.1 牛血清白蛋白-葡聚糖共聚物的制备
采用湿法美拉德反应制备牛血清白蛋白与葡聚糖共聚物[21],具体步骤为:先将牛血清白蛋白V与葡聚糖按摩尔质量比7∶1溶于磷酸盐缓冲液(0.01 mol/L,pH=8.50)中,蛋白浓度为2.80 mg/mL,95℃下磁力搅拌2.3 h后,迅速冷却并离心(6 000 r/min,4℃,15 min),取上清液并于4℃下透析24 h,分子截留量(20±0.2)kDa后,冻干即得牛血清白蛋白-葡聚糖共聚物(dextran-bovine serum albumin-lutein,DBSA)。
1.3.2 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
参考王帅等[22]方法,具体参数:10%分离胶、4%浓缩胶、7.0 μL蛋白样品上样量、蛋白质浓度1.0 mg/mL、电压200 V。
1.3.3 傅里叶变换红外光谱的测定
参考Cheng Z J等[23]的方法,并做出调整:称取适量的样品,加入一定量的溴化钾(样品与溴化钾的质量比为1∶100),研磨成均匀的粉末并压成薄片,用傅里叶变换红外谱仪作全波段(4 000 cm-1~400 cm-1)扫描,扫描16次,扫描前用溴化钾薄片扣除背景。
1.3.4 叶黄素纳米颗粒的制备
根据张雅婷等[24]的方法制备叶黄素纳米颗粒,稍作修改,具体步骤为:将BSA和DBSA分别溶于去离子水中,蛋白浓度为2 mg/mL;叶黄素溶于一定浓度乙醇溶液,然后将叶黄素乙醇溶液分别加入蛋白溶液中,至每100 mL蛋白溶液中含叶黄素2.0 mg,混合后继续在25℃下搅拌1.0 h;混匀溶液经旋转蒸发(温度55℃下)除去乙醇后迅速冷却,并调节溶液pH值至4.70,经高压均质处理(作用压力为85 MPa,循环3次)后再在4℃下静置过夜,最后冷冻干燥,就可以得到两种不同包埋材料的叶黄素纳米颗粒,分别为BSA-lutein和DBSA-lutein。未进行高压均质处理的BSA与lutein混合物以及DBSA与lutein混合物经干燥混合分别为Mix-BSA-lutein和Mix-DBSA-lutein。
1.3.5 纳米颗粒包封率的测定
根据Muhoza等[25]的方法,测定游离叶黄素的含量,稍作修改。分别准确量取0.5 mL的BSA-lutein和DBSA-lutein混合液,再加入2.0 mL正己烷,使它们充分混合后,将其离心(7 000 r/min,5 min),收集上层有机相,重复2次上述操作,将有机相合并,并在448 nm处测定其吸光值。配置不同浓度的叶黄素,按照上述方法制作标准曲线(y=0.822x+0.016,R2=0.99),以便计算游离叶黄素的含量。
总叶黄素的含量。参照Muhoza等[25]的方法测定,稍作调整。取0.5 mL叶黄素纳米颗粒,加入SDS调节终浓度为0.3 mol/L,充分振荡混合后,置于30℃孵育5 min,测定448 nm处的吸光值,以不同浓度叶黄素做标准曲线(y=28.89x-0.013,R2=0.99)计算纳米颗粒中叶黄素的总含量。
叶黄素纳米颗粒的包封率按照如下公式(1)进行计算:

1.3.6 纳米颗粒粒径的测定
采用动态激光光散射法(dynamic light scattering,DLS)测定叶黄素纳米颗粒的Zeta电位和粒径分布[26]。设定散射角为90°,折光指数1.33,测定温度25℃,保温3.0 min。将待测样品分别装入聚苯乙烯比色皿和电解池中测定平均粒径和Zeta电位。
1.3.7 扫描电子显微镜(scanning electronic microscope,SEM)
参考曹静等[27]的方法,稍作调整:将样品均匀黏附于扫描电镜的样品台上进行喷金。对薄片进行扫描拍照,参数电压为10 kV,放大倍数为100 000倍。
1.3.8 pH值对纳米颗粒稳定性的影响
用不同pH(2.00~7.00)的0.01 mol/L的磷酸盐缓冲溶液溶解样品(BSA-lutein或DBSA-lutein),25℃静置1.0 h,按1.3.4中的方法测定纳米颗粒粒径和Zeta电位。
1.3.9 DPPH自由基清除率的测定
DPPH自由基清除率的测定参考Alam等[28]的方法。
1.3.10 ABTS+自由基清除率的测定
ABTS+自由基清除率的测定参考Seeram等[29]的方法。
1.3.11 羟基自由基清除率的测定
羟基自由基清除率的测定参考杨云舒等[30]的方法。
1.3.12 还原力的测定
还原力的测定参考张泽生等[31]的方法。
1.3.13 噻唑兰(methylthiazolyldiphenyl-tetrazolium bromide,MTT)染色法
HepG2细胞于细胞培养瓶(25 cm2,康宁)中,置于37℃下、5% CO2和95%的相对湿度的培养箱中活化培养,期间需每两天换一次培养基,细胞长满培养瓶的90%时,取15代~30代细胞用于本研究。
根据Abbes等[32]的MTT法对叶黄素纳米颗粒样品(叶黄素浓度分别为 5、10、15、25、30 μg/mL)进行细胞毒性试验,得到细胞抗氧化试验的细胞安全浓度范围。
以叶黄素纯品为空白对照组,对数生长期的HepG2细胞接种于96孔板中,每孔接种100 μL;置于37℃、5% CO2、90%湿度的培养箱中培养24 h,细胞完全贴壁。移去培养基后,用PBS缓冲液(pH=7.2)清洗2遍,加入样品溶液,再于37℃下孵育24 h。移去培养基,加入 100 μL 的 MTT 溶液(5 μg/mL),再于 37℃培养箱中孵育2 h,除去上清液后,每孔再加入100 μL的DMSO溶剂,振荡10 min,并于490 nm下检测孔中的细胞OD值,按公式(2)计算HepG2细胞的存活率:

1.3.14 细胞抗氧化试验
细胞抗氧化试验参考Wolfe等[33]的方法,具体操作如下:选取对数期生长的HepG2细胞液(细胞密度为 6×104个/mL),黑边黑底 96 孔板中每孔加入 100 μL HepG2细胞液,培养24h后,弃上清液,用100μL的PBS缓冲液洗涤孔板;将样品溶液和DCFH-DA(25μmol/L)按照1∶1(体积比)添加100 μL至96孔板内,孵育1 h后弃上清液,用PBS缓冲液洗涤孔板2遍;每孔再加入 100 μL ABAP(600 μmol/L),立刻将 96 孔板放入酶标仪中,测定参数为37℃、发射波长535 nm、激发波长485 nm、每隔5 min读数一次,持续1 h。对照组为DCFH-DA和ABAP混合液,空白组为DCFH-DA溶液。样品空白组为BSA与DCFH和ABAP;DBSA与DCFH和ABAP。所得荧光读数扣除空白之后,按照公式(3)计算细胞抗氧化活性(cellular antioxidant activity,CAA)值,绘制荧光值-时间的曲线:
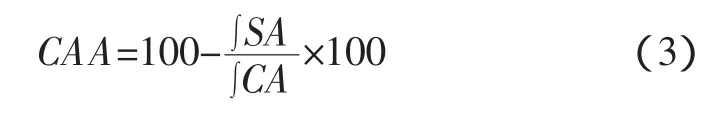
式中:∫SA和∫CA分别为样品和对照组荧光曲线的积分面积;EC50值(半数有效浓度)是由 log(fa/fu)对log(does)的中效曲线得出;其中fa和fu分别为受到样品影响和未受到样品影响的曲线面积;log(does)为样品浓度的对数,当log(fa/fu)=log 1=0时,所得浓度即为EC50。
1.3.15 数据统计与分析
使用96孔板进行的试验均设置6组平行,其余试验均重复3次,结果以均质±标准差表示,数据结果采用SPSS 17.0进行显著性分析,显著水平设定为p<0.05,并使用origin 8.0进行绘图。
2 结果与分析
2.1 叶黄素纳米颗粒分析结果
经过方法1.3.1制备的DBSA-lutein和BSA-lutein纳米颗粒冻干粉末如图2所示。

图2 蛋白-叶黄素纳米颗粒冻干粉末及其复溶溶液的照片Fig.2 Photos of BSA-lutein and DBSA-lutein nanoparticle solution
DBSA-lutein的冻干粉末的颜色比BSA-lutein的深;二者分别复溶后,DBSA-lutein的复溶液颜色也较BSA-lutein的复溶液深一点,一般蛋白和糖经过美拉德反应,颜色都会加深,同时发现二者在水中的溶解度明显提高,颜色清澈无悬浮物。溶液放置一周后,BSA-lutein溶液底部出现沉淀,是由于BSA-lutein纳米颗粒会发生聚集而产生沉淀,而DBSA-lutein溶液仍能保持均匀,说明DBSA-lutein提高了叶黄素纳米乳液的稳定性,通常牛血清白蛋白等蛋白质经美拉德反应后,可以与葡聚糖等非离子型多糖形成“蛋白-多糖”接枝物,此“蛋白-多糖”接枝物所形成的纳米颗粒的稳定性能有效提高,糖基化蛋白中蛋白部分通过疏水相互作用与所包埋的疏水性分子进行有效吸附,而葡聚糖可以为纳米颗粒提供较强的空间位阻,进而稳定“蛋白-多糖-疏水性功能分子”纳米颗粒[34]。BSADextran共聚物的电泳图见图3。

图3 牛血清白蛋白-葡聚糖接枝产物的SDS-PAGE图片Fig.3 SDS-PAGE image of BSA-Dextran
如图3所示,随着美拉德反应时间增加,牛血清白蛋白V的条带逐渐变浅,同时电泳胶的上端出现较明显的蛋白条带,且条带越来越深,表明有较大分子量的蛋白生成,且反应时间的提高,更多的BSA参与了和Dextran反应生成共聚物,且形成的共聚物分子量也不断增加。通过傅里叶变换红外光谱法进一步分析BSA与Dextran是否发生了接枝聚合反应,通常当分子中有-OH基团的引入,其红外光谱上在3 700 cm-1~3200cm-1波数范围内的伸缩振动会变宽[35];另外当Dextran分子接枝到BSA分子上后会引起N-H键的伸缩振动[36],其红外光谱图上表现为3 311 cm-1处(酰胺A带N-H的伸缩振动)和3050 cm-1处(酰胺B带N-H的伸缩振动)吸收峰增强[37];同时葡聚糖接枝到蛋白上也引入了新的C-O键,红外光谱图上表现为1 000 cm-1处出现新吸收峰,即C-O键的吸收峰[38]。应该是BSA和Dextran反应生成了糖蛋白,如图4所示。

图4 样品傅里叶变换红外光谱图Fig.4 FT-IR diagram of samples
表1对比了两种叶黄素纳米颗粒(BSA-lutein和DBSA-lutein)的包封率、平均粒径、聚合物分散性指数以及纳米颗粒的Zeta电位。

表1 两种叶黄素纳米颗粒的特征指标对比Table 1 Characteristic index comparison of two kinds of encapsulation particles loaded lutein
包封率(encapsulation efficiency)是纳米乳液稳定性的重要指标之一,通常是指被包裹亲油性分子(如类胡萝卜素物质)在脂质体悬液中占所有亲油性分子物质的百分比[39];另外,平均粒径、大小分布以及ζ-电位也都是纳米乳液的重要指标,平均粒径小的纳米颗粒的热稳定性高,且在水中的分散性能好[40],聚合物分散性指数差异性较小说明所形成的乳液滴大小之间的差别不大,形成的乳液体系性能好,不会发生部分絮凝,此外一般形成的乳液滴的ζ-电位≥30 mV,乳液的稳定性能很好,能够有效防止乳液滴的聚集,降低乳液滴的絮凝[41]。如表1所示,DBSA对叶黄素的包封率为(95.86±0.83)%,高于BSA对叶黄素的包封率(77.82±1.58)%;DBSA-lutein和 BSA-lutein的平均粒径分别为(176.8±6.5)nm 和(166.7±8.6)nm;另外 DBSA-lutein与BSA-lutein的聚合物分散性指数分别为0.176±0.07 和 0.276±0.05,均小于 0.3,同时说明分散体系稳定性良好。产生这种现象可能的原因是:接枝后的蛋白分子量更大,使其粒径较大,增加了载体疏水内核的大小,提高了DBSA对叶黄素的包封率,DBSA-lutein的ζ-电位的绝对值也高于BSA-lutein,这也进一步说明DBSA-lutein比BSA-lutein的稳定性更好。两种叶黄素纳米颗粒样品的扫描电镜图如图5所示。

图5 叶黄素纳米颗粒的扫描电镜图Fig.5 SEM images of encapsulation particles
从图5中可知,BSA-lutein及DBSA-lutein纳米颗粒的形态均为球形。根据标尺可以估算出这两种纳米颗粒的粒径也相似,约为200 nm。
2.2 叶黄素纳米颗粒的pH值稳定性
乳液的pH值对纳米颗粒粒径以及ζ-电位的影响可以判断其对纳米颗粒稳定性的影响。不同pH值条件下两种叶黄素纳米颗粒稳定性的变化如图6所示。

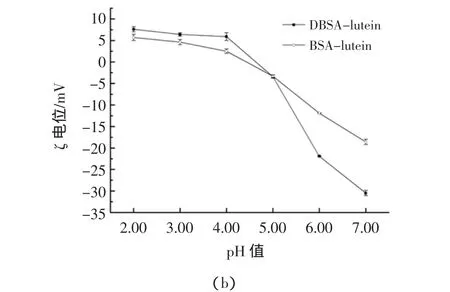
图6 pH值对两种叶黄素纳米颗粒平均粒径与ζ-电位的影响Fig.6 Effects of pH on the Z-average diameter and Zeta potentialof protein-lutein nanoparticels
由图 6(a)可得:在 BSA 蛋白的等电点(pH 4.00~5.00)附近,二者的粒径均达到了最小值,而当pH值变小或变大时,粒径均会有一定的增大,但仍在200 nm以下;在pH值相同的情况下,DBSA-lutein的粒径较BSA-lutein而言略大,这与糖蛋白载体大小相关。
通常较高的表面电荷使得纳米颗粒间具有较强的相互斥力,进而使得纳米颗粒在溶液中的溶解稳定性较高[42]。由图 6(b)可知:BSA-lutein 在 pH2.00~pH7.00范内其ζ-电位的绝对值均小于20.0 mV,说明在BSA-lutein纳米颗粒在此pH值范围内,稳定性较差,这与之前复溶的BSA-lutein在一段时间后会有沉淀产生的结果一致;而对于DBSA-lutein纳米颗粒而言,在pH 2.00~pH5.00范围,其ζ-电位的绝对值小于20.0 mV,而在pH6.00和pH7.00时,其ζ-电位的绝对值分别是大于20.0 mV和30.0mV,DBSA-lutein纳米颗粒的溶解稳定性较好。
2.3 体外抗氧化性能
以维生素E(Trolox)为标品,测定其不同浓度(0.02、0.04、0.06、0.08、0.1 mg/mL)下的抗氧化能力,并绘制出标准曲线。4种化学抗氧化法(即DPPH自由基清除率、ABTS+自由基清除率、羟基自由基清除率、还原力)的标准曲线分别为:y1=631x+3.972,R2=0.991;y2=718.2x-2.163,R2=0.996;y3=477.5x+25.55,R2=0.991;y4=3.958x+0.046,R2=0.992。以维生素E当量(mg/mg)表示各样品之间的抗氧化性能,其结果如表2所示。
表2 叶黄素及其纳米颗粒体外抗氧化性的比较Table 2 Antioxidant activity in vitro of lutein and nanoparticles
由表2可知,与lutein相比,BSA-lutein纳米颗粒清除DPPH自由基的能力提高了0.7倍,清除ABTS+自由基的能力提高了2.2倍,清除羟基自由基的能力提高了0.2倍,还原力提升了0.3倍;而DBSA-lutein相应的抗氧化能力则分别提升了1.6倍、2.5倍、1.2倍和0.5倍。表明叶黄素的抗氧化性能在经过蛋白质包埋后有了提升,但经糖蛋白包埋后的提升效果更加明显。Chen Tan等[43]研究得到经糖蛋白包埋姜黄素后的抗氧化活性明显提高,邓楚君[44]利用葡聚糖-乳铁蛋白复合物包埋姜黄素后,这些试验都得出了相类似的结果。可能的原因是DBSA、BSA、葡聚糖-乳铁蛋白复合物以及其他的糖蛋白等微颗粒或纳米颗粒的包材可以有效提高叶黄素等被包埋物质的水溶性,而DPPH自由基清除率、ABTS+自由基清除率和羟基自由基清除率的测定以及还原力的测定,这些反应都是在水溶液的环境中进行的,因此经过包埋后疏水性物质的相应能力会有显著提高。
lutein清除自由基的能力当量均大于1,效果高于维生素E,而还原力当量为0.962,与维生素E效果相近;Mix-BSA-lutein及Mix-DBSA-lutein的抗氧化能力较叶黄素强,这是由于牛血清白蛋白自身具有一定的抗氧化性能,但是只有在清除人工合成的自由基时,二者与叶黄素的差异性显著,而清除羟基自由基和还原能力与叶黄素相比差异不显著,可见蛋白与叶黄素单纯混合对抗氧化能力的影响并没有明显的变化;BSA-lutein和DBSA-lutein纳米颗粒的抗氧化性能高于混合物及叶黄素,且差异显著,说明纳米颗粒的形成能够很好地增加叶黄素的抗氧化性能;DBSA-lutein比BSA-lutein的抗氧化能力强,在清除自由基方面差异显著,而还原力差异不显著,说明经接枝改性后与叶黄素形成的纳米颗粒能够进一步提高叶黄素清除自由基的能力。
2.4 细胞抗氧化性
2.4.1 细胞存活率
据资料[45]显示,难以被细胞吸收的化合物有以下特征:分子量>500,拥有5个及以上氢键供体,10个及以上氢键受体,而叶黄素正是这类化合物之一,其由于自身的结构而导致化学性质极其不稳定,这些都限制了叶黄素在生活中的应用。而通过纳米颗粒包埋技术可以有效提高叶黄素在消化道内的稳定性和被细胞吸收的能力,从而改善叶黄素的功能特性。细胞毒性试验的结果如图7所示。
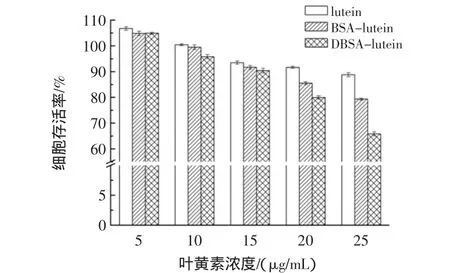
图7 不同样品对HepG2细胞的抑制作用Fig.7 Inhibition effects of different samples(lutein,BSA-lutein and DBSA-lutein)on HepG2 cells
样品对HepG2细胞有一定的抑制作用,经过包埋后,随着叶黄素浓度的增加,抑制作用越明显。当叶黄素浓度低于15 μg/mL,不同样品作用下HepG2的存活率均高于90%,即对HepG2无产生明显的毒性,故在之后的细胞抗氧化试验中,试验样品中叶黄素的浓度梯度设置上限不高于15 μg/mL。
2.4.2 细胞抗氧化试验
不同样品的细胞抗氧化性能检测的试验结果如图8所示。
随着叶黄素浓度的升高,样品的CAA值都有不同程度的提高,说明叶黄素及纳米颗粒都能够进入到细胞内并发挥其抗氧化活性的作用;此外,同一浓度条件下,3种样品的CAA值由大到小依次为DBSA-lutein、BSA-lutein、lutein,表明包埋后的叶黄素纳米颗粒确实可以提高叶黄素的细胞抗氧化活性。
以 log(does)值为 x 轴,样品不同浓度下 log(fa/fu)值为y轴,得到不同样品的中效曲线方程为lutein(y=1.391x-1.561,R2=0.993),BSA-lutein(y=1.585x-1.438,R2=0.989),DBSA-lutein(y=1.479x-1.076,R2=0.980)。当log(fa/fu)=0(即 y=0)时,得到各样品 EC50值分别为13.250、8.077、5.340 μg/mL,EC50值越低,表明样品的抗氧化活性越好,由此可知DBSA-lutein的抗氧化活性比BSA-lutein提高了0.5倍,比lutein提高了1.5倍。

图8 不同样品的细胞抗氧化活性CAA值变化Fig.8 Changes of CAA values of cellular antioxidant activitiy in differents samples(lutein,BSA-lutein and DBSA-lutein)
3 结论
高压均质法所制备的BSA-lutein和DBSA-lutein纳米颗粒,二者粒径分别为(166.7±8.6)nm(PDI=0.276±0.05)和(176.8±6.5)nm(PDI=0.176±0.07),pH 值会影响纳米颗粒的粒径和Zeta电位,pH=4.00~5.00时,粒径最小,其中pH=7.00时,纳米颗粒最稳定,DBSA-lutein粒径较大、包封率>95%,叶黄素纳米颗粒也更加稳定;与lutein相比,BSA-lutein和DBSA-lutein纳米颗粒清除DPPH自由基能力分别提高了0.7倍和1.6倍,清除ABTS+自由基的能力分别提高了2.2倍和2.5倍,清除羟基自由基的能力分别提高了0.2倍和1.2倍,还原力分别提升了0.3倍和0.5倍;DBSA-lutein纳米颗粒与BSA-lutein纳米颗粒相比,除还原力差异不显著外,其他3种体外抗氧化试验均存在显著差异。DBSA-lutein具有更好的细胞内抗氧化活性。
