微生物多糖与Fe离子螯合试验研究
2020-10-14刁欢张娟娟赵红贺真真
刁欢,张娟娟,赵红,贺真真
(安徽新华学院药学院,安徽合肥230088)
铁是人体的必需营养素,是非常容易引起代谢紊乱的元素。铁主要在人体内携带和输送O2和CO2;可以增强免疫功能;可以保持正常造血功能以及参与人体新陈代谢等[1-2]。缺铁会引起各种疾病,如缺铁性贫血(iron deficiency anemia,IDA),同时还会引起免疫力、抵抗力低下等问题。我国IDA的发生率比较高,是我国重要的公共营养卫生问题,严重影响人类的健康,儿童和孕妇缺铁现象相对更加严重。IDA增加了妊娠高血压的发生率,还可对儿童的大脑发育造成不可逆的损伤[3]。一般可通过口服补铁,静脉注射铁或联合营养干预来治疗IDA,临床上取得了显著效果,但在患者依从性、效率和不良反应方面仍存在显著差异。因此,现有的补铁剂还需要加以优化,并需开发出副作用少、利用率高、且能被人体快速吸收和利用的口服新型补铁剂。
当前国内外大多探究的是一类以多糖为载体、螯合Fe3+后形成的配合物,以Fe3+为中心的多糖铁现已成为一种新型的口服补铁剂。在1990年之后,右旋糖酐铁在美国普遍用于医治IDA,其对肠道无刺激,之后以Fe3+为中心、含多羟基的多糖类为配体的多糖铁复合物成为新研究热点。近年来,很多学者用中药或食品所含多糖合成多糖铁复合物,如大枣、玉米、茶叶、人参、二色补血草多糖铁等[4-6]。多糖铁具有较强的还原性,是一种新型的铁补充剂[7]。多糖铁配合物以非游离形态出现,不但可以避免胃肠道损伤,还可以在体内还原成Fe2+被吸收利用。多糖铁配合物和传统的补铁剂相比较而言,前者容易被人体摄取,具有较强络合Fe3+能力,对胃肠道的不良反应较弱,况且当Fe3+释放之后,配体多糖增强人体免疫能力,对细胞无损害,可以完全摄取。多糖铁可以分子方式存在于人体中,并具备水溶性、没有肠道刺激性、无毒性等优势。
克雷伯氏菌(Klebsiella sp.)的胞外多糖是一种非常好的免疫调节剂,具备高质量、不良反应少等特征[8]。此类菌的大多数胞外多糖具备絮凝活性和重金属的吸附能力。Sugihara等利用K.oxytoca TMN3发酵提取胞外多糖,并对此进行免疫活性的研究,结果显示该多糖对小鼠关节炎有免疫效果[9]。多糖与铁元素二者结合在一起,有望成为有一种新型补铁剂,满足人们的需要。
当前尚未发现微生物胞外多糖和铁螯合的有关研究报道,本论文通过研究制备微生物胞外多糖铁的最佳工艺,为进一步开发其螯合物提供重要依据,并为利用微生物胞外多糖铁配合物开发临床补铁剂类药物提供科学依据。本文拟通过研究克雷伯氏菌胞外多糖铁的制备工艺,实现其与铁的有效螯合,并获得有望成为新型铁补充剂的多糖铁。
1 材料与方法
1.1 材料与仪器
菌种:克雷伯氏菌种由安徽农业大学生物科技楼613实验室,从白酒厂活性污泥中筛选而来。
种子培养基(nutrient broth medium,NB):牛肉膏5 g、NaCl 5 g、蛋白胨 10 g,加 H2O 1 000 mL,自然 pH值。
发酵培养基:葡萄糖20 g、酵母膏0.5 g、K2HPO45.0 g、KH2PO42.0 g、MgSO40.2 g、NaCl 0.1 g、硫酸铵0.1 g、尿素 0.5 g、水 1 000 mL。
ZHP-100型振荡培育箱:常州诺基仪器有限公司;UV1000型单光束紫外/可见分光光度计:上海天美科学仪器有限公司;DHG-9101.3A型电热恒温鼓风干燥箱:上海三发科学仪器有限公司;FA2004N型电子天平:上海箐海仪器有限公司;XFS-280型手提式压力蒸汽灭菌器:浙江新丰医疗器械有限公司;SW-CJ-1D型单人净化工作台:苏州净化设备有限公司;HH数显恒温水浴锅:常州国宇仪器制造有限公司;离心机:苏州玖世器械有限公司。
1.2 方法
1.2.1 克雷伯氏菌胞外多糖的提取
克雷伯氏菌胞外多糖粗提步骤:发酵培养液→离心、去菌体细胞→无水乙醇添加倍量→4℃沉淀过夜放置→离心,取沉淀→再溶解→Sevage去蛋白→透析后再旋转蒸发浓缩、冷冻真空干燥→初步获得微生物絮凝剂的粗品。
克雷伯氏菌株按照1%接种量,接种到发酵培养基,30℃、150 r/min、培养48 h,制备细菌发酵液。取发酵液50 mL经3 000 r/min离心15 min,将上清液置于三角瓶中,然后按照上述方法进行胞外多糖提取,获得多糖粗品[10]。
1.2.2 克雷伯氏菌胞外多糖的纯化
利用Sevage试剂法去除克雷伯氏菌胞外多糖粗品中蛋白质成分,经透析法去除盐、有机溶剂和部分生物小分子杂质,再利用凝胶层析法进行深度纯化。葡萄糖凝胶为Sephadex G-200,层析柱规格为40 cm×2.5 cm。
1.2.3 克雷伯氏菌多糖铁螯合物的制备
称取克雷伯氏菌胞外多糖纯品,按照一定质量比加入柠檬酸三钠,用10 mL蒸馏水溶解,再加入足够0.1 mol/L的FeCl3,调节pH值在7~8之间,可以看到有红棕色沉淀的生成,当反应中产生的沉淀不再溶解时,停止添加FeCl3溶液,此时说明已反应完全;之后70℃水浴1 h,并不停搅拌;再4 000 r/min离心5 min,取上清液,加3倍95%乙醇,再离心;沉淀分别用无水乙醇、95%乙醇和无水乙醚3种有机溶剂洗涤,之后再真空干燥,制得粗品[11]。
1.2.4 铁标准曲线的制作
采用邻菲罗啉比色法[12],取8个50 mL容量瓶,按顺序准确加入 0、4.0、6.0、8.0、12.0、14.0、18.0、20.0 mL的铁标准溶液。再分别加入10%的乙酸钠溶液8 mL、10%的盐酸羟胺溶液1 mL以及0.1%的邻菲罗啉溶液10 mL进行反应,蒸馏水定容后摇匀,静置15 min,测510 nm处吸光度值,并作出回归方程。
1.2.5 样品中铁含量的测定
称量一定的干燥多糖铁配合物溶于蒸馏水中,50 mL容量瓶定容,即制得待测胞外多糖铁溶液。
取多糖铁溶液1 mL放入50 mL容量瓶,分别加入10%的盐酸羟胺溶液2 mL和10%的盐酸溶液1 mL,常温(25℃左右)下反应1 h,然后按顺序加入10%的乙酸钠溶液10 mL和0.15%的邻二氨菲溶液4 mL,计算铁的含量,方法同 1.2.4[11,13]。
1.2.6 螯合试验的单因素考察
在微生物胞外多糖铁螯合的试验研究过程中发现,螯合物中铁含量受多糖和柠檬酸三钠加入量的比例、螯合时间、螯合温度及溶液pH值影响较大,所以对这些影响因素再进行具体的单因素考察,最后得到最佳制备工艺范围。
胞外多糖与柠檬酸三钠的质量比:柠檬酸三钠作为催化剂对多糖铁的螯合作用有一定的影响。设置不同质量比 2∶1、3 ∶1、4 ∶1、5 ∶1、6 ∶1进行探究。螯合时间:设置 0.5、1、1.5、2、2.5 h 5 个不同时间进行探究。螯合温度:设置 40、50、60、70、80℃ 5个不同的螯合温度进行探究。溶液pH值:在5个不同pH值6、7、8、9、10的条件下进行探究。根据上述的初步试验进行多糖铁的螯合,最后通过邻菲罗啉法测定样品中的铁含量。
1.2.7 正交试验及其验证
按照1.2.3的试验方法进行螯合,测定各组样品的铁含量,并经过正交数据分析获得最佳制备工艺条件,因素水平表见1。

表1 L9(34)正交试验因素水平表Table 1 L9(34)horizontal table of factors in orthogonal test
2 结果与分析
2.1 铁标准曲线的绘制
铁的标准曲线见图1。

图1 铁的标准曲线Fig.1 Standard curve of iron
根据铁标准曲线可以得到回归方程:y=0.003 9x+0.005 2,相关系数R2=0.996 7。由图1可知,铁浓度在0 μg/mL~200 μg/mL 范围内,线性关系良好。
2.2 单因素考察
2.2.1 胞外多糖与柠檬酸三钠的质量比对铁含量的影响
胞外多糖与柠檬酸三钠按质量比分别为2∶1、3∶1、4 ∶1、5∶1、6∶1,在 pH 值为 8、70℃条件下水浴 1h,并根据上述步骤进行螯合,得出结果见图2。
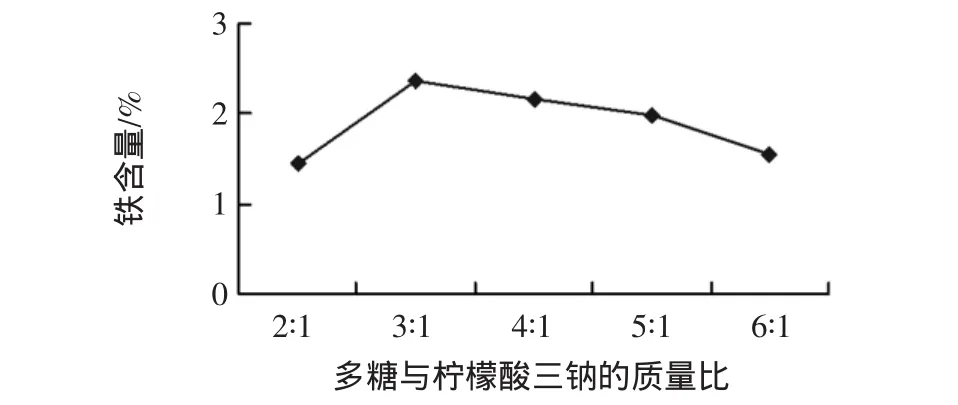
图2 胞外多糖与柠檬酸三钠的质量比对产品中铁含量的影响Fig.2 Effect of the mass ratio of polysaccharide to trisodium citrate on iron content in products
由图2可知,克雷伯氏菌胞外多糖与柠檬酸三钠的质量比因素影响大,当质量比小于3∶1时,不利于螯合反应的进行,当质量比大于4∶1时,其含铁量逐步减小,柠檬酸三钠在反应体系中作为催化剂,添加量过多过少,均会影响反应体系效率,故选择克雷伯氏菌胞外多糖与柠檬酸三钠的最佳质量比为3∶1。
2.2.2 螯合时间对产品中铁含量的影响
在最佳质量比3∶1的条件下,选择pH值为8、70 ℃的条件下水浴 0.5、1、1.5、2、2.5 h 进行螯合反应。结果见图3。

图3 螯合时间对产品中铁含量的影响Fig.3 Effect of chelating time on iron content in products
由图3可知,反应1 h时,铁含量达到最高,但随着时间的增加,铁含量迅速下降。因为当反应达到一定的时间,反应完全,继续反应,易使螯合物分离,得到的铁含量也降低。因此,最佳螯合时间选择为1 h。
2.2.3 螯合温度对产品中铁含量的影响
将胞外多糖和柠檬酸三钠以3∶1的质量比分别在 40、50、60、70、80 ℃、pH 值为 8 的条件下水浴 1 h,并根据初步试验进行螯合,结果见图4。
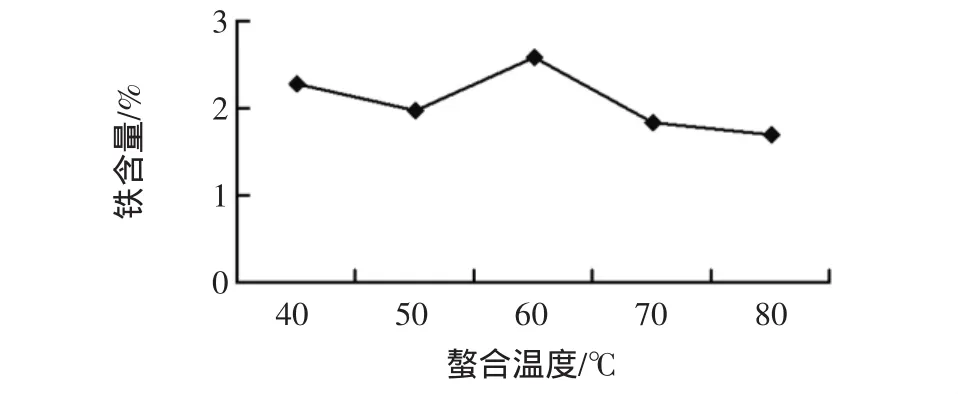
图4 螯合温度对产品中铁含量的影响Fig.4 Effect of chelating temperature on iron content in products
由图4可知,随着温度的升高,所得铁含量先降低后增加,当螯合温度为60℃时达到最大值,然后铁含量迅速降低,当反应温度过高时,离子振动比较强烈,不利于螯合反应的进行。反应温度过低,则很难进行螯合反应。因此最佳螯合温度为60℃。
2.2.4 溶液pH值对产品中铁含量的影响
按照胞外多糖与柠檬酸三钠的质量比3∶1,螯合温度 60 ℃,溶液 pH 值分别为 6、7、8、9、10,水浴 1 h,产品中铁含量的测定结果见图5。

图5 螯合pH值对产品中铁含量的影响Fig.5 Effect of chelating pH on iron content in products
当pH值高于7时,反应体系中离子强度过大,阻碍反应的进行。当pH值较低时,则反应氢离子浓度增大,导致螯合反应不完全。当反应液pH值为7时,所得含铁量最高,为最佳螯合pH值。
2.3 正交试验
L9(34)正交试验结果见表2。

表2 L9(34)正交试验结果Table 2 L9(34)Orthogonal test results

续表2L9(34)正交试验结果Continue table 2L9(34)Orthogonal test results
从表2可以得到:极差值R可以看出影响克雷伯氏菌胞外多糖与三价铁螯合效果从大到小依次为D>C>B>A,即克雷伯氏菌胞外多糖与柠檬酸三钠的质量比>螯合时间>螯合温度>溶液pH值,最佳的试验组合为A2B2C1D2,即克雷伯氏菌胞外多糖与柠檬酸三钠的质量比为3∶1,反应时间为0.5 h,温度为60℃,溶液pH值为7。经验证在这种条件下,所得螯合物的含铁量最高为2.88%,大于正交试验第2组(A1B2C2D2)的结果。
3 结论
通过单因素和正交试验发现,影响克雷伯氏菌胞外多糖与三价铁螯合效果从大到小依次为D>C>B>A,得出最佳螯合试验组合为A2B2C1D2,即克雷伯氏菌胞外多糖与柠檬酸三钠的质量比为3∶1,螯合反应时间为0.5 h,温度为60℃,溶液pH值为7。经验证,在此条件下所得的含铁量最高为2.88%。
本研究制得的多糖铁中铁含量最高为2.88%,与植物多糖铁的含量有一定差距。当归多糖鳌合铁的能力差异较大,试验通过高价铁盐的鉴别反应,得出铁含量可达10%~40%[14];党参多糖也可在碱性条件下合成党参多糖铁,且含铁量可达19.9%[15];在pH 4.1~12.6的条件下,茯苓多糖与铁易鳌合,且鳌合铁的铁含量达6.33%[16]。黄芪多糖与铁螯合力较强,形成的复合物中铁含量可达到20.45%[17]。灰树花多糖在50℃,螯合0.5 h,且溶液pH值为8时,可制得灰树花多糖铁的螯合物,铁含量最高为3.08%[11]。天麻多糖铁经响应面法优化制备工艺后,螯合物中铁含量为33.48%[18]。不同多糖原料螯合铁后得到的螯合物中铁元素含量差异较大[19-20]。本研究中微生物胞外多糖与铁离子可能未充分螯合,也可能是由于胞外多糖提纯程度不足等导致螯合率不高。但本研究开拓了一个新的螯合领域,克雷伯氏菌胞外多糖螯合铁有望成为一种新的补铁剂,但其结构分析和安全性验证试验还需要进一步研究。
