臭氧化0.9%氯化钠溶液瘤内注射对兔VX2 肿瘤低氧诱导因子-1α、 血管内皮细胞生长因子表达及微血管密度形成的影响
2020-10-14王凌霄杨朝爱杨继金
罗 荣, 王凌霄, 刘 航, 杨朝爱, 江 旭, 杨继金
臭 氧 又 称“活 性 氧”,Sweet 等[1]1980 年 研 究 发现它在一定浓度范围内可选择性抑制肿瘤细胞生长,对正常细胞无影响或影响轻微。 研究表明臭氧具有极强的氧化性,可改善肿瘤缺氧状态,其效果与肿瘤内基础氧分压呈负相关,肿瘤内氧分压低于5 mmHg(1 mmHg=0.133 kPa)时效果最佳[2-3]。 魏强等[4]在瘤内注射臭氧致瘤组织超微结构改变的实验中发现,一定浓度臭氧可对肿瘤细胞及瘤内血管内皮细胞造成损伤。 然而目前关于臭氧治疗肿瘤时对肿瘤内低氧诱导因子(HIF)-1α、血管内皮细胞生长因子(VEGF)及微血管密度(MVD)影响的研究报道较少。本研究对此进行探讨,现将实验结果报道如下。
1 材料与方法
1.1 实验动物
雄性新西兰大白兔90 只,体重2~2.5 kg,由海军军医大学海军医学研究所提供,动物合格证编号SCXK(沪)20150005;饲养条件为单笼单兔,自由摄食,室内温度(22±2)℃,湿度(70±5)%,每天12 h(7∶00~19∶00)光照。
1.2 兔VX2 肿瘤模型制备
兔适应性饲养3~5 d 后种植VX2 肿瘤:VX2瘤株来自第二军医大学附属长海医院核医学科传代瘤兔,自传代瘤兔左后腿取出后于0.9%氯化钠溶液中洗涤2~3 次,去除表面血渍,无菌手术刀切开瘤块,去除中心坏死部分,取边缘鱼肉样组织作为活性肿瘤组织, 无菌眼科剪将活性肿瘤组织剪碎,大小约为1 mm3,备用;用3%戊硫代巴比妥钠(0.8~1 mL/kg)沿兔耳缘静脉缓慢注入进行麻醉,兔仰卧位固定于专用手术台上,于左后腿内侧肌肉处备皮、消毒、铺巾后,用无齿镊提起皮肤、剪一长约5 mm 小口,钝性逐层分离皮下筋膜,暴露皮下肌肉组织, 再用无齿镊提起肌肉, 剪一长约5 mm 小口,将备用瘤块置入肌肉伤口内,缝合肌肉和皮肤后消毒并放入笼中饲养。 10~12 d 后,超声检测肿瘤大小,肿瘤长径长至1~1.5 cm 时进行实验。
1.3 臭氧化0.9%氯化钠溶液制备
实验前24 h 将所需0.9%氯化钠溶液(无菌透明玻璃瓶储存,剂量30 mL)置于4℃冰箱保存,实验开始前0.5 h 制作臭氧化0.9%氯化钠溶液时取出;将臭氧发生器输出浓度调至20 μg/mL,臭氧气体输出速率为3 L/min,通过输液管道通入备用0.9%氯化钠溶液中,持续时间为20 min。 制作至实验结束过程中玻璃瓶周围仍放置多个冰袋维持其低温状态,制作完成后用臭氧浓度测定试剂盒检测水中臭氧浓度。本实验所用臭氧化0.9%氯化钠溶液中臭氧浓度为0.25~0.5 mg/L。
1.4 动物分组与处理方法
选择符合条件的瘤兔72 只,随机均分为4 组(A、B、C、D 组),各18 只。 按上述方法麻醉后,聚维酮碘消毒肿瘤部位,超声检测肿瘤大小,记录肿瘤最大切面长径(a)和相垂直的短径(b),按公式V=1/2ab2计算肿瘤体积。超声导引下,A 组注射2 倍肿瘤体积的0.9%氯化钠溶液1 次、B 组注射2 倍肿瘤体积的臭氧化0.9%氯化钠溶液1 次、C 组注射2 倍肿瘤体积的臭氧化0.9%氯化钠溶液连续2 次(1 次/d, 连续2 d)、D 组注射2 倍肿瘤体积的臭氧化0.9%氯化钠溶液连续3 次(1 次/d,连续3 d),缓慢推注,避免肿瘤内压力过大胀破肿瘤包膜,同时禁忌反复穿刺肿瘤,以免发生针道种植转移。 注射完成后观察1 h,如无异常,放入笼中继续饲养。 术后第4、8、12 天, 各组随机选取6 只兔经耳缘静脉注射空气15~20 mL 处死, 切取肿瘤浸泡于4%甲醛溶液。
1.5 瘤组织内HIF-1α、VEGF 和MVD 检测
采用免疫组化法检测肿瘤内CD31 标记的MVD 及HIF-1α、VEGF 表达: 免疫组化染色完成后,将每张切片于高倍镜(×200)视野下选取染色最为集中处拍照并将图像输入Image-Pro Plus 6.0 生物医学影像分析系统进行染色强度即累积吸光度(IOD)检测,记录单位面积IOD 值;4%甲醛固定肿瘤标本冲洗干净,脱水、包埋、切片(厚3 μm)、烤片、脱蜡、水化,pH6.0 柠檬酸盐缓冲液加入染色盒,放入缓冲液高温高压处理10 min,染色盒于室温下自然冷却,蒸馏水冲洗2 次后磷酸缓冲液(PBS)洗3 min×3 次,3%H2O2室温孵育10 min,PBS 洗3 min×3 次, 加入100 μL 血清封闭液, 室温孵育10 min,PBS 洗3 min×3 次,加入一抗(美国Novus 生物制品公司),孵育过夜,PBS 洗3 min×3 次,加入一抗增强剂,室温孵育30 min 后PBS 洗3 min×3 次,滴加即用型二抗,室温避光孵育30 min,PBS 洗3 min×3 次,以二氨基联苯胺(DAB)显色,蒸馏水冲洗、复染、脱水、封片。
1.6 统计学方法
采用SSPS 21.0 软件进行统计学分析。 计量资料以均数±标准差(x±s)表示,多组比较用方差分析,组间两两比较用LSD-t 检验。 P<0.05 为差异有统计学意义。
2 结果
各组不同时间点瘤组织内HIF-1α 表达比较见表1、图1。 术后第4、8 天B 组瘤组织内HIF-1α 表达低于A 组,术后第12 天略高于A 组,但差异均无统计学意义(P>0.05);术后C、D 组瘤组织内HIF-1α表达均高于A 组,C 组更明显, 第12 天C 组与A、B、D 组间差异均有统计学意义(P<0.05),余各组间于同一时间节点差异均有统计学意义(P<0.05)。
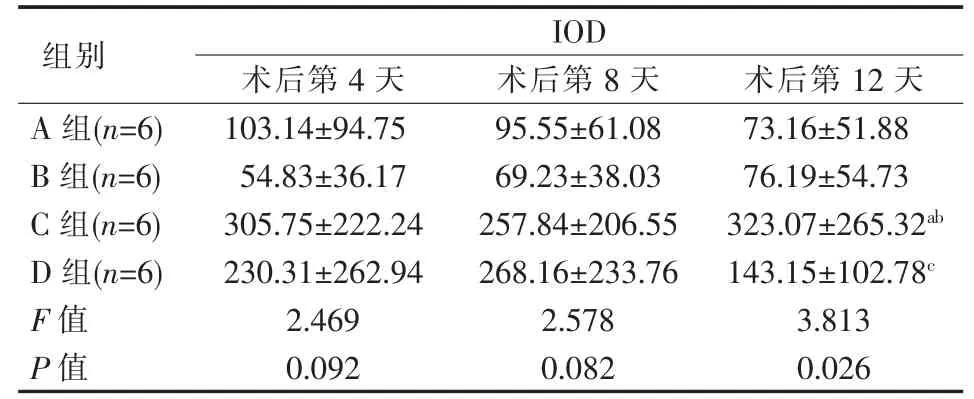
表1 各组不同时间点瘤组织内HIF-1α 表达比较 x±s
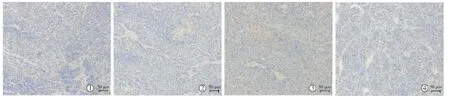
图1 各组第12 天肿瘤内HIF-1α 表达(目镜×物镜,10×20 倍)
各组不同时间点瘤组织内VEGF 表达比较见表2、 图2。 术后第4 天B 组、C 组瘤组织内VEGF表达稍低于A 组,其余时间节点及D 组瘤内VEGF表达均高于A 组, 且在第8 天C、D 组与A 组间差异均有统计学意义(P<0.05),余同一时间节点各组间差异均无统计学意义(P>0.05)。
各组不同时间点瘤组织内CD31 标记的MVD比较见表3。 与A 组相比,术后第4、8 天B 组瘤组织内MVD 形成减少,术后第12 天略增高,但差异均无统计学意义(P>0.05)。 C 组瘤组织内MVD 形成在各时间节点均高于A、B、D 组, 但差异均无统计学意义 (P>0.05); 术后第4 天D 组瘤组织内MVD 形成高于A 组, 第8 天和第12 天低于A 组,但差异均无统计学意义(P>0.05)。

表2 各组不同时间点瘤组织内VEGF 表达比较 x±s

表3 各组不同时间点瘤组织内CD31 标记的MVD 比较x±s
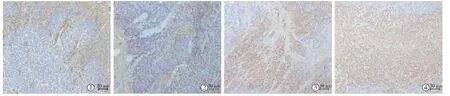
图2 各组第8 天肿瘤内VEGF 表达(目镜×物镜,10×20 倍)
3 讨论
缺氧是肿瘤组织的重要生物学特征之一。 肿瘤细胞快速分裂增殖导致大量肿瘤细胞远离血管,使得肿瘤细胞处于缺氧环境,长期缺氧将诱导肿瘤细胞产生HIF-1α[5]。 在正常氧饱和度情况下,HIF-1α在细胞质中被脯氨酸羟化酶灭活而处于失活状态,而在缺氧状态、氧化应激时,脯氨酸羟化酶被抑制,HIF-1α 不能被灭活而与HIF-1β 结合形成异源型二聚体并进入细胞核, 异源型二聚体与DNA 分子上缺氧反应元件结合, 从而调节某些基因,使VEGF、促红细胞生成素、糖酵解酶表达增多。 VEGF表达增多可促进血管形成,从而促进肿瘤细胞增殖和存活[6],使肿瘤发生远处转移的风险增加。 因此,改善肿瘤缺氧状态有可能促进HIF-1α 灭活,使VEGF 表达减少,肿瘤血管形成减少,从而改善肿瘤患者预后。
臭氧又称为“活性氧”,由3 个氧原子构成,在常温常压下是一种淡蓝色、有鱼腥臭味的刺激性气体,1840 年由德国科学家Schonbein 发现[7]。 它具有强氧化性, 其氧化性仅次于氟和羟基, 对细菌、病毒、真菌等病原微生物具有极强的杀灭作用,同时可改善局部血液循环,增加局部氧供[8]。早期研究表明, 肿瘤缺血缺氧将会增加其对放化疗的抵抗性,严重影响预后,因此减轻肿瘤缺氧对改善预后有重要作用[9-10]。 臭氧可改善肿瘤缺血缺氧状态,尤其是在肿瘤内氧分压低于5 mmHg 时效果最佳[2-3],使到达肿瘤局部的化疗药物或放疗增敏剂等增多,从而增强放化疗效果;且实验研究亦表明单一臭氧疗法或臭氧联合放化疗及光动力疗法可明显降低肿瘤细胞活性或抑制肿瘤生长[11-15]。
本研究结果显示,连续多次注射臭氧化0.9%氯化钠溶液可能导致肿瘤内HIF-1α、VEGF 表达增加,MVD 形成增多, 其原因可能为短时间内连续多次臭氧化0.9%氯化钠溶液瘤内注射加重肿瘤内已有氧化应激,从而抑制脯氨酸羟化酶活性,导致肿瘤内HIF-1α 灭活减少,VEGF 表达增多, 促进肿瘤微血管生成,促进肿瘤生长。 本实验疗效部分研究也发现,与单次臭氧化0.9%氯化钠溶液瘤内注射组相比,多次注射对肿瘤生长抑制效果较差(另文发表)。 已有研究表明,臭氧浓度过高或剂量过大可能会加重原已存在的氧化应激,而臭氧治疗用途主要是通过适度的氧化应激激发机体各种反应,如抗氧化还原反应、免疫反应等[16-17]。本研究结果还显示单次臭氧化0.9%氯化钠溶液瘤内注射,虽可使肿瘤组织内HIF-1α、VEGF 表达及MVD 形成呈下降趋势,但并无明显统计学意义;分析其原因可能为样本量不足或所用臭氧浓度/剂量过低,或为治疗剂量臭氧对肿瘤内HIF-1α、VEGF 表达及MVD 形成无明显影响。 然而Guclu 等[18]研究臭氧疗法治疗糖尿病性肾病对HIF-1α、 肿瘤坏死因子(TNF)-α 等表达的影响,发现50 μg/mL 臭氧可使病变组织内HIF-1α 表达下调。 Jin 等[19]研究臭氧对鼻咽癌放疗患者血清HIF-1α、VEGF 水平的影响,发现10~20 μg/mL 臭氧(100 mL)可下调血清中HIF-1α、VEGF 水平。因此,下一步拟通过增加样本量、改变臭氧浓度和剂量等方面研究臭氧对肿瘤内HIF-1α、VEGF 水平及MVD 形成的影响,以期更加全面地评估其对改善肿瘤乏氧的可能性。
综上所述,本研究认为臭氧化0.9%氯化钠溶液瘤内单次注射对肿瘤组织内HIF-1α、VEGF 表达及MVD 形成无明显影响, 但多次注射可能导致HIF-1α、VEGF 高表达,MVD 形成呈增加趋势。但确切机制还需进一步研究。
