Budd-Chiari 综合征患者介入开通术后再狭窄处理和远期随访结果
2020-10-14王巧争陈晓伟李启洋韩金行陈旭东
张 伟, 王巧争, 陈晓伟, 李启洋, 韩金行, 陈旭东, 徐 克
Budd-Chiari 综合征指肝静脉流出道(小肝静脉至下腔静脉入右心房口部)任意层面阻塞,但不包括因右心衰或缩窄性心包炎所致肝静脉流出道阻塞[1]。 该病在西方国家以单纯型肝静脉阻塞为主,发病率约为2/百万[2],我国估计为(7~39)/百万[3]。 我国患者流行病学特点、病因、病变阻塞部位等方面不同于西方国家,治疗方法和策略均与之不同[4]。 由于西方国家Budd-Chiari 综合征病因主要为肝静脉血栓形成, 有学者提出一种侵入性逐步升级的治疗策略,即从抗凝溶栓开始, 逐步升级至经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt,TIPS),最后至肝移植[5],而采用球囊扩张的经皮腔内血管成形术(percutaneous transluminal angioplasty,PTA)或/和支架植入的开通治疗应用较少。 我国Budd-Chiari 综合征常见类型为下腔静脉和肝静脉膜性狭窄或闭塞[6],因此介入开通成为主要治疗方法。 国内治疗研究结果显示,介入开通术后5 年、10年累积生存率分别为>80%、>70%, 5 年、10 年累积通畅率分别为>90%、>80%[7-9]。 然而对于介入开通术后再狭窄治疗及10 年以上生存和通畅情况目前鲜有报道。 本研究回顾性分析一组介入开通术后再狭窄Budd-Chiari 综合征患者, 旨在评估其远期(10 年以上)生存和通畅情况。
1 材料与方法
1.1 患者选择
收集中国医科大学附属第一医院1983 年11月至2013 年12 月间诊断为Budd-Chiari 综合征患者临床资料。 共410 例中63 位重复入院172 次,排除45 例(5 例继发性,25 例误诊,15 例资料不完整)。 余下患者中178 例接受了介入开通治疗,治疗成功165 例,其中60 例发生再狭窄,纳入本研究。
1.2 Budd-Chiari 综合征诊断与分型
本组患者经彩色多普勒超声(CDUS)、CT、MRI及静脉造影等检查中至少一种确诊。 根据阻塞部位,Budd-Chiari 综合征分为下腔静脉型(IVC 型)、肝静脉型(HV 型)和混合型(Com 型)[10]。 再狭窄指定期随访中患者症状再发, 并经影像学检查(CDUS、CT、MRI)证实开通道狭窄或阻塞。
1.3 再狭窄治疗策略
开通后再狭窄的常见原因包括血栓形成、膜性阻塞病变再生或节段性阻塞病变的弹性回缩。 对于血栓形成引起的再狭窄,如果是新鲜血栓,先予溶栓治疗, 溶栓后症状未缓解则行PTA 或/和支架植入(压住血栓贴壁);如果是陈旧性血栓,行支架植入。 对于非血栓性再狭窄, 无论初始治疗是单纯PTA 还是PTA+支架植入,均先行PTA,之后观察疗效,若症状明显缓解,继续随访观察,否则予以进一步治疗。 对于膜性病变引起的再狭窄,PTA 扩张从小球囊开始逐渐至大直径球囊。 对于节段性或长段再狭窄,则考虑支架植入。 本中心对于支架植入持谨慎态度,一般仅应用于PTA 疗效不佳或多次PTA后仍狭窄患者。 此外,一旦介入开通治疗无效,即考虑行TIPS。 所有患者术后均接受肝素治疗5~7 d,之后继续华法林抗凝治疗6~12 个月,期间定期复查凝血指标,调整国际标准化比值(INR)为2~3。
1.4 随访
患者出院后采用电话随访(患者本人或家属)或定期门诊随访,填写随访表,内容包括患者一般情况、症状有无复发、近期检查结果、用药情况等。随访截止日期为2014 年12 月31 日, 或患者死亡日期,或最后一次门诊复查日期(如果失访)。 如果随访期间患者症状再发,考虑再狭窄可能,经当地医院或本院门诊复查证实。
1.5 统计分析
所有数据统计分析均由SPSS 21.0 软件完成。 分类数据以绝对值和比例表示,比较用卡方检验或Fisher 确切检验。 连续数据以中位数和范围表示, 比较用独立样本t 检验或单因素方差分析。 累积生存率通过Kaplan-Meier 生存曲线评估,相互比较用log-rank 检验。 P<0.05 为差异有统计学意义。
2 结果
60 例原发性Budd-Chiari 综合征介入开通术后再狭窄患者中男40 例, 女20 例, 中位年龄39 岁(14~80 岁)。 根据患者初始开通治疗方式,分为单纯PTA 治疗组(40 例,其中Com 型27 例,IVC 型5例,HV 型8 例)、PTA+支架植入组(20 例,其中Com型13 例,IVC 型6 例,HV 型1 例)。 两组患者基线资料存有一定差异。
单纯PTA 治疗组出院1 年内、5 年内、10 年内发生再狭窄分别为15 例(37.5%)、34 例(85%)、38例(95%),初始通畅中位时间为19 个月(1~136 个月);PTA+支架植入组出院1 年内、5 年内、10 年内发生再狭窄分别为10 例(50%)、18 例(90%)、19 例(95%),初始通畅率中位时间为14.5 个月(0.5~196个月)。 单纯PTA 治疗组19 例再狭窄接受PTA 治疗,8 例PTA+支架植入,13 例拒绝进一步治疗;接受治疗的27 例中5 例随访中又发生第2 次再狭窄,2 例第3 次再狭窄,1 例第4 次再狭窄, 根据本研究治疗策略(图1)共给予27 次单纯PTA 治疗和8 次PTA+支架植入。 PTA+支架植入组10 例再狭窄接受PTA 治疗,1 例PTA+支架植入,9 例拒绝进一步治疗; 接受治疗的11 例中5 例随访中发生第2次再狭窄,3 例第3 次再狭窄,1 例第4 次再狭窄,根据本研究治疗策略共给予21 次单纯PTA 治疗和1 次PTA+支架植入。
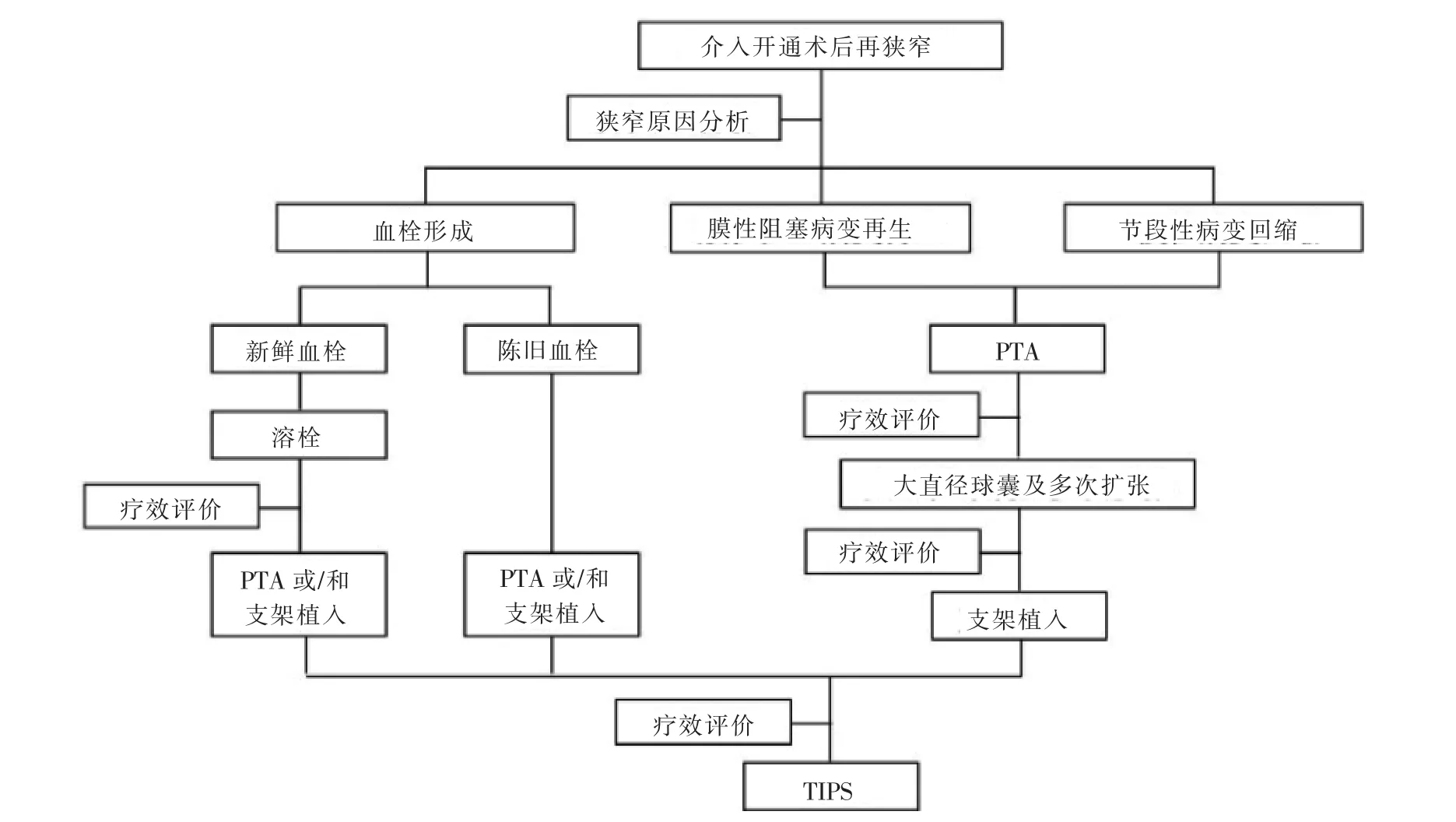
图1 介入开通术后再狭治疗策略流程图
单纯PTA 治疗组患者中位随访时间61.5 个月(1~313 个月),术后中位生存时间36 个月(1~123个月);13 例死亡(肝功能衰竭7 例,肝癌3 例,上消化道出血3 例)与Budd-Chiari 综合征相关,3 例死亡(高血压颅内出血、弥散性血管内凝血、交通事故各1 例)与Budd-Chiari 综合征无关,见表1。 PTA+支架植入组患者中位随访时间52.5 个月(2~276个月), 术后中位生存时间为30 个月(2~239 个月);10 例死亡(肝脏功能衰竭5 例,上消化道出血2 例,肝性脑病2 例,肝癌1 例),其中包括所有9 例拒绝进一步治疗患者,见表1。
两组患者介入开通治疗后总体1 年、5 年、10年、20 年、25 年累积生存率分别为89.8%、 66.2%、61.1%,、50.2%、50.2%(图2①); 单纯PTA 治疗组、PTA+支架植入组1 年、5 年、10 年、20 年、25 年累积生存率分别为94.9%、71.8%、63.8%、59.3%、59.3%(图2②),79.7%、55.5%、55.5%、48.6%、NA(未获得)(图2③);38 例再狭窄后接受进一步治疗患者1年、5 年、10 年、20 年、25 年累积生存率分别为分别为100%、78.3%、78.3%、70.5%、70.5%,22 例拒绝进一步治疗患者分别为72.7%、45.9%、30.6%、10.2%、NA(未获得),两部分患者间比较(两者基线资料无显著异质性), 差异有显著统计学意义(P<0.001)(图2④)。

表1 两组介入开通治疗后再狭窄患者治疗与随访结果 n(%)

图2 两组患者介入开通治疗后生存分析曲线图
3 讨论
本研究回顾性分析了一组60 例原发性Budd-Chiari 综合征介入开通术后再狭窄患者治疗与远期随访结果,最长随访时间超过300 个月(25 年)。 本研究所定义的再狭窄指介入开通(PTA 和/或支架植入)术后出现症状再发,并经影像学检查证实原开通道出现狭窄、 闭塞或肝静脉流出道出现新的狭窄、 闭塞。 有研究报道介入开通术后1 年、5 年、10年累积初始通畅率分别为87%、77%、58%[9]。 一项meta 分析报道显示,初始开通后1 年内再狭窄发生率为5.5%(4.3%~6.7%)[11]。 本组患者近50%再狭窄发生于术后第1 年[单纯PTA 治疗组为37.5%(15/40),PTA+支架植入组为50%(10/20)],提示开通术后1 年内是再狭窄高发时期,需要加强随访观察,并积极预防再狭窄发生。
本研究关注的重点是再狭窄患者治疗策略,主张定期随访,发生再狭窄后积极治疗。 采用侵入性逐步升级方式, 先从PTA 开始, 若多次PTA 无效(包括大直径球囊扩张)则采用支架植入,但支架植入一定要慎重。 支架在体内作为一种异物的长期影响目前仍不明确,且已有支架断裂移位、阻挡肝静脉口部的报道[12-13]。因此,治疗过程中何时需植入支架,需要综合权衡利弊,尤其是远期可能出现的问题值得关注。 本组60 例再狭窄患者中2 例出现4次再狭窄,其中1 例在单纯PTA 治疗组,经3 次球囊扩张后植入支架;另1 例在PTA+支架植入组,经2 次球囊扩张后再次植入支架。 对于反复出现再狭窄患者,首先要明确病因,寻找可能存在的诱因并予以治疗,在此基础上考虑支架植入。 同时还需要考虑,如果支架植入后仍发生再狭窄,或支架阻塞不能开通,由此导致窦后性门静脉高压(或伴有窦性门静脉高压、慢性淤血性肝硬化),那么TIPS 是否可行,前期植入的支架是否会对TIPS 手术造成影响[14]。 何时是转行TIPS 的最佳时机,有待于进一步研究。
肝功能衰竭、消化道出血和肝癌是本组患者死亡的主要原因。 肝功能衰竭主要是在慢性肝病基础上伴发急性肝功能衰竭(血栓形成),或是肝硬化缓慢进展逐渐发展至终末期肝病,肝脏功能无法代偿所致[15]。 消化道出血主要原因考虑是肝脏长期淤血不能缓解(同时可能伴有病毒性及乙醇性肝病)导致肝脏逐渐硬化,发展为窦性门静脉高压,由此引起突发致死性消化道大出血[16]。 肝癌是值得重点关注的死因,Budd-Chiari 综合征患者出现肝癌, 既往研究多认为IVC 型或Com 型患者多见,但也有HV型患者出现肝癌的报道,原因可能与肝脏血供方式改变、肝动脉供血比例增加有关[17-18]。
之前诸多研究显示再狭窄是影响生存的重要因素[8-9,19-20],本研究也得以证实。 本组再狭窄患者5年、10 年累积生存率分别为66.2%、61.1%, 低于Budd-Chiari 综合征患者5 年、10 年累积生存率(分别为80%、70%), 说明再狭窄患者远期预后不容乐观, 尤其是再狭窄后拒绝进一步治疗患者,20 年累积生存率仅为10%。 本组再狭窄后接受治疗患者总体生存率显著优于拒绝治疗患者,10 年、20 年生存率分别达到78%、70%,结果令人满意。 治疗组中接受单纯PTA 治疗患者生存率似乎优于PTA+支架植入患者,但支架植入患者一般基线情况较单纯PTA治疗患者严重,因此未直接比较,当然也不能否定支架的作用。 此外,再狭窄后拒绝治疗患者病程可间接模拟Budd-Chiari 综合征自然病程,1 年、5 年、10 年、20 年累积生存率分别约为70%、50%、30%、10%,目前随访未发现生存超过25 年患者。
本研究存在不足之处:作为回顾性研究,数据完整性存在缺陷, 有选择偏倚; 患者分组根据治疗方式,无法保证各组基线水平均衡,涉及组间可比性和结果可靠程度;患者样本量较小,未进一步亚组分析。期待进一步开展多中心大样本随机对照试验研究。
综上所述, 介入开通术后远期随访非常重要。积极治疗再狭窄可改善患者预后。 从球囊扩张开始逐步升级,根据疗效判断是否需要进一步增加侵入性操作,治疗后可获得令人满意的效果。
