HPLC同时测定紫丹参药材中8种成分含量
2020-10-14管小军厉君黄娜娜浦滇邓雪琪李凤仙李嘉新李俊
管小军,厉君,黄娜娜,浦滇,邓雪琪,李凤仙,李嘉新,李俊
HPLC同时测定紫丹参药材中8种成分含量
管小军1,厉君2,黄娜娜1,浦滇1,邓雪琪1,3,李凤仙1,李嘉新1,李俊1,3
1.云南中医药大学,云南 昆明 650500;2.云南楚雄天利药业有限公司,云南 楚雄 651208;3.云南省民族特色养生理论与健康产品工程实验室,云南 昆明 650500
建立同时测定紫丹参药材中丹参素钠、迷迭香酸、紫草酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA含量的方法,为紫丹参药材的质量评价提供参考。采用ACE Neptune-C18色谱柱(4.6 mm×250 mm,5 μm),以乙腈-0.1%磷酸水溶液为流动相梯度洗脱,流速1.0 mL/min,检测波长275 nm,柱温25 ℃,同时测定10批紫丹参药材中丹参素钠,迷迭香酸、紫草酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA的含量。丹参素钠、迷迭香酸、紫草酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA进样量分别在0.041 2~0.412 0、0.030 8~0.308 0、0.056 8~0.568 0、1.010 0~10.100 0、0.015 9~0.159 0、0.035 2~0.352 0、0.016 4~0.164 0、0.042 0~0.420 0 μg范围内与峰面积呈良好的线性关系(2为0.999 4~0.999 8),平均加样回收率为97.79%~102.33%(RSD<3%)。本研究建立的方法灵敏、准确、可靠、重复性好,可用于紫丹参药材的质量评价。
紫丹参;多成分同时测定;含量测定;高效液相色谱法
紫丹参始载于《滇南本草》,为唇形科植物云南鼠尾草C. H. Wrigh的干燥根和根茎,又名滇丹参、云南鼠尾草、丹参、小丹参、山槟榔、小红参、小红党参、小红草乌、奔马草等,彝族称为呆乃色,为多年生草本植物,主要分布于云南、贵州、四川等地[1],1974年起收载于《云南省药品标准》。紫丹参具有活血化瘀、清热解毒、镇痛、安神之功,可扩张血管,增加冠状动脉血流量,临床主要用于冠心病、高血压、动脉粥样硬化等心脑血管疾病[2]。目前对紫丹参的研究报道多集中于紫丹参化学成分研究,在采用现代分析技术进行质量控制研究方面比较欠缺。紫丹参的药效活性成分主要为水溶性的丹酚酸类和脂溶性的丹参酮类[3]。文献报道丹参质量控制多采用HPLC测定水溶性或脂溶性成分,指标成分多选用丹酚酸B、丹参酮ⅡA等,但方法较为繁琐[4-7]。本研究在此基础上采用HPLC同时测定紫丹参中4种水溶性成分丹参素钠、迷迭香酸、紫草酸、丹酚酸B及4种脂溶性成分二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA,更全面控制紫丹参药材的质量,以期为云南紫丹参药材的整体质量控制及优选GAP种植基地提供参考。
1 仪器与试药
HH-S4数显恒温水浴锅(江苏金怡仪器科技有限公司),百分之一电子天平(XCC-2002,昆明金瑞克电子衡器有限公司),BSM120.4电子天平(万分之一,上海卓精电子科技有限公司),AB265-S十万分之一电子天平(METTLER TOLEDO),SKSSOOH超声波清洗器(上海科导超声仪器有限公司),超声波清洗机(上海科导超声仪器有限公司),LC-2030液相色谱仪、UV检测器(日本SHIMADZU公司)。
丹参素钠(批号110855-201604,质量分数≥99.80%)、迷迭香酸(批号111871-201706,质量分数≥99.80%)、丹酚酸B(批号111562-201716,质量分数≥99.80%)、隐丹参酮(批号110852-201807,质量分数≥99.80%)、丹参酮Ⅰ(批号110867-201607,质量分数≥99.80%)、丹参酮ⅡA(批号110766-201721,质量分数≥99.80%),中国食品药品检定研究院;紫草酸(批号19053003,质量分数≥99.87%)、二氢丹参酮Ⅰ(批号19040211,质量分数≥99.80%),森岚科技有限公司。甲醇(分析纯,批号20190601,天津市风船化学试剂科技有限公司),甲醇(色谱纯,默克股份两合公司,批号IO917307743),乙腈(色谱纯,默克股份两合公司,批号JA059730),自制超纯水,娃哈哈纯净水。10批紫丹参药材,均购自昆明螺蛳湾药材市场,经云南中医药大学陈绍田副研究员鉴定为唇形科植物云南鼠尾草C. H. Wrigh的干燥根和根茎,样品来源信息见表1。
表1 紫丹参药材样品来源信息
批号来源产地 20180501云南楚雄云南 20190501云南楚雄云南 20190601云南玉溪云南 20190602云南瑞丽云南 20190603云南曲靖云南 20190604云南曲靖云南 20190605云南螺蛳湾云南 20190606云南昭通云南 20190607云南螺蛳湾云南 20190608云南螺蛳湾云南
2 方法与结果
2.1 溶液制备
2.1.1 对照品贮备液
取丹参素钠、迷迭香酸、紫草酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA对照品适量,精密称定,加甲醇配制成浓度分别为0.042 0、0.030 8、0.056 8、1.010 0、0.159 6、0.035 2、0.016 8、0.042 0 mg/mL的对照品贮备液。
2.1.2 混合对照品溶液
精密移取混合对照品贮备液适量,置于10 mL容量瓶中,加适量甲醇定容至刻度,得每1 mL含丹参素钠16.48 μg、迷迭香酸12.32 μg、紫草酸22.72 μg、丹酚酸B 404.00 μg、二氢丹参酮Ⅰ 6.38 μg、隐丹参酮14.08 μg、丹参酮Ⅰ 6.66 μg、丹参酮ⅡA16.80 μg的混合对照品溶液。
2.1.3 供试品溶液
取紫丹参样品(批号20180501)粉末(过3号筛)0.5 g,精密称定,置具塞锥形瓶中,精密加甲醇50 mL,称定质量,置水浴锅中加热回流30 min,取出,放冷,再称定质量,用甲醇补足减失的质量,摇匀,静置,用0.45 μm微孔滤膜过滤,取续滤液,即得。
2.1.4 阴性对照溶液
取适量甲醇,用0.45 μm微孔滤膜过滤,取续滤液,即得。
2.2 色谱条件
色谱柱为ACE Neptune-C18(4.6 mm×250 mm,5 μm),流动相为乙腈-0.1%磷酸水溶液,梯度洗脱(0~32 min,10%~38%乙腈;32~34min,38%~59%乙腈;34~40 min,59%乙腈;40~60 min,59%~90%乙腈;60~70 min,90%~10%乙腈),流速1.0 mL/min,检测波长275 nm,柱温25 ℃,进样量10 μL。理论塔板数按丹酚酸B峰计算不低于6000。
2.3 专属性试验
精密量取“2.1”项下混合对照品溶液、供试品溶液和阴性对照溶液各10 μL,按“2.2”项下色谱条件进样测定,记录色谱图。结果显示检测成分色谱峰与相邻色谱峰的分离度良好,对称因子为0.90~1.10,理论塔板数以丹酚酸B峰计均大于6000。供试品色谱图中,在与对照品色谱图丹参素钠(峰1)、迷迭香酸(峰2)、紫草酸(峰3)、丹酚酸B(峰4)、二氢丹参酮Ⅰ(峰5)、隐丹参酮(峰6)、丹参酮Ⅰ(峰7)及丹参酮ⅡA(峰8)相应位置上,均有相同保留时间的色谱峰,阴性对照溶液在相应保留时间处未见色谱峰,不干扰测定,表明系统适用性良好,方法专属性良好。色谱见图1。
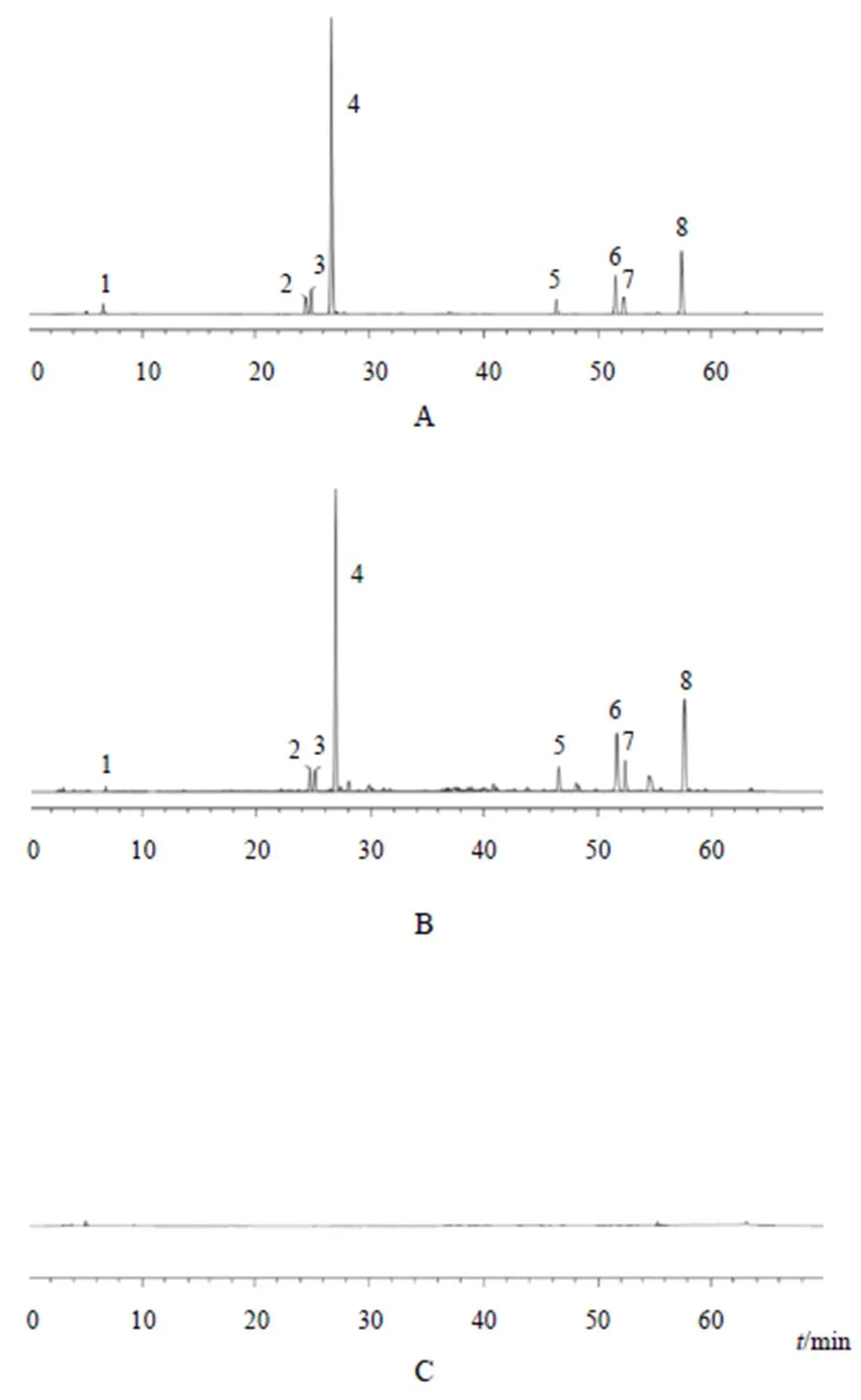
注:A.混合对照品;B.供试品;C.阴性对照;1.丹参素钠;2.迷迭香酸;3.紫草酸;4.丹酚酸B;5.二氢丹参酮Ⅰ;6.隐丹参酮;7.丹参酮Ⅰ;8.丹参酮ⅡA
2.4 线性关系考察
取“2.1.1”项下对照品贮备液0、1、2、4、6、8、10 mL,置于10 mL容量瓶中,加入适量甲醇,定容至刻度,摇匀。分别精密吸取10 μL,注入液相色谱仪,按“2.2”项下色谱条件进样测定,记录色谱图,以对照品浓度为横坐标,相应的峰面积积分值为纵坐标,得到各待测成分的线性回归方程和线性范围,各成分2均大于0.999,表明线性关系良好。结果见表2。
表2 8种成分线性关系考察结果
成分回归方程R2线性范围/μg 丹参素钠Y=6640.4X-1417.70.999 80.041 2~0.412 0 迷迭香酸Y=15 809X-2439.20.999 80.030 8~0.308 0 紫草酸Y=12 800X-3089.90.999 80.056 8~0.568 0 丹酚酸BY=9002.1X-26 2590.999 4 1.010 0~10.100 0 二氢丹参酮ⅠY=32 752X-3088.60.999 80.015 9~0.159 0 隐丹参酮Y=41 157X-30030.999 80.035 2~0.352 0 丹参酮ⅠY=37 543X-1817.70.999 90.016 4~0.164 0 丹参酮ⅡAY=55 733X-81870.999 80.042 0~0.420 0
2.5 精密度试验
精密吸取“2.1.2”项下混合对照品溶液10 μL,按“2.2”项下色谱条件进样测定,重复6次,计算丹参素钠、迷迭香酸、紫草酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA峰面积RSD分别为0.69%、0.48%、0.36%、0.31%、0.31%、0.33%、0.27%、0.34%,表明仪器精密度良好。
2.6 稳定性试验
精密吸取“2.1.3”项下供试品溶液10 μL,分别于制备后0、2、4、6、8、10、12、24 h注入液相色谱仪,按“2.2”项下色谱条件进样测定,计算丹参素钠、迷迭香酸、紫草酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA峰面积RSD分别为1.90%、2.84%、2.72%、2.22%、2.77%、3.38%、1.87%、1.85%,表明供试品在24 h内稳定性良好。
2.7 重复性试验
取紫丹参样品(批号20180501),精密称定6份,按“2.1.3”项下方法平行制备6份供试品溶液,按“2.2”项下色谱条件进样测定,测得丹参素钠、迷迭香酸、紫草酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA的峰面积值,计算其含量RSD分别为0.92%、0.67%、2.84%、1.75%、3.97%、0.62%、0.29%、0.73%,表明该方法重复性良好。
2.8 加样回收率试验
取已知含量(丹参素钠0.083%、迷迭香酸0.215%、紫草酸0.244%、丹酚酸B 4.908%、二氢丹参酮Ⅰ 0.133%、隐丹参酮0.264%、丹参酮Ⅰ 0.064%、丹参酮ⅡA0.296%)的紫丹参药材粉末0.5 g,精密称定,精密加入丹参素钠、迷迭香酸、紫草酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA对照品适量,按“2.1.3”项下方法,平行制备6份,按“2.2”项下色谱条件进样测定,以外标法计算含量,并计算加样回收率,结果见表3~表10。
表3 丹参素钠加样回收率试验
取样量 /g样品中含量 /mg加入量 /mg测得量 /mg回收率 /%平均回收率 /%RSD /% 0.250 10.207 80.210 00.417 799.95598.321.36 0.250 20.207 90.210 00.410 096.220 0.249 80.207 60.210 00.415 198.816 0.250 00.207 80.210 00.412 397.419 0.250 10.207 80.210 00.413 097.681 0.250 00.207 80.210 00.417 399.801
表4 迷迭香酸加样回收率试验
取样量 /g样品中含量 /mg加入量 /mg测得量 /mg回收率 /%平均回收率 /%RSD /% 0.250 10.537 70.543 01.092 0102.07999.851.19 0.250 20.537 90.543 01.082 1100.214 0.249 80.537 10.543 01.079 9 99.972 0.250 00.537 50.543 01.072 5 98.531 0.250 10.537 70.543 01.079 3 99.742 0.250 00.537 50.543 01.072 8 98.586
表5 紫草酸加样回收率试验
取样量 /g样品中含量 /mg加入量 /mg测得量 /mg回收率 /%平均回收率 /%RSD /% 0.250 10.609 50.610 01.227 7101.350100.151.80 0.250 20.609 70.610 01.197 9 96.428 0.249 80.608 80.610 01.227 8101.477 0.250 00.609 30.610 01.216 6 99.564 0.250 10.609 50.610 01.229 0101.557 0.250 00.609 30.610 01.222 4100.522
表6 丹酚酸B加样回收率试验
取样量 /g样品中含量 /mg加入量 /mg测得量 /mg回收率 /%平均回收率 /%RSD /% 0.250 112.275 712.330 024.846 2101.951101.352.25 0.250 212.280 612.330 025.251 1105.195 0.249 812.260 912.330 024.679 4100.717 0.250 012.270 812.330 024.714 2100.920 0.250 112.275 712.330 024.291 8 97.454 0.250 012.270 812.330 024.830 4101.863
表7 二氢丹参酮Ⅰ加样回收率试验
取样量 /g样品中含量 /mg加入量 /mg测得量 /mg回收率 /%平均回收率 /%RSD /% 0.250 10.332 00.330 00.667 1101.514102.330.77 0.250 20.332 00.330 00.672 3103.116 0.249 80.332 00.330 00.667 1101.555 0.250 00.332 00.330 00.672 3103.116 0.250 10.332 00.330 00.667 1101.555 0.250 00.332 00.330 00.672 3103.116
表8 隐丹参酮加样回收率试验
取样量 /g样品中含量 /mg加入量 /mg测得量 /mg回收率 /%平均回收率 /%RSD /% 0.250 10.660 80.660 01.351 7104.694101.571.52 0.250 20.661 00.660 01.325 0100.598 0.249 80.660 00.660 01.330 5101.594 0.250 00.660 50.660 01.319 7 99.883 0.250 10.660 80.660 01.326 0100.787 0.250 00.660 50.660 01.332 6101.840
表9 丹参酮Ⅰ加样回收率试验
取样量 /g样品中含量 /mg加入量 /mg测得量 /mg回收率 /%平均回收率 /%RSD /% 0.250 10.160 80.160 00.318 898.71197.790.64 0.250 20.160 90.160 00.317 497.816 0.249 80.160 60.160 00.317 397.932 0.250 00.160 80.160 00.315 396.565 0.250 10.160 80.160 00.317 497.839 0.250 00.160 80.160 00.317 397.858
表10 丹参酮ⅡA加样回收率试验
取样量 /g样品中含量 /mg加入量 /mg测得量 /mg回收率 /%平均回收率 /%RSD /% 0.250 10.739 50.740 01.485 7100.835100.080.88 0.250 20.739 80.740 01.480 5100.095 0.249 80.738 70.740 01.485 3100.903 0.250 00.739 30.740 01.468 9 98.600 0.250 10.739 50.740 01.473 8 99.217 0.250 00.739 30.740 01.485 2100.798
2.9 样品含量测定
分别取不同批号的紫丹参样品,按“2.1.3”项下方法每批样品同时制备3份供试品溶液,按“2.2”项下色谱条件进样测定,测定峰面积,用外标法计算样品中丹参素钠、迷迭香酸、紫草酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA的含量,结果见表11。
表11 紫丹参样品中8种成分含量测定结果(mg/g,n=3)
批号丹参 素钠迷迭 香酸紫草酸丹酚 酸B二氢丹 参酮Ⅰ隐丹 参酮丹参 酮Ⅰ丹参 酮ⅡA 201805010.0840.2160.2354.7760.1410.2680.0640.299 201905010.0630.2570.0975.9540.0530.0960.0120.105 201906010.0490.1690.0874.2160.0330.0620.0200.150 201906020.0710.2290.1176.5780.1040.0620.0120.122 201906030.0710.2780.1206.3690.0730.2030.0570.351 201906040.0400.1000.0863.1070.1560.1800.0340.212 201906050.0581.9860.8094.6200.0530.4430.0880.451 201906060.0870.1450.1773.5950.0380.1280.0180.153 201906070.0170.0170.0360.6410.0170.2350.0130.254 201906080.0570.2150.0825.0730.1260.0370.0080.061
3 讨论
本试验考察了流动相(甲醇-0.1%磷酸水溶液、甲醇-乙腈-0.1%磷酸水溶液、乙腈-0.1%甲酸水溶液、乙腈-1%醋酸水溶液)、柱温(20、25、30 ℃)、流速(0.8、1.0、1.2 mL/min),采用二极管阵列检测器,在波长200~400 nm范围对各成分进行全波长扫描,综合考虑,最后选择275 nm为检测波长,流动相为乙腈-0.1%磷酸水溶液梯度洗脱,检测波长275 nm,柱温25 ℃,在该条件下所得色谱图的分离效果、峰形、峰数等均较好。
以8种化合物的含量作为考察指标,采用单因素法,考察提取方式(超声法、水浴加热回流法)、提取溶剂(50%、70%、80%甲醇水溶液及100%甲醇)、提取时间(10、20、30 min),最终确定紫丹参样品提取方法为100%甲醇回流提取30 min,此条件下目标成分提取较完全,提取效率高,干扰杂质峰较少。
由含量测定结果可以看出,不同批次的紫丹参各成分含量差异较大。批号20190501、20190601、20190608紫丹参药材的丹参酮类成分(二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ及丹参酮ⅡA)之和低于3.0 mg/g,与其他批次样品有较大差距;批号20190607紫丹参药材中丹参素钠、迷迭香酸、紫草酸及丹酚酸B含量较其他批次药材均有较大差异。
不同来源的紫丹参药材各成分含量差异显著,有必要严格控制紫丹参药材产地或来源,以保证产品质量和疗效。本研究建立的方法可以同时测定紫丹参中的8种成分,包括以丹酚酸B为代表的水溶性成分和以丹参酮ⅡA为代表的脂溶性成分,且保留时间稳定,分离度高,测定结果准确,方法精密度高,可为紫丹参的质量控制提供参考。
[1] 中国科学院中国植物志编辑委员会.中国植物志:第65卷[M].北京:科学出版社,1977:144-145.
[2] 吴春艳,姚尧,杨兴伟,等.滇丹参的化学成分与药理活性研究进展[J].中药材,2012,35(2):330-335.
[3] 吴春艳.云南鼠尾草的化学成分研究[D].昆明:昆明理工大学,2012.
[4] 孙立秋,王金兰,赵明,等.HPLC法测定丹参地上部分中丹酚酸B和迷迭香酸的含量[J].农产品加工,2019(12):63-65.
[5] 秦学玲,杨璐璐,马娜,等.UPLC法同时测定丹参片中6种酚酸类成分的含量[J].西北药学杂志,2019,34(3):323-327.
[6] 骆媱,潘娉娉,章建华,等.HPLC法同时测定丹参-当归药对中7个成分的含量[J].药物分析杂志,2018,38(10):1689-1696.
[7] 姜晓燕,张琳,窦志华,等.反相高效液相色谱法同时测定丹参中5种成分含量[J].医药导报,2016,35(9):997-1000.
Simultaneous Determination of 8 Components in Purple Salviae Miltiorrhizae et Rhizoma by HPLC
GUAN Xiaojun1, LI Jun2, HUANG Nana1, PU Dian1, DENG Xueqi1,3, LI Fengxian1, LI Jiaxin1, LI Jun1,3
To establish a method for the simultaneous determination of tanshinone sodium, rosemary acid, shikonic acid, salvianolic acid B, dihydrotanshinone Ⅰ, cryptotanshinone, tanshinone Ⅰ, tanshinone IIAin purple Salviae Miltiorrhizae et Rhizoma; To provide reference for its quality evaluation.An ACE Neptune- C18 column (4.6 mm × 250 mm, 5 μm) was used. Gradient elution with acetonitrile-0.1% phosphoric acid aqueous solution was set as mobile phase. The flow rate was 1.0 mL/min. The detection wavelength was 275 nm. The column temperature was 25 ℃. Contents of tanshinol sodium, rosemary acid, shikonic acid, salvianolic acid B, dihydrotanshinone Ⅰ, cryptotanshinone, tanshinone Ⅰ and tanshinoneⅡAin 10 batches of purple Salviae Miltiorrhizae et Rhizoma were detected.The mass concentration of tanshinol sodium, rosemary acid, shikonic acid, salvianolic acid B, dihydrotanshinone Ⅰ, cryptotanshinone, tanshinone Ⅰ and tanshinone ⅡAwere 0.041 2‒0.412 0, 0.030 8‒0.308 0, 0.056 8‒0.568 0, 1.010 0‒10.100 0, 0.015 9‒0.159 0, 0.035 2‒0.352 0, 0.016 4‒0.164 0, 0.042 0‒ 0.420 0 μg, respectively, which showed a good linear relationship with the peak area (2were 0.999 4‒0.999 8), and the average sample recovery was among 97.79%‒102.33% (RSD<3%).This method is sensitive, accurate, reliable and reproducible, which can be used for the quality evaluation of purple Salviae Miltiorrhizae et Rhizoma.
purple Salviae Miltiorrhizae et Rhizoma; multi-component simultaneous measurement; content determination; HPLC

R284.1
A
1005-5304(2020)09-0082-05
10.3969/j.issn.1005-5304.202002080
云南省重大科技专项(2018ZF001)
李俊,E-mail:411790624@qq.com
(2020-02-06)
(2020-03-06;编辑:陈静)
