粪便标本中诺如病毒GⅡ拷贝数定量检测方法的建立和应用
2020-10-13赵跃丽孙强明张兰胜
赵跃丽,饶 清,孙强明,张兰胜
(1. 大理大学药学与化学学院,云南 大理 671000; 2. 中国医学科学院 北京协和医学院医学生物学研究所,云南 昆明 650118; 3. 云南省重大传染病疫苗研发重点实验室,云南 昆明 650118)
诺如病毒(Norovirus,NoV)是一种RNA病毒,该病毒无包膜、单链、正向,其基因组长度为7.5~7.7 kb,病毒颗粒直径长27~40 nm,属于杯状病毒(Caliciviridae),其基因(小鼠NoV除外)包含3个编码不同功能蛋白的开放阅读框(ORF1,2,3)[1]。ORF1主要编码6个非结构蛋白,从N端依次到C端编码的蛋白质分别为p48、NTPase、p22、VPg、3CLpro、RdRp[2];该病毒的主要结构蛋白VP1和次要结构蛋白VP2分别由ORF2和ORF3编码[3]。根据其主要结构蛋白VP1的氨基酸同源性的不同,NoV主要划分为7个基因型(GⅠ~VⅡ),其中以GⅡ基因型最常见[4]。5岁以下儿童中绝大部分胃肠炎的暴发均与NoV GⅡ有关,流行范围和其易感性仅次于轮状病毒,疫情又常在幼托机构和小学低年级中发生[5]。由于NoV GⅡ传染性强,其新变种每2~4年出现一次,且极易引起全球性的暴发流行,给全球公共卫生事业带来了沉重的疾病负担。通过感染患者粪便或呕吐物产生的气溶胶,或间接接触被感染患者排泄物污染的环境均可使NoV GⅡ发生二次传播,甚至在不同物种间NoV GⅡ也有发生传播的可能[6-7],因此,研究和开发敏感、可靠、标准化的实验室病毒定量检测方法,对有效防治NoV GⅡ具有重要意义。
为建立一种快速的NoV GⅡ拷贝数标准质粒及其检测体系,本试验通过BioEdit对NCBI数据库中下载的所有NoV GⅡ株全基因序列进行比对,选取同源性好且高度保守的片段构建标准对照质粒,根据构建的NoV GⅡ标准品基因序列设计其特异性检测引物,优化反应体系,最终建立一种用于检测NoV GⅡ拷贝数的逆转录实时定量聚合酶链反应(RT-qPCR)检测体系,准确快速地定量检测临床粪便标本的病毒拷贝数,为临床诊断及治疗提供重要参考依据。
1 材料与方法
1.1 主要试剂与材料 病毒RNA提取试剂盒购于Qiagen公司,逆转录试剂盒和质粒小量提取试剂盒购于天根(TIANGEN)生化科技(北京)有限公司,荧光定量试剂ALL-in-OneTM qPCR Mix试剂盒购于复能基因有限公司(GeneCopoeia),loading buffer、PCR MIX购于日本TaKaRa公司。4份儿童腹泻粪便标本来自于2018年12月昆明市儿童医院。
1.2 NoV GⅡ标准质粒与特异性引物 在NCBI数据库中下载所有NoV GⅡ株全基因序列,用BioEdit进行全基因序列比对,选取同源性好、高度保守、大小为500 bp的片段为标准品并克隆到载体pUC57上,且根据该片段设计特异性引物。普通PCR上游引物CoG2F:5’-CARGARBCNATGTTYAGRTGGATGAG-3’,普通PCR下游引物G2-SKR:5’-CCRCCNGCATRHCCRTTRTACAT-3’;q-PCR上游引物G2F:5’-GAATGAAGATGGCGTCGAGTG-3’,q-PCR下游引物G2R:5’-CCAAAT GGGAAAGGTAGGGAT-3’,标准品片段与引物由昆明硕擎生物科技公司合成。
1.3 腹泻粪便标本病毒核酸(RNA)提取 依据QIAamp公司病毒RNA提取试剂盒的说明书,按操作流程处理分装的粪便标本,最后用50 μL DEPC H2O溶解所提取的RNA,静置2 min后离心收集提取的RNA。
1.4 逆转录聚合酶链反应(RT-PCR) 使用天根公司的逆转录试剂盒,参考试剂盒说明书采用20 μL 体系。反应体系分为两步,首先取2 μL 5×gDNA Buffer(5×gDNA Buffer含有高效去除基因组DNA的gDNase,可以去除gDNA,有效避免Total RNA中基因组的干扰),加8 μL RNA至反应管中,充分混匀,短暂离心42℃孵育3 min后置于冰上;其次取2 μL 10×King RT Buffer、1 μL FastKing RT Enayme Mix、2 μL FQ-RT Primer Mix、5 μL RNase-Free ddH2O加入第一步反应液中,充分混匀,短暂离心后42℃孵育15 min,95℃孵育3 min,置于4℃终止反应。
1.5 标准质粒的扩增 合成的标准品片段连接至载体PUC57上,连接产物转化感受态E.coli DH-5α,挑单个独立菌落接种至5 mL液体培养基中,加入氨苄西林(100 μg/mL)5 μL,置于摇床震摇14 h,使用天根生化科技(北京)有限公司的质粒小量提取试剂盒进行质粒提取,采用紫外分光光度计检测提取质粒的浓度(ng/μL),并按下式计算标准质粒的拷贝数。

1.6 标准质粒与粪便标本的验证 将扩增的质粒稀释100倍和粪便标本cDNA同时进行普通PCR验证,采用25 μL反应体系,包括上、下游引物各1 μL, ddH2O 8.5 μL,Mix 12.5 μL,稀释的质粒和标本cDNA原液2 μL,充分混匀,短暂离心,放入PCR仪中。扩增程序如下:98℃预变性2 min,98℃10 s,56℃ 30 s,72℃ 1 min,进行35个循环;72℃延伸10 min。取PCR产物5 μL加入1%的琼脂糖凝胶的上样孔中,采用120 V的电压进行电泳。将出现目的条带的PCR产物送至昆明硕擎生物科技公司进行测序。
1.7 实时荧光定量PCR 将扩增的NoV GⅡ标准质粒用ddH2O按梯度从10-1稀释至10-7浓度,采用实时荧光定量PCR 检测,反应体系选择10 μL,包括qPCR Mix 5 μL(qPCR Mix是含有SYBR○R Green染料的即用型预混液),ddH2O 3 μL, q-PCR上、下游引物各0.5 μL,标准质粒1 μL,同时设3个阴性对照孔,以ddH2O作为阴性对照。扩增程序为95℃ 5 min,95℃ 10 s,56℃ 20 s,72℃ 30 s,进行40个循环;65℃ 5 s,95℃ 50 s。以获得的NoV GⅡ标准质粒的溶解峰与扩增曲线,绘制NoV GⅡ标准质粒的标准曲线,标准曲线Y轴是RT-qPCR检测所获得的标准质粒Ct值,X轴为计算求得的标准质粒拷贝数log10,NoV GⅡ标准质粒的标准曲线方程根据标准曲线求得。
1.8 病毒拷贝数 对上述1.6获得的并且与BLAST对比确定为GⅡ阳性的粪便标本,随机抽取4份粪便标本的RT-PCR产物进行定量PCR,获得Ct值,再根据NoV GⅡ标准质粒获得的标准曲线和求得的标准曲线方程计算获得粪便上清标本中NoV GⅡ的拷贝数。定量PCR以标准质粒作为阳性对照组,ddH2O作为阴性对照组。
2 结果
2.1 普通PCR验证结果 将4份粪便标本普通PCR产物琼脂糖凝胶电泳图和序列进行比对,结果确定标本中含GⅡ组NoV。粪便标本NoV GⅡ PCR产物电泳及序列比对结果见图1、2。

Maker为分子量标准;标本1、2、3、4为粪便标本。

图2 粪便标本NoV GⅡ序列对比图
2.2 标准质粒的扩增与验证结果 采用质粒小量提取试剂盒按说明书操作步骤提取扩增的NoV GⅡ标准品质粒,使用紫外分光光度计测其浓度为321.25 ng/μL,再将NoV GⅡ标准质粒稀释100倍后进行普通PCR取其扩增产物采用1%的琼脂糖凝胶电泳。见图3A。将扩增的NoV GⅡ标准品质粒取4 μL与其普通PCR产物送至昆明硕擎生物科技公司进行测序,测序结果在BLAST上进行比对,比对结果表明质粒嵌合序列与设计序列100%吻合。见图3B。
2.3 标准曲线图 根据荧光定量PCR的扩增曲线,可直接获得各个标准质粒相应的Ct值,并按照公式计算标准质粒的拷贝数。NoV GⅡ标准质粒的荧光定量PCR的扩增曲线与溶解曲线见图4。

A:标准质粒的电泳图;B:标准质粒测序峰。
使用紫外分光光度计测得NoV GⅡ标准质粒浓度为321.25 ng/μL,DNA长度为3 653 bp,按照公式计算获得其拷贝数为8.15×1010copies/μL,NoV GⅡ标准质粒拷贝数的log10值见表1。以RT-qPCR检测所获得的NoV GⅡ标准质粒拷贝数log10作为X轴,其Ct值作为Y轴,绘制NoV GⅡ标准质粒的标准曲线,其标准曲线方程根据标准曲线可求得为Y=-3.972X+39.03,R2=0.991,标准曲线见图5。

图4 NoV GⅡ标准质粒荧光定量PCR的扩增曲线与溶解曲线
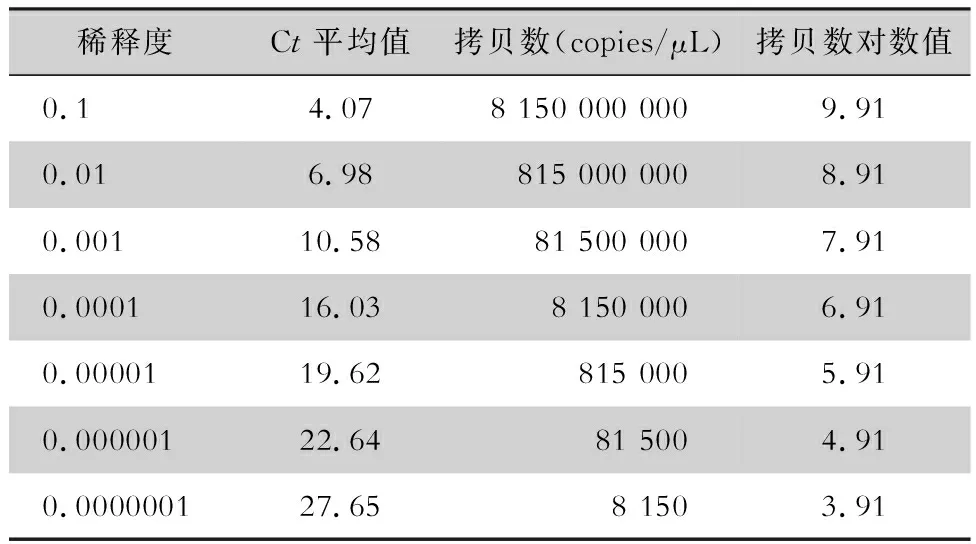
表1 NoV GⅡ标准质粒检测结果

图5 NoV GⅡ标准质粒标准曲线
2.4 粪便标本测序分型及其拷贝数 4份粪便标本进行荧光定量PCR检测获得相应的Ct值,且各Ct分布在标准曲线范围内,将荧光定量PCR产物送至昆明硕擎生物科技公司进行测序,测序结果通过NCBI网站上的BLAST进行比对,比对结果及序列见表2,与普通PCR结果一致。4份粪便标本NoV GⅡ检测结果曲线为,标本1:Y=-3.152X+23.45,R2=0.95;标本2:Y=-2.730X+26.33,R2=0.96;标本3:Y=-3.075X+23.63,R2=0.96;标本4:Y=-2.166X+29.14,R2=0.89。见图6、7。4份粪便标本原液病毒拷贝数分别为30 443.45、9 468.40、53 176.69、4 493.12 copies/μL,标本原液及稀释液NoV GⅡ拷贝数检测结果见表3。对标本稀释后进行NoV GⅡ拷贝数检测,最低可以检测的拷贝数为24.66 copies/μL。

表2 4份粪便标本的分型及其序列

图6 粪便标本3荧光定量PCR扩增曲线

图7 4份粪便标本荧光定量PCR检测结果曲线图
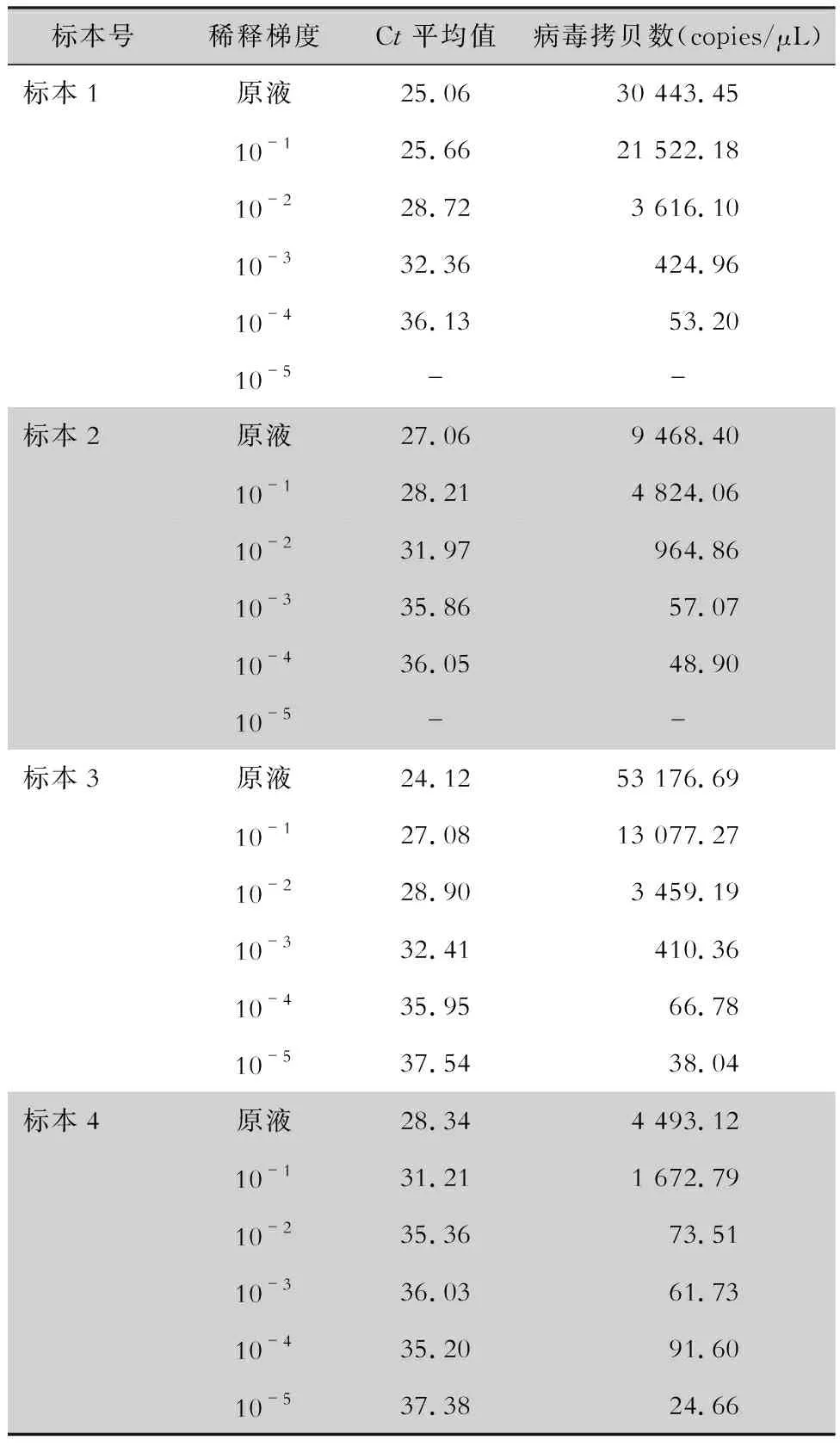
表3 粪便标本原液及各稀释度中 NoV GⅡ拷贝数检测结果
3 讨论
NoV GⅡ感染性腹泻在全世界范围内均有流行,可以感染所有人群,甚至威胁5岁以下儿童、60岁以上老人和有潜在疾病患者的生命,因此接种疫苗对这一人群非常有益。目前,还没有获得被批准的可以预防和治疗NoV感染的疫苗,其中NoV基因型的多样性、抗原漂移突变、不能在体外细胞培养中生长和缺乏合适的动物模型等是阻碍疫苗研究的主要因素[8-12]。近年来,我国北京、上海、香港等多地发生多起NoV感染暴发,暴发程度仅次于轮状病毒,绝大多数暴发主要是由NoV GⅡ基因型引起,并且随着时间的推移NoV疫情不断上升、加重,给我国的医疗卫生事业造成了严重的疾病负担[13-16]。因此,寻找早期诊断NoV GⅡ感染的方法,对于其感染控制和临床治疗具有十分重要的意义。目前,虽然RT-PCR是NoV GⅡ主要的诊断方法,但是RT-PCR在操作过程中易发生交叉污染,导致假阳性,需要测序才能确定病毒类型,并且对于检测病毒含量低的标本灵敏度低,不能进行定量测定无法获得病毒的拷贝数,不利于对患者感染程度进行判断[17]。因此,研究开发敏感、可靠、标准化的实验室NoV GⅡ定量检测方法对有效防治NoV GⅡ具有重要意义。本试验在扩增曲线中设定了荧光阈值,只有荧光RFU值高于阈值才有相应的拷贝数结果,在扩增结束后设定了溶解曲线程序,只有扩增产物是目的片段时,扩增曲线的溶解曲线才单一且与溶解值一致,通过以上方法排除假阳性。本试验方法能在感染早期NoV含量低的标本中,快速、准确地检测出NoV,并通过定量测定获得病毒的拷贝数,从而对患者感染程度作出准确判断,指导用药剂量及其用药疗程,还可以对重病患者的病程发展情况进行实时监控,为患者的临床治疗及预后判断提供了一种有效的检验方法。
本研究通过对NoV GⅡ基因组序列进行分析,针对VP1衣壳蛋白高度保守序列片段设计扩增特异性引物,此引物在试验中显示出较高的敏感性。选取VP1衣壳蛋白高度保守序列片段引物区序列500 bp,构建NoV GⅡ标准质粒。得到标准曲线方程:Y=-3.972X+39.03,R2=0.991。试验中相应浓度的Ct值差异较小,且在误差范围内,证明该方法的稳定性和准确性都较好,可根据标准曲线对试验标本中的NoV GⅡ进行绝对定量。对4份2018年12月来自于云南省昆明市儿童医院的NoV GⅡ感染患者的粪便标本分别进行荧光定量PCR检测,参照标准曲线方程获得相应的粪便标本拷贝数。通过试验验证,该标准质粒具有较高的敏感性,并且可对标本中NoV GⅡ进行定量测定,为疾病的预防控制和相关试验研究提供了有效的定量检测方法。
