血清胃蛋白酶原联合幽门螺杆菌检测对慢性胃炎患者胃黏膜损伤程度的评估价值
2020-10-13
慢性胃炎是一种由多因素引起的胃黏膜屏障破坏伴或不伴胃腺结构受损的炎性病变,基于胃黏膜病理变化和病变分布范围等可分为慢性非萎缩性胃炎、慢性萎缩性胃炎Closed型和慢性萎缩性胃炎Open型[1,2]。慢性萎缩性胃炎是胃癌最常见的癌前病变,据世界卫生组织和美国癌症协会官方数据库中收集到的癌症流行病学资料显示,胃癌已成为普通人群中第三大癌症致死疾病[3],每年有超过95 万的新增病例,不同国家和地区胃癌的发病率存在明显差异[4]。我国是胃癌高发地区,胃癌在我国肿瘤相关发病率中排名第二,死亡率排名第三[5]。由于胃癌早期无特异性症状,不易与其他胃部疾病相鉴别,因此胃癌被发现时多数已进展为中晚期,所以对胃癌高危人群进行大规模筛查,早期发现癌前病变、早期干预显得至关重要。当前慢性萎缩性胃炎的确诊主要是通过胃镜观察及病理诊断,但因该检查方法费用较高,且胃镜检查痛苦较大,导致一些患者拒绝此项检查,故该方法难以用于大规模筛查。
血清中胃蛋白酶原(pepsinogen, PG)水平可较准确地反映不同部位胃黏膜的损伤程度。幽门螺杆菌(Helicobacter pylori, Hp)感染是胃黏膜病变重要的始动因素,是慢性胃炎最主要的病因[1],积极进行Hp 检测已成为胃癌防治的重要措施之一。患者血清PG 水平及Hp感染状态与胃炎及早期胃癌的发生发展关系密切,此两种检测方法简便快捷、经济安全,可对胃癌高危人群进行批量筛查,从而评估胃癌高危人群胃黏膜损伤的程度。本研究旨在分析慢性胃炎患者血清中PGⅠ、PG Ⅱ和PGR 的水平与慢性胃炎黏膜病变程度的相关性,探讨血清PG 水平联合Hp 检测对慢性胃炎患者胃黏膜损伤程度的评估价值。
1 材料与方法
1.1 临床资料选取2019年7~12月于潍坊医学院附属医院消化内科就诊的慢性胃炎患者共150例,其中慢性非萎缩性胃炎患者90例、慢性萎缩性胃炎(C型、O型)患者60例;男58例,女92例;年龄18~86岁,平均(51.31±14.19)岁。纳入标准:①均由胃镜及病理组织学活检确诊;②均符合《中国慢性胃炎共识意见(2017年,上海)》诊断标准[1];③近3个月均无特殊用药史(抑酸药物、抗生素、铋剂药物);④均自愿参与本研究,并签署知情同意书。排除标准:①患有心、肝、肺、肾重大疾病或功能严重异常者;②有胃癌、胃部手术史者;③有上消化道大出血者;④有凝血功能障碍或近1 周内服用抗凝或抗血小板药物者;⑤有精神疾病不能配合者。
1.2 检测方法PG Ⅰ、PG Ⅱ和PGR水平检测:采集患者空腹静脉血5ml,检测转速为4 000r/5min,离心半径5cm,离心5min,分离血清。采用全自动化学发光仪 MAGLUMI4000 Plus 检测仪,通过化学发光分析法来检测PG Ⅰ、PG Ⅱ和PGR水平,血清PGⅠ、PG Ⅱ试剂盒来自深圳市新产业生物医学工程股份有限公司,操作均按照试剂盒说明严格进行。PG 正常值:PGⅠ70~240ng/ml、PG Ⅱ0~13ng/ml、PGR>3.0。根据相关指南,将PGⅠ≤70ng/ml、且PGR≤7.0 作为我国胃癌高危人群筛查的标准[6]。Hp 检测:检测仪器及配套试剂由深圳市中核海得威生物科技有限公司提供,受试者空腹安静状态下呼气至第1个集气袋内,随后服用13C 尿素胶囊,服药30min 后呼气至第2个集气袋内,采用远红外光谱分析仪进行检测。13C-UBT诊断Hp感染的标准以DOB(Delta Over Baseline)值表示,即第2个集气袋所测13CCO2的δ值减去第1 袋所测δ值,DOB≥4.0为阳性。病理检测:采用日本奥林巴斯高清电子胃镜GIF-HQ290,受试者接受胃镜检查前8h 禁食、4h 禁水,检查前10min 服用盐酸达克罗宁胶浆,患者取左侧卧位,双腿向前屈曲,行胃镜检查,采集食管至十二指肠的图像,分别于胃窦、胃角和胃体处取活检,若有可疑部位再另取活检,根据病理检查结果,本次试验采用日本木村-竹本分型,将慢性萎缩性胃炎分为Closed型和Open型。。
1.3 统计学方法采用SPSS 22.0 统计软件进行统计分析。计数资料比较采用χ2检验。计量资料采用Kolmogorov-Smimov 检验分析其是否服从正态分布,偏态分布资料采用中位数(M)[四分位数(P25,P75)]表示,两组间比较采用Mann-Whitney U 检验,检验水准的调整采用Bonferroni 法,多组间比较采用Kruskal-Wallis H 检验。以P<0.05为差异有统计学意义。
2 结果
2.1 病理检查结果通过对临床患者进行电子胃镜及病理检查后,筛选出慢性非萎缩性胃炎患者90例,慢性萎缩性胃炎C型患者45例,慢性萎缩性胃炎O型患者15例。
2.2 血清中PGⅠ、PGⅡ和PGR水平对比慢性非萎缩性胃炎患者的PG Ⅰ、PG Ⅱ和PGR水平与慢性萎缩性胃炎C型患者相比无明显变化,差异无统计学意义(P>0.05);慢性非萎缩性胃炎患者的PG Ⅰ、PGR水平明显高于慢性萎缩性胃炎O型患者,PG Ⅱ水平明显低于慢性萎缩性胃炎O型患者,差异有统计学意义(P<0.05);慢性萎缩性胃炎C型患者的PG Ⅰ、PGR水平明显高于慢性萎缩性胃炎O型患者,PG Ⅱ水平明显低于慢性萎缩性胃炎O型患者,差异有统计学意义(P<0.05),见表1。

表1 血清中PG Ⅰ、PG Ⅱ和PGR水平比较
2.3 不同类型胃炎患者中Hp阳性率对比慢性非萎缩性胃炎患者中,Hp感染者21例,Hp非感染者69例;慢性萎缩性胃炎患者中,Hp感染者31例,Hp非感染者29例。萎缩性胃炎患者Hp阳性率(51.66%)显著高于非萎缩性胃炎患者(23.33%),差异有统计学意义(P<0.05)。
2.4 同种类型慢性胃炎患者中Hp感染者与Hp非感染者血清中PGⅠ、PGⅡ和PGR水平对比在慢性非萎缩性胃炎及慢性萎缩性胃炎患者中,Hp感染者与Hp非感染者之间血清PG Ⅰ、PG Ⅱ和PGR水平比较,差异均无统计学意义(P>0.05),见表2。
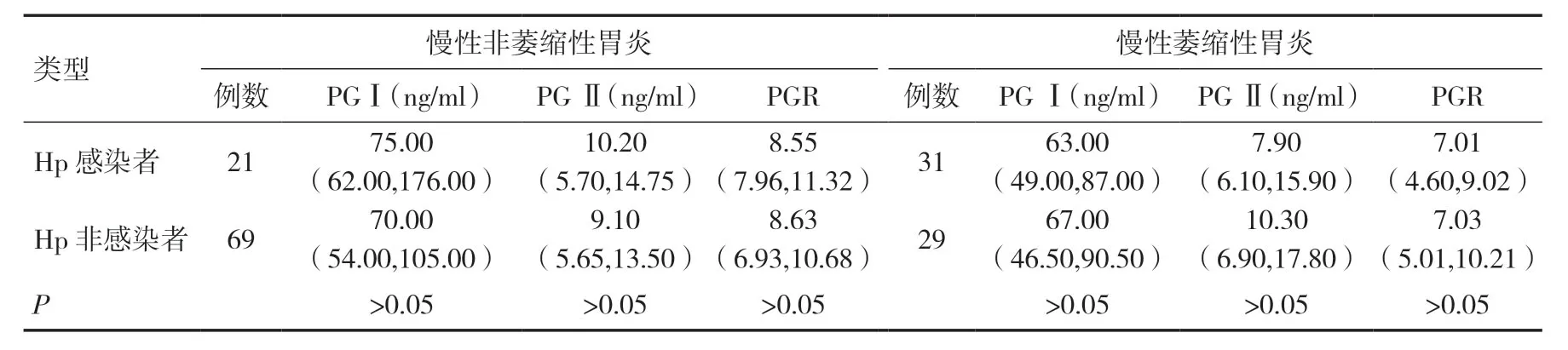
表2 慢性萎缩性胃炎中Hp感染者与非感染者血清PG Ⅰ、PG Ⅱ和PGR水平比较
3 讨论
胃癌是起源于胃黏膜上皮细胞的恶性肿瘤,导致胃黏膜癌变的两大可控事件是Hp感染和胃黏膜萎缩。Hp感染是胃黏膜癌变重要的始动因素,同时Hp感染目前也公认是胃癌发生的独立危险因素;慢性萎缩性胃炎是早期胃癌重要的“过渡性事件”,部分胃黏膜萎缩可以逆转,而一旦发生肠化生,就很难逆转。因此,在积极治疗Hp感染所致的慢性活动性胃炎的前提下,及早筛查出慢性萎缩性胃炎并采取有效的治疗措施,就可能阻止胃黏膜癌变。
PG是胃蛋白酶的无活性前体,主要由胃黏膜腺体细胞合成分泌,根据其生化特性、免疫原性及细胞来源不同PG可分为PG Ⅰ和PG Ⅱ两个亚群,其中PG Ⅰ主要由胃底腺主细胞分泌,而 PG Ⅱ可来源于几乎所有的胃腺细胞,除由胃底腺主细胞分泌外,贲门腺、幽门腺以及十二指肠布鲁纳腺细胞也能产生[7]。人体所有的PG 几乎都来源于胃,正常情况下,大部分合成后的PG 进入胃腔,约1%的PG 透过胃黏膜毛细血管进入血液循环,进入血液循环的PG 在血液中非常稳定。因此,当胃黏膜发生病理变化时,血清中PG 的含量也随之改变,故血清中PG Ⅰ和PG Ⅱ的水平可间接反映不同部位的胃黏膜分泌功能,检测血清中PG 浓度可作为监测胃黏膜状态的手段。本研究结果显示,慢性萎缩性胃炎C型患者的PG 水平与慢性非萎缩性胃炎患者相比无明显变化,考虑与萎缩性胃炎分型相关,C型患者胃黏膜萎缩范围不超过贲门,较少或未侵及胃底腺,PG Ⅰ水平受变化影响较小;胃体萎缩时可存在肠上皮化生或者被幽门腺体所代替,PG Ⅱ水平维持稳定或者轻度增加,因此慢性萎缩性胃炎C型与慢性非萎缩性胃炎组患者相比PG Ⅰ、PGR水平略有下降,但差异无统计学意义(P>0.05)。慢性萎缩性胃炎O型患者PG Ⅰ水平明显低于C型患者和非萎缩性胃炎患者,考虑当腺体萎缩超过贲门时,萎缩范围广,腺体和主细胞数量明显减少,PG Ⅰ分泌下降,由于腺体化生或者Hp 长期刺激致使分泌PG Ⅱ细胞数目增多,PG Ⅱ的分泌就增加,所以PGR 明显下降。慢性萎缩性胃炎病程越长,病变侵及范围越大、发展越快,PG Ⅰ的分泌就越低,而PG Ⅱ分泌增加,故此PGR 明显下降[8]。这与孙运涛等[9]的研究结果大致相符。本研究结果示PG水平和PGR 的变化可以在一定程度上判断患者是否处于慢性萎缩性胃炎高危阶段,即胃底腺黏膜是否存在大范围萎缩、伴或不伴肠上皮化生,可以起到胃底腺黏膜“血清学活检”的作用[10],在此基础上进一步行胃镜及病理组织活检就可以确诊,这样就能及时采取有针对性的治疗措施,进而阻止早期胃癌的发生发展。
Hp为革兰阴性微需氧菌,主要附着于胃窦部,定居于胃窦黏液层与黏膜上皮细胞表面,凭借其产生的空泡毒素及细胞毒素导致上皮细胞损伤,促进上皮细胞释放炎症介质,并可引起自身免疫反应,总之可通过多种机制使炎症反应迁延或加重[11]。目前关于Hp感染与PG 水平的变化,国内外研究结果各异,本研究结果表明,在慢性非萎缩性胃炎及萎缩性胃炎患者中,PG 水平与Hp感染与否差异不明显,与李红涛等[12]研究结果一致,但与相关文献结果不符[13],考虑可能与检测方法不同、Hp 的菌株状态、感染阶段等因素有关,其具体机制有待进一步研究。此外,本研究结果显示,萎缩性胃炎患者Hp阳性率(51.66%)显著高于非萎缩性胃炎患者(23.33%),表明胃癌前病变中Hp感染更为常见,且与胃黏膜萎缩严重程度密切相关[14]。有报道Hp感染者几乎都存在慢性活动性胃炎[15],且Hp可促进慢性萎缩性胃炎发展为胃癌[16],因此,Hp感染后无论有无症状及并发症,均应给予根除治疗,除非存在抗衡因素。鉴于此积极进行Hp 检测就成为早期胃癌防治的重要举措之一,快速尿素酶试验属于有创性检查,且该结果受检测人自身因素影响较大,假阳性率较高,准确性较差;血清Hp 抗体检测无法分清是现症感染还是既往感染。本研究采用13C-尿素呼气试验检测Hp,该方法不依赖内镜,方便、快捷、准确率高。
综上所述,血清PG 和Hp 联合检测可用于大规模筛查人群中慢性萎缩性胃炎患者,Wang 等[17]也同样认为,对于早期胃癌患者若使用血清PG Ⅰ联合Hp 诊断可有效提高诊断效能。但该检查并不能代替胃镜,当PG Ⅰ、PGR水平明显降低,PG Ⅱ水平明显升高时,应提高早期胃癌的警惕性,及时进行胃镜检查,以明确是否存在早期癌变的可能性,多项研究[18,19]均表明此观点。此外,有研究认为,感染Hp 且PG 水平低于胃癌高危人群筛查标准的患者,其胃癌发病风险明显高于正常人[7]。若根除Hp 后PG 水平可恢复正常,则其胃癌发病风险显著下降[20]。但目前国内对此研究领域少有报道,故需行多中心、大样本数据以进一步追踪研究。
