宫颈癌患者血清SCC-Ag、Tim-4、PD-L1水平与预后的相关性分析
2020-10-13
宫颈癌是最常见的妇科恶性肿瘤,早期常无症状和体征,随着病情的发展可发生阴道流血、排液[1]。近年来,宫颈癌的发病率逐渐上升,并有年轻化的趋势,严重威胁患者的生命安全。临床已发现多种与宫颈癌相关的生物学指标,但发病机制仍不清楚,故寻找新的与宫颈癌发生发展及预后相关的生物学指标具有重要意义[2]。血清鳞状细胞癌抗原(SCC-Ag)是鳞癌细胞产生的特异抗原,与肿瘤分级、大小及侵袭程度和淋巴结转移相关[3]。T细胞免疫球蛋白黏蛋白分子4(Tim-4)是具有共同基序的跨膜糖蛋白,参与多种免疫性疾病的发生发展,其表达强度与肿瘤分化程度有关[4]。可溶程序性死亡分子1(PD-L1)信号通路是近年来医学免疫学研究热点,其主要通过抑制T细胞活化与增殖和细胞因子分泌负性调控T细胞免疫应答,在肿瘤免疫逃逸和耐受中具有重要作用[5]。临床关于血清SCCAg、Tim-4、PD-L1水平与肿瘤预后关系的相关报道较少,本研究分析血清SCC-Ag、Tim-4、PD-L1水平与肿瘤预后的关系,旨在为临床诊断和治疗提供参考,现报道如下。
1 材料与方法
1.1 一般资料回顾性分析2012年1月~2015年1月我院收治的60例宫颈癌患者的临床资料。纳入标准:①均经病理学证实,符合国际妇产科联合会(FIGO)分类标准和WHO分级标准[6]者;②年龄30~75岁;③术前未行化疗、放疗或激素治疗。排除标准:①严重肝肾功能不全者;②合并自身免疫系统疾病及其他恶性肿瘤者;③临床资料不完整者。选取50例宫颈上皮内瘤病变(CIN)患者作为CIN组,同时选取同期于我院进行体检的40例健康者作为对照组。宫颈癌组:年龄31~75岁,平均(47.26±5.33)岁;临床分期:Ⅰb期28例,Ⅱa期12例,Ⅱb期20例;病理类型:鳞状细胞癌41例,腺癌19例。CIN组:年龄30~75岁,平均(48.31±5.37)岁。对照组:年龄30~73岁,平均(46.95±5.30)岁。三组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 临床资料 记录患者年龄、临床分期、病理类型、肿瘤直径、病理分级、浸润深度、淋巴结转移及脉管浸润情况。
1.2.2 SCC-Ag、Tim-4、PD-L1水平测定 取晨起空腹静脉血3ml,保存于EDTA 抗凝管中,在3 000r/min下离心15min,沉淀细胞,分离上清液后采用全自动电化学发光免疫分析仪(罗氏Cobas e601型)测定血清SCC-Ag、Tim-4、PD-L1水平。
1.2.3 宫颈癌患者随访 采用电话、门诊等方式对患者进行至少5年的随访,起始时间为确诊时间,5年生存随访截至2020年1月,总生存随访截至2020年4月,随访过程中2例失访,随访率为96.67%,中位随访时间为(30.14±2.88)个月,记录患者5年生存率和总生存率。
1.3 观察指标①对比宫颈癌组、CIN组及对照组血清SCC-Ag、Tim-4、PD-L1水平;②对比不同年龄、病理类型、肿瘤直径、临床分期、病理分级、浸润深度、淋巴结转移及脉管浸润患者的血清SCC-Ag、Tim-4、PD-L1水平。
1.4 统计学方法采用SPSS 20.0 软件分析数据,计量资料以±s表示,行单因素方差分析及LSD-t 检验,多组比较采用F检验,多因素采用COX回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 三组血清SCC-Ag、Tim-4、PD-L1水平比较宫颈癌组血清SCC-Ag、Tim-4、PD-L1水平均显著高于CIN组和对照组(P<0.05),CIN组血清PD-L1水平高于对照组,两组血清SCC-Ag、Tim-4水平比较差异无统计学意义(P>0.05),见表1。
表1 三组血清SCC-Ag、Tim-4、PD-L1水平比较(±s)

表1 三组血清SCC-Ag、Tim-4、PD-L1水平比较(±s)
注:与宫颈癌组比较,#P<0.05;与对照组比较,*P<0.05
组别 n SCC-Ag(ng/ml)Tim-4(ng/ml)PD-L1(%)宫颈癌组 60 9.05±3.26 18.69±9.10 9.91±3.55 CIN组 50 1.92±0.65# 15.61±7.12# 6.21±2.03#*对照组 40 0.64±0.20# 14.26±6.15# 3.80±1.24#F 245.671 3.924 69.342 P 0.000 0.022 0.000
2.2 宫颈癌患者血清SCC-Ag、Tim-4、PD-L1水平与临床病理特征的关系SCC-Ag、Tim-4、PD-L1水平与临床分期、病理分级、浸润深度、淋巴结转移及脉管浸润相关,差异具有统计学意义(P<0.05);与年龄、病理类型、肿瘤直径无关,差异无统计学意义(P>0.05),见表2。
表2 宫颈癌患者血清SCC-Ag、Tim-4、PD-L1水平与临床病理特征的关系(±s)

表2 宫颈癌患者血清SCC-Ag、Tim-4、PD-L1水平与临床病理特征的关系(±s)
项目 n SCC-Ag(ng/ml) Tim-4(ng/ml) PD-L1(%)均数±标准差 t P 均数±标准差 t P 均数±标准差 t P年龄(岁) 0.396 0.964 0.914 0.365 1.940 0.057≤45 24 8.91±2.26 17.56±4.60 9.65±3.30>45 36 9.15±2.33 18.76±5.22 8.14±2.70临床分期 4.252 0.000 2.835 0.006 3.898 0.000Ⅰb 22 7.65±2.08 15.16±4.23 9.59±3.27Ⅱa+Ⅱb 38 11.44±3.86 18.87±6.37 7.04±1.81病理类型 0.424 0.673 0.501 0.618 1.506 0.138鳞状细胞癌 41 9.13±2.40 18.17±5.62 9.31±3.24腺癌 19 8.85±2.34 17.45±4.01 7.98±3.05病理分级 7.669 0.000 2.617 0.013 4.026 0.000 G1+G2 39 7.33±1.26 15.64±3.34 6.87±2.26 G3 21 12.29±3.68 18.77±5.92 9.83±3.42肿瘤直径(cm) 0.802 0.426 0.793 0.431 1.575 0.121≤5 32 8.74±2.30 17.09±5.04 8.05±3.04>5 28 9.28±2.91 18.14±5.20 9.28±3.15浸润深度 4.804 0.000 2.272 0.027 3.635 0.001≤1/2肌层 20 7.63±2.44 15.22±3.39 7.04±1.66>1/2肌层 40 12.33±4.01 18.85±6.71 9.78±3.50淋巴结转移 5.714 0.000 2.350 0.022 3.684 0.001是12 12.53±4.10 18.51±6.44 9.92±3.61否48 7.40±2.19 15.30±3.52 7.11±1.96脉管浸润 4.984 0.000 2.601 0.012 2.444 0.018是17 12.43±4.05 18.57±6.32 9.24±3.05否43 8.04±2.61 15.26±3.47 8.19±2.88
2.3 影响宫颈癌预后的单因素分析单因素分析显示,临床分期、病理分级、浸润深度、淋巴结转移、SCC-Ag、Tim-4及PD-L1 与宫颈癌患者预后不良有关,差异有统计学意义(P<0.05),见表3。
2.4 影响宫颈癌预后的多因素分析将单因素分析中有统计学意义的影响因素设为变量进行赋值(病理分期Ⅱa+Ⅱb=1、Ⅰb期=0;病理分级G3=1、G1+G2=0;浸润深度>1/2肌层=1,≤1/2肌层=0;有淋巴结转移=1,无淋巴结转移=0;SCC-Ag>2ng/ml、Tim-4>5ng/ml、PD-L1>1%赋值为1,SCC-Ag≤2ng/ml、Tim-4≤5ng/ml、PD-L1≤1%赋值为0。COX回归分析显示,临床分期、病理分级、浸润深度、淋巴结转移、SCC-Ag、Tim-4及PD-L1为宫颈癌患者预后不良的独立危险因素(P<0.05),见表4。

表3 影响宫颈癌预后的单因素分析[n(%)]

续表3
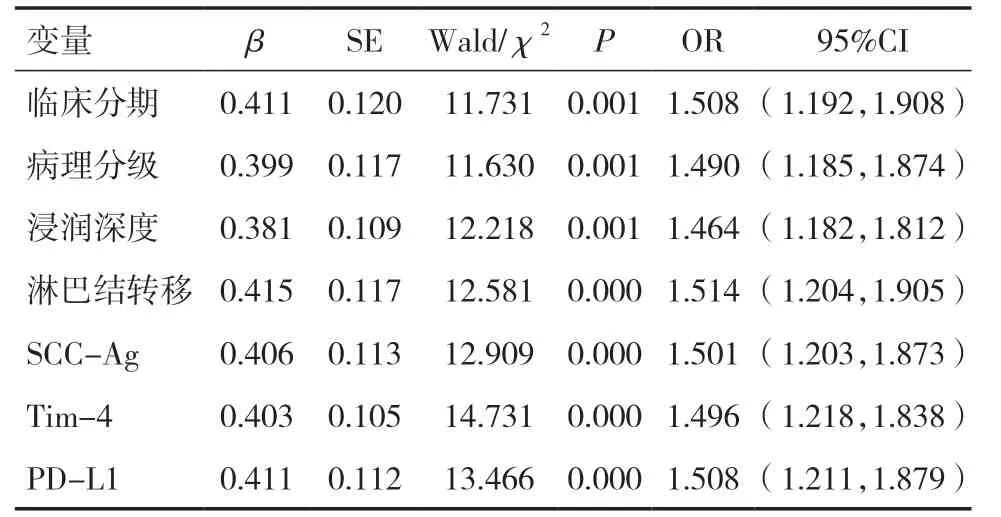
表4 影响宫颈癌预后的多因素分析
3 讨论
近年来,我国宫颈癌发病率呈逐渐上升趋势,且趋向年轻化。相关报道显示,我国每年新发病例约13万,占全世界宫颈癌新发病例的28%,且我国每年死于宫颈癌的患者约5万,严重威胁女性生命安全,故宫颈癌早期筛查对早发现、早治疗及预后具有重要意义[7,8]。
宫颈涂片和活检是早期检测宫颈癌的重要措施,而肿瘤标志物的检测在早发现及预测肿瘤预后中具有重要意义。SCC-Ag是诊断宫颈癌的敏感指标,其是分子量为42 000~48 000 的糖蛋白,由机体鳞癌细胞合成和分泌,参与细胞凋亡调控,主要存在于子宫、子宫颈等鳞状上皮细胞癌的细胞质内,当鳞状细胞癌变时其基因表达和调控异常,蛋白质合成紊乱,从而导致SCC-Ag 基因活化,大量合成并分泌入血,故SCC-Ag 呈高表达[9]。Tim 主要定位于染色体5q33.2 上,该染色体区域与自身免疫性疾病相关。Tim-4 基因是近年来发现的Tim家族成员,是新型免疫调节分子,主要表达于巨噬细胞等抗原提呈细胞中,特别是成熟巨噬细胞和树突状细胞表面。Tim-4 分子由378个氨基酸组成,在T细胞增殖和存活方面发挥重要作用。协同共刺激是近年来免疫学研究的热点,主要来自于免疫细胞表面分子的调节表达及其信号传导,在T细胞活化过程中具有重要作用[10]。研究发现,Tim-4 包含独特的Tim家族成员所缺少的Arg-Gly-Asp 序列,表面Tim-4表达可能与细胞迁移和黏附有关[11]。免疫球蛋白为协同刺激分子主要家族,包括B7-1/CD28 和CTLA 等,可通过刺激信号在免疫应答中调节应答持续时间和程度,以达到T细胞活化的调节平衡。PD-L1是协同抑制因子,属于B7/CD28 超家族成员,其表达于活化T细胞、B 细胞、单核细胞等多种细胞,可介导T细胞抑制信号,减弱机体抗肿瘤免疫反应,使肿瘤发生免疫逃逸并促进恶性肿瘤的发生、发展,阻断PD-L1 结合可加强并维持内源性抗肿瘤效应,进而控制肿瘤[12,13]。同时相关报道显示,宫颈癌患者血清SCC-Ag 水平高于CIN 患者[14]。本研究结果显示,宫颈癌组血清SCC-Ag、Tim-4、PD-L1水平均显著高于CIN组和对照组,提示血清SCC-Ag、Tim-4、PD-L1水平可作为早期鉴别宫颈癌和CIN 的有效指标,且CIN组血清PD-L1水平高于对照组,提示血清PD-L1水平可作为早期筛查CIN 的指标,但CIN组和对照组血清SCC-Ag、Tim-4水平比较差异无统计学意义,分析其原因可能与纳入病例数较少有关。
本研究进一步分析了血清SCC-Ag、Tim-4、PD-L1水平与临床病理特征的关系。结果显示,Ⅱa、Ⅱb分期、病理G3分期、浸润深度>1/2肌层、淋巴结转移及脉管浸润的宫颈癌患者血清SCC-Ag、Tim-4、PD-L1水平增高,说明SCC-Ag、Tim-4、PD-L1 参与宫颈癌的发生、发展,可能与肿瘤淋巴结转移有关。肿瘤的发生发展是多因素和基因共同作用的过程,而肿瘤细胞的侵袭和转移是影响肿瘤发生、发展的重要因素。既往研究表明,淋巴结转移是宫颈癌预后影响因子,无淋巴结转移的宫颈癌患者5年生存率高达90%,而淋巴结转移患者5年生存率为65%[15]。经COX回归分析显示,临床分期、病理分级、浸润深度、淋巴结转移、SCC-Ag、Tim-4及PD-L1为宫颈癌患者预后不良的独立危险因素,宫颈癌预后不良患者血清SCC-Ag、Tim-4、PD-L1水平升高,对诊断、病情监测和疗效判断具有一定的临床价值。由于高表达的SCC-Ag、Tim-4及PD-L1与受体相互作用后抑制肿瘤抗原特异性T淋巴细胞增殖和活化,进而诱导并维持T淋巴细胞对宫颈癌细胞免疫耐受,从而使癌细胞逃避机体免疫杀伤,得不到有效控制,致使增长甚至转移,故导致宫颈癌患者预后较差[16,17]。
综上所述,临床分期、病理分级、浸润深度、淋巴结转移、SCC-Ag、Tim-4及PD-L1 阳性表达是宫颈癌预后不良的危险因素,故监测血清SCC-Ag、Tim-4及PD-L1水平有利于判断患者预后,为治疗提供参考。但本研究纳入例数较少,对结果产生一定影响,下一步将扩大样本量并延长随访时间,进行前瞻性研究。
