肺癌免疫治疗:免疫抑制细胞和肺内免疫
2020-10-13何春明郑佳杰傅于捷赵晓菁
何春明,尹 航,郑佳杰,唐 健,傅于捷,赵晓菁
上海交通大学医学院附属仁济医院胸外科,上海 200127
经过过去10 年的研究,人们发现肿瘤免疫治疗具有广阔的应用前景。其中,免疫检查点通路的相关研究对肿瘤免疫治疗的发展起到了至关重要的作用[1]。免疫检查点如程序性死亡蛋白-1(programmed death-1,PD-1)、细胞毒性T 淋巴细胞相关蛋白4(cytotoxic T-lymphocyteassociated protein 4,CTLA-4)等可促使T 细胞丧失效能,从而关闭免疫应答。而应用这些免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)则可恢复T 细胞对肿瘤的免疫应答,继而改善患者的生存期[2]。尽管这些ICIs 被证明能够有效治疗肿瘤患者,但仍有多数患者存在治疗性耐药,导致肿瘤进展[3];究其原因,可能是由几种免疫抑制因子和细胞所代表的肿瘤免疫抑制微环境所致。例如,骨髓来源的抑制性细胞(myeloid-derived suppressor cells,MDSCs)与调节性T 细胞(regulatory cells,Tregs)可利用多种机制抑制抗肿瘤免疫,调节肿瘤免疫微环境(tumor immune microenvironment,TME)中的炎症反应,促进免疫系统向耐受和促进肿瘤生长的方向转换。近年来,已有越来越多的研究聚焦于上述因子的生物学特性,以探索新的肿瘤免疫治疗靶点。基于此,本文就免疫抑制细胞如MDSCs、Tregs 等的表型和功能特性进行综述,并结合肺内免疫特征探讨该类细胞在肺癌免疫治疗中的靶向策略。
1 MDSCs 的一般生物学特性和临床应用
在长期炎症刺激或肿瘤环境下,骨髓细胞的正常分化和成熟过程被阻断,从而以MDSCs 形式在机内大量聚集(图1)。 有证据表明,MDSCs 是免疫抑制肿瘤微环境的主要驱动因素[4]。在小鼠中,MDSCs 被分为2 个亚群:CD11b+Ly6GLy6Chigh单核MDSCs(monocytic MDSC,MO-MDSCs)和 CD11b+Ly6GhighLy6Clow多核MDSCs(polymorphonuclear MDSC,PMN-MDSCs)[5]。而在人体中,MO-MDSCs 被定义为Lin-CD11b+CD14+CD15-HLA-DR-/low,PMN-MDSCs被定义为Lin-CD11b+CD14-CD15+HLA-DR-或Lin-CD11b+CD14-CD66b+[5-6]。MDSCs 的生成过程分为富集和激活 2 个阶段,前者是通过阻止未成熟的髓细胞最终分化为粒细胞、巨噬细胞和树突状细胞(dendritic cell,DC)而介导,其中粒细胞-巨噬细胞集落刺激因子(granulocytemacrophage colony stimulating factor,GM-GSF)和血管内皮生长因子(vascular endothelial growth factor,VEGF)发挥主要作用;后者是由长期分泌的细胞因子如白介素6(interleukin 6,IL-6)、IL-10、IL-1β,干扰素γ (interferon-γ,IFN-γ)和Toll 样受体(Toll-like receptors,TLR)的配体等介导,如慢性炎症下产生的损伤相关模式分子[7]。
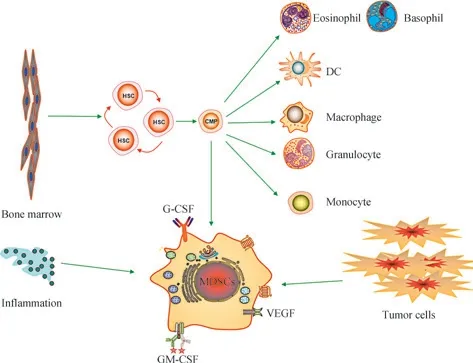
图1 肿瘤/炎症刺激下的骨髓细胞分化Fig 1 Differentiation of bone marrow cells stimulated by tumor/inflammation
1.1 MDSCs 的功能
激活的MDSCs 可通过诱导型一氧化氮合酶上调精氨酸酶-1 的表达,耗竭T 细胞活化代谢所必需的L-精氨酸;也可通过下调T 细胞受体ζ-链的表达来诱导T 细胞功能丧失[4,8]。MDSCs 还可通过产生一氧化氮(nitric oxide,NO)损害自然杀伤细胞的功能,并刺激肿瘤血管生成和肿瘤基质细胞生长等[9]。同时,MDSCs 亦可通过分泌基质金属蛋白酶介导细胞外基质和基底膜的完整性降低,使肿瘤细胞更容易进入血液循环系统,从而形成转移灶[10]。
1.2 针对MDSCs 与ICIs 的治疗策略
免疫抑制性受体的配体在肿瘤细胞上表达丰富,这一特性与Tregs 和MDSCs 免疫抑制细胞的肿瘤浸润起协同作用,帮助肿瘤逃避T 细胞的免疫应答。阻遏免疫抑制性受体与配体结合、减少免疫抑制细胞数量可增强肿瘤患者的免疫反应,减弱TME 中免疫抑制因子的作用,从而促进免疫细胞激活和对肿瘤的免疫应答。
近年来,针对免疫抑制细胞的相关特性联合ICIs 的治疗方法极大地改善了肿瘤免疫治疗的效果。目前,针对MDSCs 的治疗策略大致可分为4 类,包括 MDSCs 失活、抑制髓性细胞向MDSCs 分化、促进MDSCs 向成熟细胞分化和MDSCs 耗竭。这些治疗策略旨在恢复正常的严格调控的造血细胞分化过程,即根据免疫抑制的特点,阻止MDSCs 募集到TME,从而加强宿主的免疫反应,改善免疫治疗的效果。如全反式维甲酸(alltrans retinoic acid,ATRA)阻断维甲酸信号转导,导致MDSCs 在小鼠和人类细胞中分化为巨噬细胞和DC,有着较好的应用前景[11]。MDSCs 的相关抗体及作用机制见 表1。

表1 近年来有关MDSCs 的抗体及作用机制研究Tab 1 Study on the antibody and mechanism of MDSCs in recent years
目前,越来越多的靶向MDSCs 联合ICIs 治疗方案应用于临床前的肿瘤模型和癌症患者。ENT 是Ⅰ类HDACI(组蛋白去乙酰化酶抑制剂),被证明可抑制MDSCs 的抑制活性。如在Lewis 肺癌和肾细胞癌小鼠模型中,与单纯的抗PD-1 治疗相比,ENT 联合PD-1 阻断MDSCs 的抑制活性可显著提高小鼠的生存率[14-15]。另有研究[16]发现,吉西他滨(gemcitabine)和5-氟尿嘧啶可广泛应用于恶性肿瘤的化学治疗,这可能是与二者均可以通过诱导细胞凋亡来增强免疫应答等实现对MDSCs 的抑制相关。
2 Tregs 的一般生物学特性和临床应用
Tregs 是CD4+T 细胞的一个免疫抑制亚群,其特征是转录因子叉头框蛋白P3(forkhead box protein P3,FOXP3)的高度表达,是免疫系统的一个重要组成部分。Tregs 具有免疫抑制特性,对维持生物体内的免疫稳态至关重要[17]。根据其产生和发展的部位的不同,Tregs 被分为2 种亚型:①胸腺来源的Tregs(thymic-derived Tregs,tTregs),是在胸腺中成熟的T 细胞中的一类亚群,在免疫抑制中具有特殊作用。②诱导型Tregs(induced Tregs,iTregs),在一定条件下由传统T 细胞(conventional T cell,Tconv)分化而来[18],如图2 所示。目前,我们对于tTregs 的发生、发展并没有完全理解,更多的数据和结论均来源于动物实验。其中,Tregs 在胸腺T 细胞亚群中的筛选和成熟机制与其表面特异的T 细胞受体(T-cell receptor,TCR)以及FOXP3 的产生和稳定表达有关,人白细胞分化抗原 25(cluster of differentiation 25,CD25)[即IL-2 受体(IL-2 receptor,IL-2R)亚单位α]、信号转导与转录活化因子5、保守非编码序列2 承担了重要作用。另外,通过对Tconv 和Tregs 的全基因组测序进行分析比较发现,Tregs 特异性的DNA 低甲基化基因编码的蛋白在Tregs 中表达,并具有免疫抑制功能,包括FOXP3、IKAROS 家族锌指蛋白4(IKAROS family zinc finger 4,IKZF4,也称EOS)和CTLA-4 等[19]。
2.1 Tregs 的功能
Tregs 通过多种细胞和体液机制发挥免疫抑制作用:①CTLA-4+肿瘤浸润Tregs 通过抑制抗肿瘤免疫、下调CD80/86 分子在抗原提呈细胞(antigen-presenting cells,APC)上的表达,促进肿瘤免疫逃避。②其能够促使ATP转化为腺苷[20],后者可作为一种免疫调节代谢物,阻止T 细胞活化。③其可产生免疫抑制细胞因子,如IL-10、 IL-35 和肿瘤生长因子β。④其分泌的颗粒酶和穿孔素能够破坏效应T 细胞。⑤其可抑制高内皮细胞微静脉的发育,而该微静脉在淋巴细胞归巢中起着十分重要的 作用[21]。
2.2 针对Tregs 与ICIs 的治疗策略

图2 Tregs 的分化过程Fig 2 Differentiation of Tregs
针对Tregs 的靶向治疗方法已被报道了很多,如Tregs耗竭、抑制Tregs 功能、阻断TME 对Tregs 的募集、抑制Tregs 细胞的生成等。对于所有的治疗方法,其主要的治疗目标是TME 中的特异性Tregs 而非外周循环中的Tregs,从而降低自身免疫性疾病的风险。
阻断Tregs 向TME 中迁移或耗竭外周循环中异常增高的有免疫抑制功能的Tregs,会将成为未来的研究方向。已有研究[22]证明,具有强免疫抑制活性的Tregs 亚群可表达CC 趋化因子受体4(CC chemokine receptor 4, CCR4),并存在于黑色素瘤患者的血液中,且这些细胞在肿瘤组织中高度富集。Mogamulizumab 作为一种抗CCR4 的单克隆抗体,于2012 年在日本被批准应用于治疗表达CCR4 的成人T 细胞白血病和/或淋巴瘤(adult T-cell leukemia/lymphoma,ATLL)患者[22]。一项涉及136 例肺癌或食管癌患者的Ⅰa 期临床研究[23]发现,Mogamulizumab 安全且耐受性良好,未观察到剂量限制性毒性(dose limited toxicity,DLT)。此外,亦有研究[24]表明,即使使用最低剂量的Mogamulizumab 也能显著减少外周循环中有免疫抑制功能的Tregs 数量。Tregs 的相关抗体及作用机制见表2。

表2 近年来有关Tregs 的抗体及作用机制研究Tab 2 Study on the antibody and mechanism of Tregs in recent years
肿瘤浸润的Tconv 和Tregs 可在TME 中表达类似的免疫检查点分子,包括CTLA-4 和PD-1;继而表明针对这些蛋白的抗体可影响这2 种细胞类型,同时也使得应用ICIs 的情况变得更加复杂。应用抗CTLA-4 单克隆抗体初期的设想是将假设功能失调的表达CTLA-4 的Tconv 重新活化。然而,目前几项临床前研究[28]的证据表明,这些药物的抗肿瘤作用依赖TME 中Tregs 的耗尽,从而使CD8+T 细胞与Tregs 的比率增加。而有关PD-1 抑制剂与Tregs 的相互作用尚不清楚。PD-1 通过抑制TCR 和共刺激CD28 信号抑制Tconv 的过度激活,使其功能失调或耗尽。鉴于TME 中的Tregs 与Tconv 的PD-1 表达水平相当,且Tregs 需依赖于TCR 和CD28 信号维持其生存和功能,因此PD-1 的抑制剂或可增强 Tregs 的免疫抑制功能。事实上,2018 年有报道[29]显示,在使用抗PD-1 的单克隆抗体nivolumab 治疗胃癌患者的过程中,患者出现的疾病超进展(hyper-progressive disease,HPD)现象与TME 中CD45RA-FOXP3highCD25highCD4+Tregs 明显增多有关,而无HPD 现象的患者Tregs 增殖程度不高。因此,PD-1 可能对肿瘤中Tregs 介导的免疫抑制有负作用,继而表明在使用PD-1 抗体治疗期间,监测肿瘤浸润Tregs 群十分 重要。
3 其他免疫抑制细胞
CD45+红系前体细胞(CD45+erythroid progenitor cells,CD45+EPCs)是由我国Zhao 等[30]在研究晚期肺癌患者中首次发现。由于晚期肺癌患者贫血导致相关骨髓外造血的发生,其可诱导细胞群在脾脏内聚集,该细胞数量超过了Tregs 和MDSCs,且其转录组与MDSCs 非常相似。与MDSCs 一样,活性氧的产生是CD45+EPCs 介导免疫抑制的主要机制。这些发现表明,该细胞群可能是导致晚期癌症患者常见的T 细胞反应受损的一个重要原因。此外,在目前已知M1 型和M2 型巨噬细胞中,与M1型巨噬细胞常分泌引起的辅助性T 细胞( helper T cells,Th) 1 型免疫反应的细胞因子不同,M2 型巨噬细胞则常分泌引起Th2 型免疫反应的细胞因子[31]。Lambrechts 等[32]运用单细胞RNA 测序技术(single cell RNA sequencing,scRNA-seq)深度解析了肺癌TME 中除癌细胞以外的细胞群落,展示了肿瘤来源和非恶性肺源性的巨噬细胞间的区别;同时,还观察到在肿瘤来源的巨噬细胞中的强烈炎症反应、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)诱导下,细胞增殖和细胞活性氧产生途径均明显减少,这是小鼠癌症模型中描述的M2 样的特征[33];继而提示,M2型巨噬细胞在肺癌TME 中发挥了较为重要的作用。
4 肺内免疫与ICIs
肺微环境中独特的免疫细胞参与形成了外部环境和内部组织之间的屏障,如由上皮细胞-巨噬细胞组成的呼吸系统第一道防线和由记忆T 细胞、肺先天性淋巴细胞、Tregs、γδT 细胞和DC 形成第二道防线[34]。肺在呼吸过程中持续暴露于外源性无机和有机微粒,且早在胚胎形成时,肺即与微生物共生共存。由于人体终身暴露于含有不同病毒、细菌以及真菌的环境下,我们的肺部环境也因此做出了相应的调整,该适应性改变则为ICIs 的个体化治疗带来了挑战。对于免疫抑制细胞而言,不同的微生物群落会导致肺内该细胞的组成发生变化,因此对于ICIs 的抵抗也有所不同,这可能是现有大规模研究所获结果存在争议甚至矛盾的一个重要原因。此外,肺稳态中的免疫细胞并不是单一发挥促进免疫或抑制免疫的作用,更多的是具有两面性,例如中性粒细胞就是一个典型的例子。在肺癌早期,肿瘤浸润性中性粒细胞可通过抗原提呈刺激T 细胞,这些APC 样中性粒细胞由未成熟的粒细胞在IFN-γ 和GM-CSF 的作用下分化而来,并提呈抗原刺激效应T 细胞反应[35];但在肺癌晚期,特别是中性粒细胞大量募集至TME 时,其更多的是发挥免疫抑制作用,甚至促进肿瘤转移。值得注意的是,MDSCs 在这个方面是否代表一个独特的谱系,或是否具有特定免疫抑制功能的中性粒细胞,也是一个有争议的科学问题。在肺的免疫稳态中,越来越多的证据表明,自出生时起人的肺组织中即存在Tregs,其表型直接受周围微生物群的影响[36],且对空气中颗粒的免疫耐受的维持至关重要。简单地来说,Treg可对有害的颗粒产生炎症,而对无害颗粒表现耐受。这类天然驻肺的Tregs 对于肺癌的直接或间接作用,以及免疫抑制药物对其数量的减少可能引起的并发症(如呼吸道变态反应)等,都将是未来研究肺癌免疫的重点。
5 总结与展望
肿瘤ICIs 已被批准应用于治疗黑色素瘤、非小细胞肺癌、肾癌、膀胱癌、头颈部癌、默克尔细胞癌、胃癌和霍奇金淋巴瘤等,可显著提高患者的临床疗效。然而,初始反应或完全缺乏反应后对ICIs 的抗性仍然是一个问题。免疫抑制细胞为肺癌的免疫治疗提供了新的策略,需要我们进行广泛的探索。目前,一些针对免疫抑制细胞的靶向治疗方法正在研究中,主要是与ICIs 联合应用。但上述研究也存在许多问题,比如选择性靶向Tregs 的困难,特别是靶向药物是否会选择性地消耗癌症患者TME 中的Tregs等。同时,关于免疫因子抑制,检查点蛋白表达,Tregs、肿瘤相关巨噬细胞和MDSCs 的增殖等多种抑制机制协同作用所形成的免疫抑制网络的研究仍然较少。而通过对MDSCs 的深入了解,我们知道MDSCs 的低水平或缺失均可改善ICIs 的疗效,因此将肿瘤患者的MDSCs 水平作为启动ICIs 治疗的先决条件可能被认为是一种可行的策略。未来,通过确定关键机制和上游信号以及寻找其特异性靶点,或将为获得更有效的肿瘤免疫治疗效果提供支持。同时,对于肺的独特微环境的深入研究,包括分析成长因素、地域特点、治疗前的肺组织取样分析和对肺癌TME的全面免疫分析等,或将为建立个体患者的免疫精准治疗方案提供帮助。
参·考·文·献
[1] Nirschl CJ, Drake CG. Molecular pathways: coexpression of immune checkpoint molecules: signaling pathways and implications for cancer immunotherapy[J]. Clin Cancer Res, 2013, 19(18): 4917-4924.
[2] Wolchok JD, Saenger Y. The mechanism of anti-CTLA-4 activity and the negative regulation of T-cell activation[J]. Oncologist, 2008, 13(Suppl 4): 2-9.
[3] Hodi FS, O'Day SJ, McDermott DF, et al. Improved survival with ipilimumab in patients with metastatic melanoma[J]. N Engl J Med, 2010, 363(8): 711- 723.
[4] Parker KH, Beury DW, Ostrand-Rosenberg S. Myeloid-derived suppressor cells: critical cells driving immune suppression in the tumor microenvironment[J]. Adv Cancer Res, 2015, 128: 95-139.
[5] Bronte V, Brandau S, Chen SH, et al. Recommendations for myeloid-derived suppressor cell nomenclature and characterization standards[J]. Nat Commun, 2016, 7: 12150.
[6] Solito S, Marigo I, Pinton L, et al. Myeloid-derived suppressor cell heterogeneity in human cancers[J]. Ann N Y Acad Sci, 2014, 1319: 47-65.
[7] Veglia F, Perego M, Gabrilovich D. Myeloid-derived suppressor cells coming of age[J]. Nat Immunol, 2018, 19(2): 108-119.
[8] Baniyash M. TCR ζ-chain downregulation: curtailing an excessive inflammatory immune response[J]. Nat Rev Immunol, 2004, 4(9): 675-687.
[9] Shen P, Wang AJ, He MY, et al. Increased circulating Lin-/lowCD33+HLADR-myeloid-derived suppressor cells in hepatocellular carcinoma patients[J]. Hepatol Res, 2014, 44(6): 639-650.
[10] Baniyash M. Myeloid-derived suppressor cells as intruders and targets: clinical implications in cancer therapy[J]. Cancer Immunol Immunother, 2016, 65(7): 857-867.
[11] Iclozan C, Antonia S, Chiappori A, et al. Therapeutic regulation of myeloidderived suppressor cells and immune response to cancer vaccine in patients with extensive stage small cell lung cancer[J]. Cancer Immunol Immunother, 2013, 62(5): 909-918.
[12] Serafini P, Meckel K, Kelso M, et al. Phosphodiesterase-5 inhibition augments endogenous antitumor immunity by reducing myeloid-derived suppressor cell function[J]. J Exp Med, 2006, 203(12): 2691-2702.
[13] Hong D, Kurzrock R, Kim Y, et al. AZD9150, a next-generation antisense oligonucleotide inhibitor of STAT3 with early evidence of clinical activity in lymphoma and lung cancer[J]. Sci Transl Med, 2015, 7(314): 314ra185.
[14] Orillion A, Hashimoto A, Damayanti N, et al. Entinostat neutralizes myeloidderived suppressor cells and enhances the antitumor effect of PD-1 inhibition in murine models of lung and renal cell carcinoma[J]. Clin Cancer Res, 2017, 23(17): 5187-5201.
[15] Shen L, Ciesielski M, Ramakrishnan S, et al. Class Ⅰ histone deacetylase inhibitor entinostat suppresses regulatory T cells and enhances immunotherapies in renal and prostate cancer models[J]. PLoS One, 2012, 7(1): E30815.
[16] Vincent J, Mignot G, Chalmin F, et al. 5-Fluorouracil selectively kills tumorassociated myeloid-derived suppressor cells resulting in enhanced T celldependent antitumor immunity[J]. Cancer Res, 2010, 70(8): 3052-3061.
[17] Sakaguchi S, Sakaguchi N, Asano M, et al. Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor α-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases[J]. J Immunol, 1995, 155(3): 1151-1164.
[18] Sakaguchi S, Miyara M, Costantino CM, et al. FOXP3+regulatory T cells in the human immune system[J]. Nat Rev Immunol, 2010, 10(7): 490-500.
[19] Ohkura N, Hamaguchi M, Morikawa H, et al. T cell receptor stimulationinduced epigenetic changes and Foxp3 expression are independent and complementary events required for Treg cell development[J]. Immunity, 2012, 37(5): 785-799.
[20] Deaglio S, Dwyer KM, Gao WD, et al. Adenosine generation catalyzed by CD39 and CD73 expressed on regulatory T cells mediates immune suppression[J]. J Exp Med, 2007, 204(6): 1257-1265.
[21] Colbeck EJ, Jones E, Hindley JP, et al. Treg depletion licenses T cell-driven HEV neogenesis and promotes tumor destruction[J]. Cancer Immunol Res, 2017, 5(11): 1005-1015.
[22] Sugiyama D, Nishikawa H, Maeda Y, et al. Anti-CCR4 mAb selectively depletes effector-type FoxP3+CD4+regulatory T cells, evoking antitumor immune responses in humans[J]. Proc Natl Acad Sci U S A, 2013, 110(44): 17945-17950.
[23] Kurose K, Ohue Y, Wada H, et al. Phase Ⅰ a study of FoxP3+CD4 Treg depletion by infusion of a humanized anti-CCR4 antibody, KW-0761, in cancer patients[J]. Clin Cancer Res, 2015, 21(19): 4327-4336.
[24] Doi T, Muro K, Ishii H, et al. A phase Ⅰ study of the Anti-CC chemokine receptor 4 antibody, mogamulizumab, in combination with nivolumab in patients with advanced or metastatic solid tumors[J]. Clin Cancer Res, 2019, 25(22): 6614-6622.
[25] Onizuka S, Tawara I, Shimizu J, et al. Tumor rejection by in vivo administration of anti-CD25 (interleukin-2 receptor α) monoclonal antibody[J]. Cancer Res, 1999, 59(13): 3128-3133.
[26] Abbas AK, Trotta E, Simeonov DR, et al. Revisiting IL-2: biology and therapeutic prospects[J]. Sci Immunol, 2018, 3(25): EAAT1482.
[27] Roland CL, Lynn KD, Toombs JE, et al. Cytokine levels correlate with immune cell infiltration after anti-VEGF therapy in preclinical mouse models of breast cancer[J]. PLoS One, 2009, 4(11): E7669.
[28] Simpson TR, Li FB, Montalvo-Ortiz W, et al. Fc-dependent depletion of tumorinfiltrating regulatory T cells co-defines the efficacy of anti-CTLA-4 therapy against melanoma[J]. J Exp Med, 2013, 210(9): 1695-1710.
[29] Marks KM, West NP, Morris E, et al. Clinicopathological, genomic and immunological factors in colorectal cancer prognosis[J]. Br J Surg, 2018, 105(2): E99-E109.
[30] Zhao LT, He R, Long HX, et al. Late-stage tumors induce anemia and immunosuppressive extramedullary erythroid progenitor cells[J]. Nat Med, 2018, 24(10): 1536-1544.
[31] Tugal D, Liao XD, Jain MK. Transcriptional control of macrophage polarization[J]. Arterioscler Thromb Vasc Biol, 2013, 33(6): 1135-1144.
[32] Lambrechts D, Wauters E, Boeckx B, et al. Phenotype molding of stromal cells in the lung tumor microenvironment[J]. Nat Med, 2018, 24(8): 1277-1289.
[33] Biswas, SK, Gangi L, Paul S, et al. A distinct and unique transcriptional program expressed by tumor-associated macrophages (defective NF-κB and enhanced IRF-3/ STAT1 activation)[J]. Blood, 2006, 107(5): 2112–2122.
[34] Lloyd CM, Marsland BJ. Lung homeostasis: influence of age, microbes, and the immune system[J]. Immunity, 2017, 46(4): 549-561.
[35] Singhal S, Bhojnagarwala PS, O'Brien S, et al. Origin and role of a subset of tumor-associated neutrophils with antigen-presenting cell features in early-stage human lung cancer[J]. Cancer Cell, 2016, 30(1): 120-135.
[36] Gollwitzer ES, Saglani S, Trompette A, et al. Lung microbiota promotes tolerance to allergens in neonates via PD-L1[J]. Nat Med, 2014, 20(6): 642-647.
