组蛋白乙酰化在IgA 肾病发病中的作用
2020-10-13王伟铭
戴 芹,王伟铭
1. 复旦大学附属中山医院徐汇医院肾内科,上海 200031;2.上海交通大学医学院附属瑞金医院肾内科,上海 200025
IgA 肾病(IgA nephropathy,IgAN)是全世界最常见的肾小球疾病,也是引起肾衰竭的重要病因[1],IgAN 更是导致年轻人终末期肾病的最常见原因[2]。半乳糖缺乏的IgA1(galactose deficient IgA1,Gd-IgA1)是导致IgAN 最关键的致病因素,血浆Gd-IgA1 被认为是能够预测IgAN预后的重要指标,是IgAN 重要的早期诊断和临床预后生物学标志物[3]。但是,Gd-IgA1 产生的机制目前仍不清楚。表观遗传学在疾病发病中的作用受到日益关注,赖氨酸残基的翻译后乙酰化已成为所有真核生物中的关键调节机制[4]。为此,本研究从组蛋白乙酰化角度探索IgAN 的发病机制。
1 对象与方法
1.1 研究对象
纳入2014 年1 月—2018 年12 月于上海交通大学医学院附属瑞金医院肾内科住院的IgAN 患者30 例。纳入标准:①新确诊的原发性IgAN 患者。②之前从未用过激素、免疫抑制剂等治疗。③年龄15 ~65 岁。④ 慢性肾脏病(chronic kidney disease,CKD)1 ~4 期的患者。排除标准: ① 因肿瘤、高血压、代谢性疾病(如糖尿病)、乙肝、自身免疫性疾病(如红斑狼疮、甲亢等)、遗传性肾病、系统性血管炎等继发性因素引起者。② 肝功能指标异常者。③ 妊娠或哺乳期妇女。④有感染或应激情况存在者。⑤ 严重心血管疾病如心功能不全、恶性高血压、心律失常者。⑥ CKD5 期及已经肾替代治疗者。研究获得医院伦理委员会批准(批号为No.2013-29),所有研究对象均签署知情同意书。
1.2 材料、试剂与仪器
1.2.1 材料 IgAN 组血液样本来源于医院住院患者,对照组的血液样本来自瑞金医院体检中心的健康者。收集IgAN 患者(30 例)及对照组(血样本16 例)外周血各15 mL 至肝素抗凝管。常温1 500×g 离心15 min 后的沉淀物用磷酸缓冲盐溶液(phosphate buffer saline,PBS)1:1 稀释后充分混匀,用Ficoll 法[5]分离外周血单个核细胞,将单个核细胞(peripheral blood mononuclear cell,PBMC)约4×106/管,分装至500μL EP 管中。
IgAN 组肾组织来自于医院肾内科的患者经皮肾穿刺标本,对照组肾组织样本来源于泌尿外科肾癌患者(3例)经手术切除后留取的癌旁正常肾组织。
1.2.2 主要试剂 RNA(Trizol)提取液(美国Invitrogen),qRT-PCR 逆转录试剂盒(美国Invitrogen),人外周血淋巴细胞分离液(上海普飞),AxyPrep PCR 纯化试剂盒(美国Axygen),染色质免疫共沉淀试剂盒(美国Millipore),组蛋白H3 乙酰化水平检测试剂盒 (美国EPIGENTEK),组蛋白H4 乙酰化水平检测试剂盒 (美国EPIGENTEK),cy3-山羊抗兔(英国Abcam),488-Alex-山羊抗小鼠(英国Abcam),抗HDAC1 抗体(CHIP 级,英国Abcam),抗H3Ac 抗体(ChIP 级,英国Abcam),抗H4Ac 抗体(CHIP 级,英国Abcam),EpiQuik ™ 总的组蛋白提取试剂盒(美国Epigentek),蛋白酶K(上海生工),RNase A(上海生工),蛋白酶抑制剂复合物(上海生工),PCR 引物均由铂尚生物技术(上海)有限公司合成,其他试剂均为分析纯产品。
1.2.3 仪器 低温离心机(德国Eppendorf),台式微量高速离心机(德国Eppendorf),纯水机(美国Millipore),酶标仪(美国Bio-Rad),倒置相差显微镜及计算机成像系统(日本尼康),梯度PCR 仪(美国 MJ-research),Opticon 2 荧光实时定量PCR 仪(美国 Bio-Rad),石蜡切片机(德国Leica),微量核酸蛋白定量仪 NanoDrop ND-1000(美国 NanoDrop)。
1.3 方法
1.3.1 提取组蛋白 从-80 ℃冰箱中取出1 管“1.2.1”制备的PBMC,冰上熔化;预裂解液裂解10 min 后低温离心1 min,弃去上清;用100 μL 的裂解液重悬细胞,冰孵30 min;超声破碎仪10 Hz 超声10 s;低温离心1 min,收集上清(含有酸溶解的蛋白)至1 支新的EP 管内;立即加30 μL 的DTT 平衡液至上清中,将提取的组蛋白分装后于-80 ℃冰箱保存。
1.3.2 ELISA 法检测 将“1.3.1”提取的组蛋白按照试剂盒的说明书步骤调节浓度,设立空白对照孔、阳性对照孔及样品检测孔,依次加入一抗、二抗,最后显色,观察到样本孔及标准品孔变蓝,每孔加入50μL 终止液终止反应,在酶标仪450 nm 波长处读各孔的OD 值。


表1 Real-time PCR 引物序列Tab 1 Primer sequence for real-time PCR
1.3.4 染色质免疫共沉淀 染色质免疫共沉淀法(chromatin immunocoprecipitation,ChIP)用于检测各种组蛋白修饰相关的基因组的特定位点,提示组蛋白修饰的对象。甲醛交联活细胞的蛋白质和相关的染色质后裂解,染色质-蛋白复合体经超声打断或酶切为约500bp 的DNA 片段,分别用抗H3Ac 抗体和H4Ac 抗体将目的蛋白-染色质复合体从细胞碎片中分离出来,纯化、分离出DNA 片段,测定其序列,获得蛋白质与DNA 相互作用的信息。
1.3.5 ChIP-qPCR 检测 ChIP-qPCR 检测半乳糖基转移酶(core 1β1,3-galactosyltransferase,C1GALT1)和唾液酸转移酶(α-N-acetylgala-ctosaminide α-2,6-sialyltransferase 2,ST6GALNAC2)启动子区H3 和H4 乙酰化水平:使用基因启动子区特异的引物扩增C1GALT1 和ST6GALNAC2启动子区域,以10μL 体系进行real time-PCR 扩增,以对应的input 为对照。每次实验设3 个复孔,重复3 次。启动子区引物序列见表2。

表2 C1GALT1 和ST6GALNAC2 启动子区域引物序列Tab 2 Primer sequence of promoter region of C1GALT1 and ST6GALNAC2
1.3.6 组织免疫荧光检测 IgAN 组和对照组肾组织样本的石蜡切片脱蜡至水后抗原修复,分别加一抗(抗HDAC1 抗体、抗H3Ac 抗体),切片平放于湿盒内4 ℃孵育过夜;加二抗,避光室温孵育60 min,将玻片置于PBS中在摇床上洗3 次,5 min/次;4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)复染细胞核,避光室温孵育10min 后洗3 次,5min/次。切片稍干后用抗荧光淬灭封片剂封片。切片于倒置相差显微镜下观察并采集图像。
1.4 统计学方法
采用 SPSS16.0 统计软件分析数据,采用GraphPad Prism5.0 软件作图。符合正态分布的定量资料用x—±s 表示,非正态分布的定量资料用M(Q1,Q3)表示,定性资料用n(%)表示。采用t 检验和χ2检验进行比较。P<0.05 为差异有统计学意义。
2 结果
2.1 研究对象的基本特征
研究纳入IgAN 组及对照组。IgAN 组为医院收治的IgAN 患者30 例;血液样本的对照组为16 例体检健康者,肾组织样本的对照组为3 例肾癌患者手术切除的癌旁正常肾组织。研究对象的基本特征见表3。
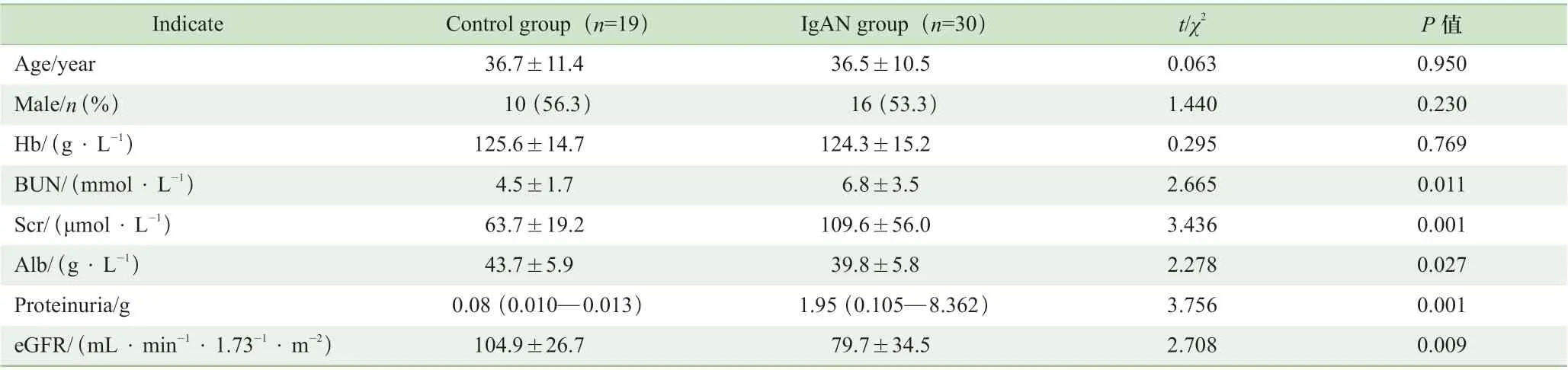
表3 研究对象的基本特征比较 Table 3 Comparison of basic characteristics of the experimental groups
2.2 组蛋白乙酰化修饰比较
2 组PBMC 中组蛋白乙酰化修饰的比较结果见表4。与对照组相比,IgAN 组组蛋白H3 乙酰化水平明显升高(P=0.035),H4 乙酰化水平明显升高(P=0.012)。

表4 IgAN 组与对照组的PBMC 组蛋白乙酰化修饰Tab 4 Level of acetylation of histone in PBMC of IgAN group and control group
2.3 HAT、HDAC 及糖基化酶mRNA 比较

图1 2 组乙酰化相关酶及糖基化酶mRNA 表达Fig 1 mRNA expression of acetylation related enzyme and glycosylation enzyme in two groups
2 组研究对象的组蛋白乙酰化相关酶HAT、HDAC 及糖基化酶mRNA 比较结果见图1,real-time PCR 结果显示:IgAN 组组蛋白乙酰基转移酶P300、CREBBP mRNA的表达分别是对照组的(2.81±0.39)倍(P=0.002),(2.44±0.27)倍(P=0.001),见图1A;组蛋白去乙酰化酶HDAC1、HDAC2、HDAC3、HDAC7 和HDAC8 mRNA的表达分别是对照组的(2.20±0.18)倍(P=0.001),(0.44±0.08)倍(P=0.035),(0.98±0.18)倍(P=0.690),(1.02±0.21)倍(P=0.924),(1.47±0.25)倍(P=0.045),见图1B;IgAN 组C1GALT1 mRNA 的表达是对照组的(0.28±0.06)倍(P=0.008),ST6GALNAC2 的mRNA 表达是对照组的(2.88±0.60)倍(P=0.012),见图1C。
2.4 C1GALT1 和ST6GALNAC2 启动子区组蛋白H3 和H4 乙酰化水平
用ChIP 法检测基因启动子区乙酰化水平,结果见图2。 对“1.3.4”方法获得的DNA 样本及各自的Input 使用引物扩增C1GALT1 和ST6GALNAC2 启动子区域,结果显示:与对照组相比,IgAN 组C1GALT1 基因启动子区域组蛋白H3 和H4 乙酰化程度降低,分别为[ (0.43±0.12)vs(1.00±0.16),P=0.043] 和[ (0.62±0.06)vs(1.07±0.05),P=0.005]; ST6GALNAC2 基因启动子区域组蛋白H3 和H4 乙酰化程度均显著升高,分别为[(3.42±0.76)vs(1.00±0.21),P=0.038]和[(2.07±0.17)vs(1.10±0.20),P=0.021]。

图 2 C1GALT1 和ST6GALNAC2 启动子区组蛋白H3 和H4 乙酰化水平Fig 2 H3/H4 acetylation at the C1GALT1 and ST6GALNAC 2 gene promotor region
2.5 肾组织HDAC1 和H3Ac 蛋白表达情况
IgAN 患者肾组织与对照组的正常肾组织比较结果见图3。结果显示,正常肾组织肾小管以及肾小球间质中HDAC1 表达都很少,而H3Ac 蛋白在肾小管和肾小球表达都较多。与癌旁正常肾组织相比,IgAN 组肾小球及肾小管中HDAC1 表达明显增多,而H3Ac 蛋白表达显著减少,肾组织呈低乙酰化状态。

图3 IgAN 组与正常肾组织中HDAC1 和H3Ac 蛋白表达情况(免疫荧光染色)Fig 3 Expression of HDAC1and H3Ac protein in renal tissue (IF)
3 讨论
IgAN 是最常见的肾脏疾病,以肾小球区IgA 沉积为特征[6]。研究[7]发现在IgAN 患者冷冻肾组织中均含有Gd-IgA1 特异性IgG 自身抗体,这一发现提示了Gd-IgA1在IgAN 发病机制中的重要性,但IgAN 发病机制至今尚未清晰。组蛋白乙酰化修饰是表观遗传学的重要作用机制之一,组蛋白乙酰化和去乙酰化修饰在肾脏的发育和肾脏疾病的发生过程中也起着多重作用[8-10]。本研究检测了IgAN 患者及健康对照者PBMC 中组蛋白乙酰化水平变化,以及组蛋白乙酰化修饰酶mRNA 表达变化。研究发现IgAN 患者组蛋白H3 和H4 乙酰化水平较健康对照组均显著升高,提示组蛋白乙酰化参与了IgAN 的发病过程。组蛋白乙酰化和去乙酰化受组蛋白乙酰化相关酶HAT和HDAC 调控。HAT 的主要作用是“打开”染色质结构,促进基因的转录。HDAC 是一类通过去除组蛋白(和非组蛋白的蛋白)赖氨酸ε-氨基上的乙酰化基团,引起染色质结构凝聚从而抑制基因表达的蛋白[11-12]。染色质通过其相对“打开”和“关闭”的形式调控着基因的表达[13]。
本研究应用real-time PCR 法检测了2 组研究对象PBMC 中HAT 和HDAC 的mRNA 表达水平。结果显示IgAN 组HAT 均出现了显著上调,组蛋白去乙酰化酶HDAC1 和HDAC8 mRNA 的表达显著上调,HDAC2 mRNA 的表达显著下调。由此可见,IgAN 患者PBMC 中 H3 和H4 乙酰化水平升高是HAT 和HDAC 共同调控的结果。为了明确IgAN 肾组织乙酰化修饰情况,我们应用组织免疫荧光技术检测了肾小球中HDAC1 和H3Ac 的蛋白表达。研究发现正常肾组织中肾小球中HDAC1 表达很少,而H3Ac 蛋白表达较多。与正常肾组织相比,IgAN患者的肾小球中HDAC1 明显上调,而H3Ac 蛋白显著减少,呈低乙酰化状态。由此可见,组蛋白乙酰化修饰参与了IgAN 的发病过程。我们在前期研究中应用IgA 肾病患者来源的聚合IgA1(P-aIgA1)干预人系膜细胞,发现P-aIgA1 能够显著促进系膜细胞合成细胞外基质,上调纤溶酶原激活物抑制剂(PAI-1)的表达,而且系膜细胞中HDAC1、HDAC2、HDAC8 均显著升高;应用HDAC 抑制剂丙戊酸钠干预后可以显著下调HDAC1 的表达,上调H3Ac 的表达,提高系膜细胞乙酰化水平,显著减轻了细胞外基质的合成[14]。上述研究进一步表明组蛋白乙酰化不仅参与了IgA 肾病的发病过程,而且可以被逆转。
IgA1 糖基化异常是IgAN 发病过程中重要环节[3]。本研究结果显示IgAN 组C1GALT1 mRNA 的表达显著减少,ST6GALNAC2 的mRNA 表达显著增多,与Suzuki 等[1]研究结果一致,但导致这2 个糖基化酶基因表达异常的机制尚未清晰。为了进一步明确C1GALT1 和ST6GALNAC2的mRNA 表达水平发生变化的机制,我们应用ChIP 的方法检测了上述2 个基因启动子区的H3 和H4 乙酰化水平。结果显示IgAN 组C1GALT1 基因启动子区H3 和H4乙酰化较健康对照组均显著下降;ST6GALNAC2 基因启动子区的H3 和H4 乙酰化水平较健康对照组均显著升高。C1GALT1 基因启动子区的H3 和H4 乙酰化水平下降后导致染色质呈相对“关闭”状态,从而抑制了C1GALT1 基因的表达。ST6GALNAC2 基因启动子区的H3 和H4 乙酰化水平较正常人升高,导致染色质呈相对“开放”状态,从而促进了ST6GALNAC2 基因的表达,2 个基因的异常导致了IgA1 的糖基化异常。
综上所述,我们观察IgAN 患者PBMC 和肾组织中组蛋白乙酰化修饰水平,发现IgAN 都存在乙酰化修饰异常。本研究还发现组蛋白乙酰化参与调控糖基化酶的基因表达,并从表观遗传学角度对IgAN 发病机制进行了探讨。组蛋白乙酰化的可逆性提示其在疾病的干预治疗方面有重要前景,为IgAN 的治疗提供了新的思路。
参·考·文·献
[1] Suzuki H, Raska M, Yamada K, et al. Cytokines alter IgA1 O-glycosylation by dysregulating C1GalT1 and ST6GalNAc-II enzymes[J]. J Biol Chem, 2014, 289(8): 5330-5339.
[2] Floege J, Amann K. Primary glomerulonephritides[J]. Lancet, 2016, 387(10032): 2036-2048.
[3] Wada Y, Matsumoto K, Suzuki T, et al. Clinical significance of serum and mesangial galactose-deficient IgA1 in patients with Iga nephropathy[J]. PLoS One, 2018, 13(11): e0206865.
[4] Ali I, Conrad RJ, Verdin E, et al. Lysine acetylation Goes global: from epigenetics to metabolism and therapeutics[J]. Chem Rev, 2018, 118(3): 1216-1252.
[5] Capece D, Fischietti M, Verzella D, et al., The inflammatory microenvironment in hepatocellular carcinoma: a pivotal role for tumor-associated macrophages[J]. Biomed Res Int, 2013, 2013:187204.
[6] Holdsworth S , Gan P Y, Kitching A R, Biologics for the treatment of autoimmune renal diseases[J]. Nat Rev Nephrol, 2016, 12(4): 217-231.
[7] Rizk DV, Saha MK, Hall S, et al. Glomerular immunodeposits of patients with Iga nephropathy are enriched for IgG autoantibodies specific for galactosedeficient IgA1[J]. J Am Soc Nephrol, 2019, 30(10): 2017-2026.
[8] Chen SW, Bellew C, Yao X, et al. Histone deacetylase (HDAC) activity is critical for embryonic kidney gene expression, growth, and differentiation[J]. J Biol Chem, 2011, 286(37): 32775-32789.
[9] Bush EW, McKinsey TA. Protein acetylation in the cardiorenal Axis: the promise of histone deacetylase inhibitors[J]. Circ Res, 2010, 106(2): 272-284.
[10] Hadden MJ, Advani A. Histone deacetylase inhibitors and diabetic kidney disease[J]. Int J Mol Sci, 2018, 19(9): E2630.
[11] Roth SY, Denu JM, Allis CD. Histone acetyltransferases[J]. Annu Rev Biochem, 2001, 70: 81-120.
[12] Thiagalingam S, Cheng KH, Lee HJ, et al. Histone deacetylases: unique players in shaping the epigenetic histone code[J]. Ann N Y Acad Sci, 2003, 983: 84-100.
[13] Quintero-Ronderos P, Montoya-Ortiz G. Epigenetics and autoimmune diseases[J]. Autoimmune Dis, 2012, 2012: 593720.
[14] Dai Q, Liu J, Du YL, et al. Histone deacetylase inhibitors attenuate P-aIgA1-induced cell proliferation and extracellular matrix synthesis in human renal mesangial cells in vitro[J]. Acta Pharmacol Sin, 2016, 37(2): 228-234.
