男性系统性红斑狼疮合并蛋白丢失性肠病一例并文献复习
2020-10-12杨峰胡杰英丘彬彬谭俊峰江颖李时悦钟南山郑则广
杨峰 胡杰英 丘彬彬 谭俊峰 江颖 李时悦 钟南山 郑则广
1广州医科大学附属第一医院呼吸内科 广州呼吸健康研究院 呼吸疾病国家重点实验室/国家呼吸系统疾病临床医学研究中心510120;2广西中医药大学第一附属医院老年干部病区,南宁530012;3佛山市高明区人民医院呼吸内科528500
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种弥漫性、全身性自身免疫病,主要累及皮肤黏膜、骨骼肌肉、肾脏及中枢神经系统,同时还可以累及肺、心脏、血液等多个器官和系统,表现出多种临床表现;血清中可检测到多种自身抗体和免疫学异常,SLE 以女性多见,男性发病率低,男女发病比例约为1∶9。蛋白丢失性肠病(protein-losing enteropathy,PLE)是指肠道或肠道外病变导致蛋白从肠道丢失的一种病理状态,临床上少见。PLE 主要影响为蛋白丢失后导致的严重的低蛋白血症,从而临床表现出多浆膜腔积液。SLE累及肠道而表现为PLE的病例非常罕见,报道如下,同时检索并分析SLE合并PLE的病例资料,以提高对此类疾病的临床特点、诊断、治疗的认识。
1 临床资料
患者男,45 岁,货车司机。主因 “眼睑水肿半年,活动后气促、腹胀、双下肢浮肿1个月”于2018年8月15日入院。半年前无明显诱因开始出现眼睑轻度浮肿,未予处理。1个月前出现活动后气促,伴腹胀、下肢水肿。到广州市某大学附属(三甲)医院检查,血常规:白细胞4.9×109/L,血红蛋白137 g/L,血小板164×109/L;白蛋白18.9 g/L, 球 蛋 白19.4 g/L, 总 胆 固 醇8.86 mmol/L,甘油三酯1.50 mmol/L,总钙1.86 mmol/L;补 体3 为0.521 g/L,补 体4 为0.131 g/L,ds-DNA 弱阳性,抗核抗体阳性,抗SSA 抗体阳性 (+++),anti-Ro52 阳性 (+);糖类抗原125为1 097 U/ml;尿蛋白++,尿酮体++;胸部CT 平扫提示双侧胸腔积液 (图1);B超提示心包少量积液,腹盆腔积液 (图2);PETCT 检查提示全身未见实质性高代谢恶性肿瘤改变。给予利尿消肿、改善循环等处理后,双下肢浮肿较前稍消退,气促等症状无明显改变,为进一步诊治到广州医科大学附属第一医院就诊。查体:体温36.5℃,脉搏100次/min,呼吸频率20次/min,血压96/70 mm Hg (1 mm Hg=0.133 k Pa)。全身浅表淋巴结未触及肿大,眼睑轻度浮肿,胸腔积液、腹腔积液体征,双下肢中度凹陷性水肿。既往体健无特殊疾病病史及风湿病家族史。入院后查血常规及降钙素原等正常,白蛋白19.3 g/L,抗SSA 抗体强阳性 (+++),抗Ro-52抗体阳性(++),抗核抗体阳性 (1∶10 000);24 h尿蛋白0.23 g;胸片示左侧胸腔中量积液,右侧胸腔大量积液;右侧胸腔穿刺引流提示:黄色,李凡他试验阳性(+),潘氏试验++++,白细胞394×106/L(/HP),分叶核细胞占15%,单个核细胞占85%,葡萄糖6.14 mmol/L,总蛋白29.6 g/L,乳酸脱氢酶91.6 U/L,腺苷脱氨酶1.6 U/L。考虑诊断为结缔组织病(SLE 可能性大),转肾内科肾穿刺活检。后因患者外院使用中成药 (前列地尔、血必静)活血化瘀,出血风险大,未行肾穿刺活检,给予泼尼松60 mg及利尿、护肾等治疗后稍有好转出院。出院后2~3 d再次出现活动后气促、腹胀、双下肢浮肿症状,因腹胀明显饮食下降,体质量增加约3 kg,遂再次收住入院。继续完善检查,其后血白蛋白波动在13.3~19.3 g/L,血钾正常,血钠波动在127~134 mmol/L,血钙波动在1.66~1.87 mmol/L,甘油三脂1.64 mmol/L,补体3为0.46~0.53 g/L,补体4为0.10~0.12 g/L,总胆固醇8.14 mmol/L;凝血功能、肝纤指标、抗心磷脂抗体、血管炎抗体、抗环瓜氨酸肽抗体、抗肾小球基底膜抗体、甲状腺抗体等均正常。锝标记的淋巴管核素显像示未见明确乳糜胸、乳糜腹征象,双侧下肢淋巴链完整,淋巴回流通畅。口腔黏膜活检:(左下唇)送检涎腺组织,腺体无明显萎缩,间质无明显淋巴细胞浸润,未见干燥综合征的病理改变;眼科眼底镜检查:双眼中心性浆液性脉络膜视网膜病变及左眼视网膜微出血。临床考虑诊断SLE,行肾穿刺活检示肾小球病变轻微 (图3),结合临床考虑狼疮性肾炎等结缔组织病早期改变。尿蛋白丢失不足以解释严重低蛋白血症,行腹部小肠低张平扫及增强CT 提示:胃壁、空肠及部分回肠管壁不均匀增厚,结合临床考虑结缔组织病胃肠道受累可能性大,降结肠远端与乙状结肠交界处可疑附壁结节 (图4)。行胃、肠镜检查,提示胃肠道黏膜水肿明显(图5),活检提示:(胃窦)胃黏膜组织,腺体部分萎缩,部分腺体核较肥大、深染,间质淋巴细胞、浆细胞浸润,可见淋巴滤泡,散在嗜酸粒细胞,考虑慢性浅表性萎缩性胃炎,非活动期;(十二指肠)黏膜充血水肿,部分绒毛可见淋巴管扩张,有浦氏细胞化生,淋巴细胞浆细胞浸润,个别散在嗜酸粒细胞 (图6),慢性炎症,符合PLE,未见淀粉样变。临床诊断考虑SLE 合并PLE。糖皮质激素(泼尼松1 mg/kg,4周)治疗效果不佳,后给予糖皮质激素(注射用甲基泼尼龙琥珀酸钠500 mg)小冲击治疗及免疫抑制剂(环磷酰胺,0.2 g,隔日1 次,静脉滴注)治疗后,气促、腹胀、胃胀感消退,症状改善(使用后2周开始出现症状改善),胸腹水消退、血白蛋白逐步上升,后带糖皮质激素及口服环磷酰胺出院,定期随访6个月复查暂无复发。
2 文献复习
以“系统性红斑狼疮”与 “蛋白丢失性肠病”为中文关键词检索万方数据库、中国知网数据库,检索时限为1998年1月至2019年12月;同时以“Lupus Erythematosus,Systemic”与 “Protein-Losing Enteropathies”检索Pub Med 数据库与FMRS数据库的相关文献,检索时限为1966年1月至2019年12月。提取符合SLE 合并PLE 病例的临床特征进行总结,文献检索共获得中文36篇、外文93篇,审阅符合新发病例报道且资料相对齐全的共40例,其中国内报道12例,国外报道28例。

图1 胸部CT 示双侧胸腔积液

图2 腹部B超示腹盆腔积液
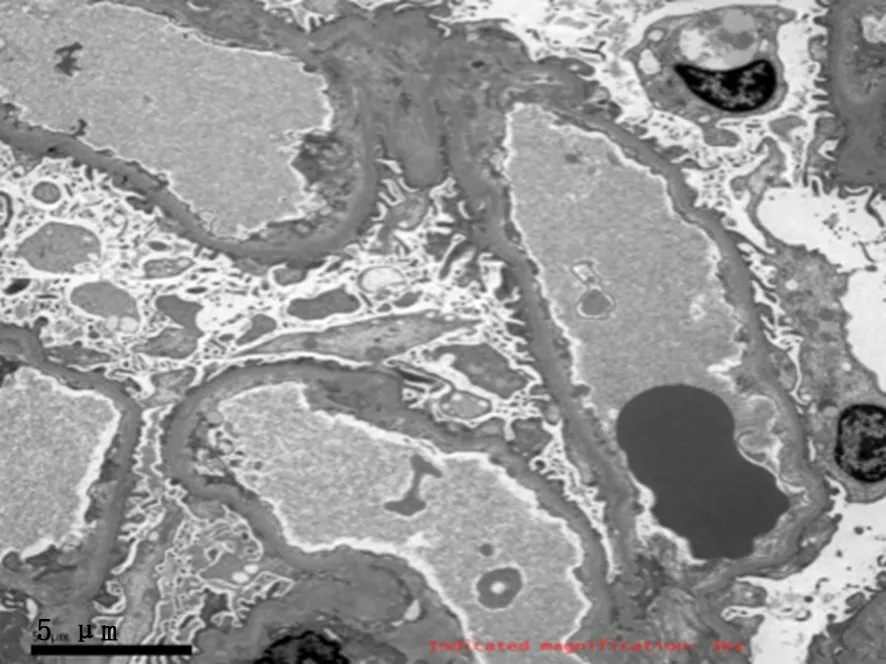
图3 肾穿刺 (已经使用60 mg泼尼松2周后): (电镜)肾小球毛细血管内细胞无明显增生,毛细血管襻开放,壁层细胞无明显增生,基底膜无明显增厚,厚度约240~350 nm,足突部分融合,上皮下未见电子致密物沉积,系膜细胞和基质无增生,系膜区少量可疑电子致密物沉积
3 讨论
多浆膜腔积液及顽固性水肿临床常见,常见病因包括心功能不全、肾功能不全、肝硬化、结缔组织病、重度营养不良及严重低蛋白血症、肿瘤、甲状腺疾病、结核病。本病例排除心源、肾源、肝源、甲状腺疾病以及进食障碍致严重营养不良导致的低蛋白血症等,结合血自身免疫标志物明显异常,考虑自身免疫性疾病可能性大。本例符合美国风湿病学会SLE 诊断标准11 条中的4 条 [浆膜炎、抗核抗体(+)、dsDNA (+)和蛋白尿][1]。
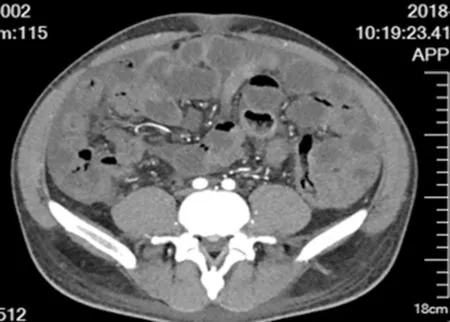
图4 小肠低张平扫及增强CT 示肠管壁不均匀增厚
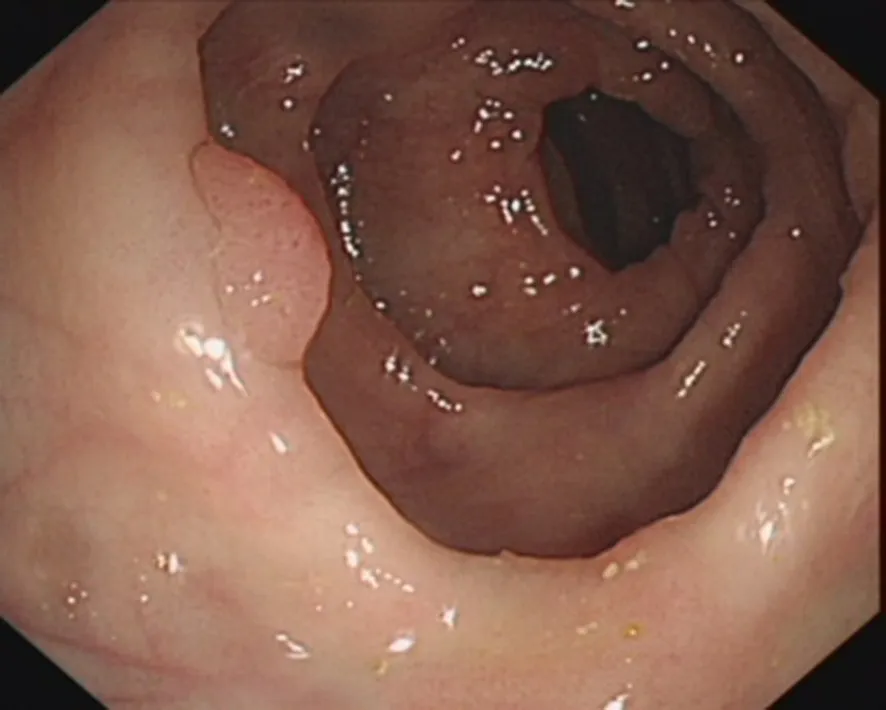
图5 肠镜示黏膜水肿明显
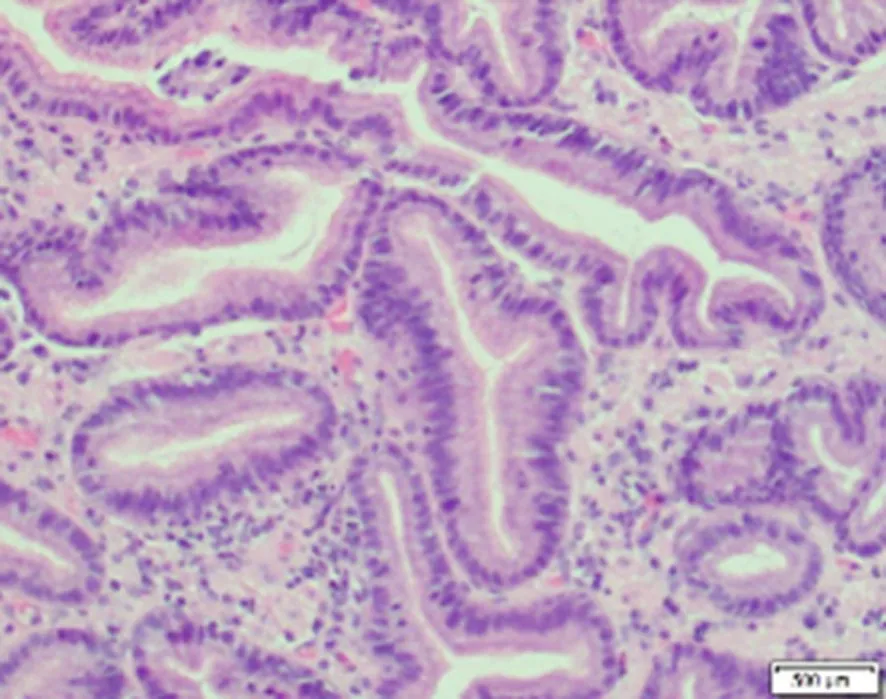
图6 活检示 (十二指肠)绒毛充血、水肿,局灶绒毛萎缩脱落,部分绒毛可见淋巴管扩张,淋巴细胞浆细胞浸润,有个别散在嗜酸性粒细胞 HE ×200
SLE是一种多系统受累性疾病,临床表现形式可以多样,皮肤、关节、肾脏、黏膜、血液系统等系统受累多见,胃肠道受累常表现为胃肠炎、溃疡、肠系膜血管炎、小肠坏死、假性肠梗阻、肠套叠、吸收不良等。而本病例最大特点为并不表现上述SLE的常见临床表现形式,而以严重低蛋白血症、多浆膜腔积液及顽固性水肿为本病例最大临床特征。临床上SLE 相关低蛋白血症往往多见于狼疮肾所致的肾损害后蛋白丢失,而该病例尿蛋白定量非常少,进食并无明显障碍,血蛋白的丢失需要考虑到淋巴回流障碍、浆膜腔丢失或消化系统丢失,进一步检查提示淋巴回流无明显异常、浆膜腔蛋白水平不高,最后排查消化道检查后具备PLE特征,临床诊断SLE合并PLE。
单纯PLE常见的病因为[2-4]:(1)淋巴回流受阻如先天性淋巴管扩张、长期右心功能衰竭、缩窄性心包炎等;(2)机械原因如肠溃疡等;(3)肠炎血管壁通透性增高如各种肠炎等;(4)肠道术后丢失蛋白。SLE合并PLE 在临床上少见,其病因尚不明确,推测可能为[5-7]:(1)血管炎;(2)补体沉积或其他原因致血管通透性增加;(3)淋巴管扩张导致淋巴液从淋巴管中漏入到肠道中;(4)肠系膜血管栓塞:(5)菌群失调;(6)肠道黏膜破坏,内毒素增加所致肝脏产白蛋白减少。本病例未有血管炎表现,补体明显减低 (40例报道中仅有4例正常,3例未有数据),肠道多处取材活检病理提示充血水肿,可见淋巴细胞、浆细胞、嗜酸粒细胞等浸润,淋巴管存在一定程度的扩张,其他的机制该病例并未有明确线索。
对40例SLE 合并PLE 患者的资料结合本病例总结及讨论如下。
3.1 临床表现 40例SLE 合并PLE 患者平均年龄(33.6±14.5)岁 (6~68 岁),有报道称主要出现在东亚人群中[8-10],机制尚不明,这与笔者检索的40例SLE合并PLE患者中67.5%为东亚人种(表1)相符。中国香港和北京人群PLE占SLE的3.2%和1.9%[11-12]。有报道PLE既可以作为SLE的首发表现,也可在确诊SLE多年后出现[13-17]。
以PLE为首发表现的23 例 (57.5%),这与Al-Mogairen[9]系统综述54项研究中的112例狼疮相关蛋白丢失性肠病所报道的48.6%接近。有学者提出PLE可能为SLE亚组人群[18],而本病例就可能为PLE为首发表现的SLE。既往病史均无特殊,临床表现主要为多浆膜腔积液和/或全身水肿 (表2)。有文献提出水肿及多浆膜腔积液为表现的PLE可能是SLE早期改变[19],也有报道提示早期以水肿为主的病例,3年后进展为狼疮肾炎、肾病综合征,最后死于尿毒症[20]。消化系统症状主要表现为腹胀、腹泻及胃纳减退。腹泻一般程度不严重,存在腹泻的病例大部分为轻微腹泻或大便次数增多,最严重的个案为以色列25岁女患者,出现严重水样腹泻 (>20次/d)以及呕吐、严重消瘦和营养不良[21]。

表1 系统性红斑狼疮合并蛋白丢失性肠病患者基本资料
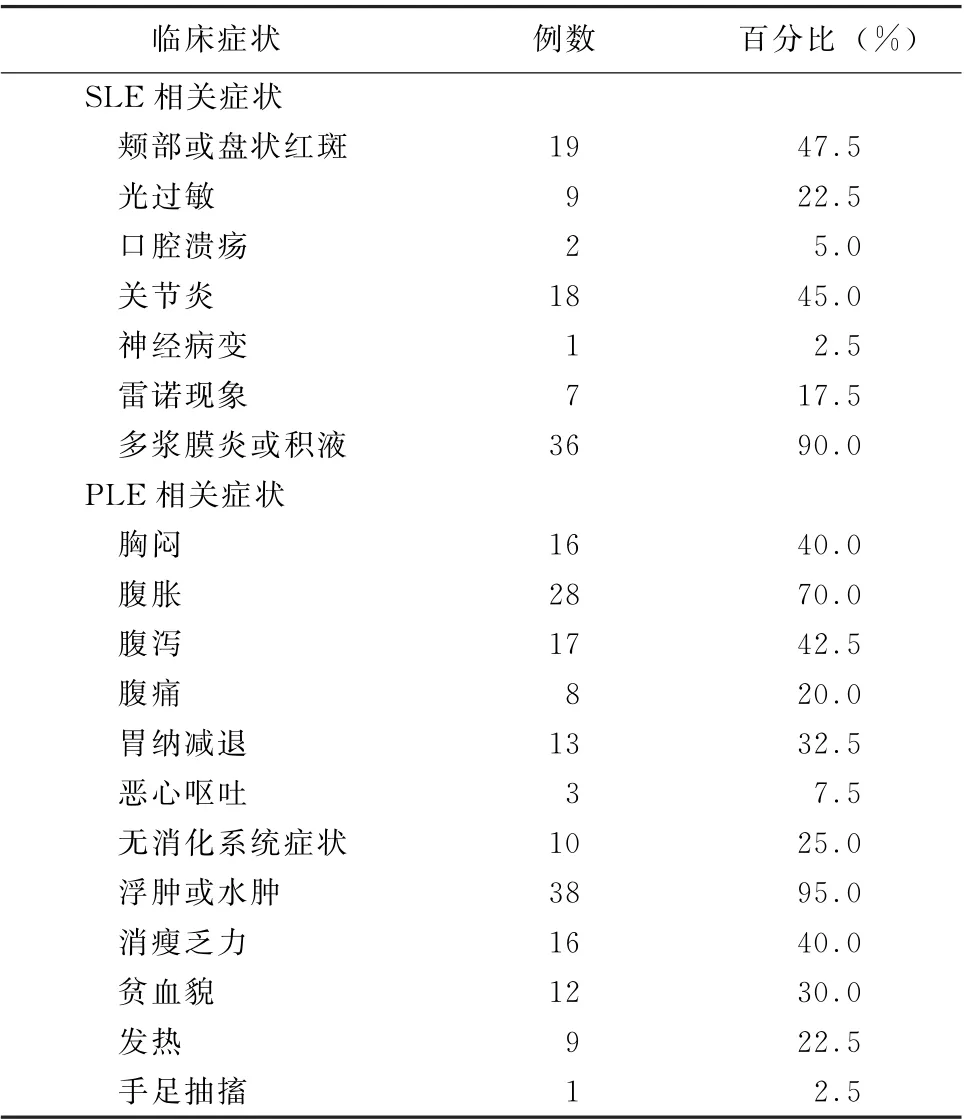
表2 系统性红斑狼疮合并蛋白丢失性肠病患者主要临床症状或体征
3.2 实验室特点 所有病例均排除严重肝脏疾病,实验室最具特征性的改变为血蛋白低下以及严重的低蛋白血症与尿蛋白的丢失不成比例 (表3)。(1)平均血白蛋白水平为 (16.18±8.2)g/L (范围7.5~26.8 g/L),其中属于严重低蛋白血症 (<25 g/L)者达90.0%。(2)尿蛋白水平不高,许多病例报道提示尿蛋白可以为阴性 (35.0%),24 h尿蛋白<0.5 g占85.0%,提示严重的低蛋白血症肾丢失并非主要渠道,消化系统丢失是最主要的方式,消化系统丢失蛋白的机制尚不清楚,有推测首要原因为淋巴管扩张[22]。有病例观察到绒毛状淋巴管扩张,但无证据表明中心静脉压高或者淋巴管堵塞,本病例亦未发现此问题存在。当然多浆膜腔积液中蛋白的丢失也是重要的一个因素,有个案报道乳糜胸腹水导致严重低蛋白血症[23]。 (3)补体水平明显下降也是SLE 并PLE 的一个重要特征(30/40,75.0%),而补体水平是评估SLE 疾病活动的一项指标。有文献指出补体参与的炎症介导的黏膜渗出加剧蛋白释放,可能是低蛋白血症的一个重要原因[24]。(4)本病例糖类抗原125(1 097 U/ml)明显升高。有文献关注到糖类抗原125可以作为一个病情观察的指标[10,25]。 (5)血脂水平的异常,尤其是胆固醇的升高也在诸多病例中体现(12/40,30.0%)。本病例血胆固醇为8.86 mmol/L。有文献关注到没有高脂血症的患者持续出现腹泻,而没有腹泻的患者则无一例外地出现高脂血症[26]。推测在患有PLE 的患者中,高脂血症的关联主要取决于腹泻的存在,这可能是另一种病理过程在胃肠道中同时发生的迹象,这与本病例没有腹泻而存在高胆固醇血症相符合。(6)另外在SLE 相关PLE中,转化生长因子α和血管内皮生长因子可能是潜在的生物标志物和治疗靶点[27],但仍需更多样本人群进一步研究。免疫学指标详细情况见表4,抗核抗体升高或阳性为97.5%,其他最多见的免疫学异常为抗DNA 或dsDNA、抗SSA、抗RNP。
3.3 影像学特征 SLE合并PLE影像表现并无特异性。往往影像表现主要集中在多浆膜腔积液,腹腔积液 (35/40,87.5%)、胸腔积液 (21/40,52.5%)、心包积液 (8/40,20.0%)常见,其中有2例胸、腹腔乳糜积液。腹部CT 常见的表现为腹水征、淋巴结增大、水肿、肠壁增厚、门静脉血栓形成等。SLE 出现腹水多见于肾病综合征、充血性心力衰竭或门静脉高压症,也有报道因自身免疫性浆液炎症而出现无痛难治性腹水[28],除此之外PLE为常见腹水征的主要原因。本病例出现明显腹水征、肠壁增厚典型表现,考虑除SLE 并PLE肠壁病理改变以外,低蛋白血症所致肠道壁的水肿也是肠壁增厚的重要因素。
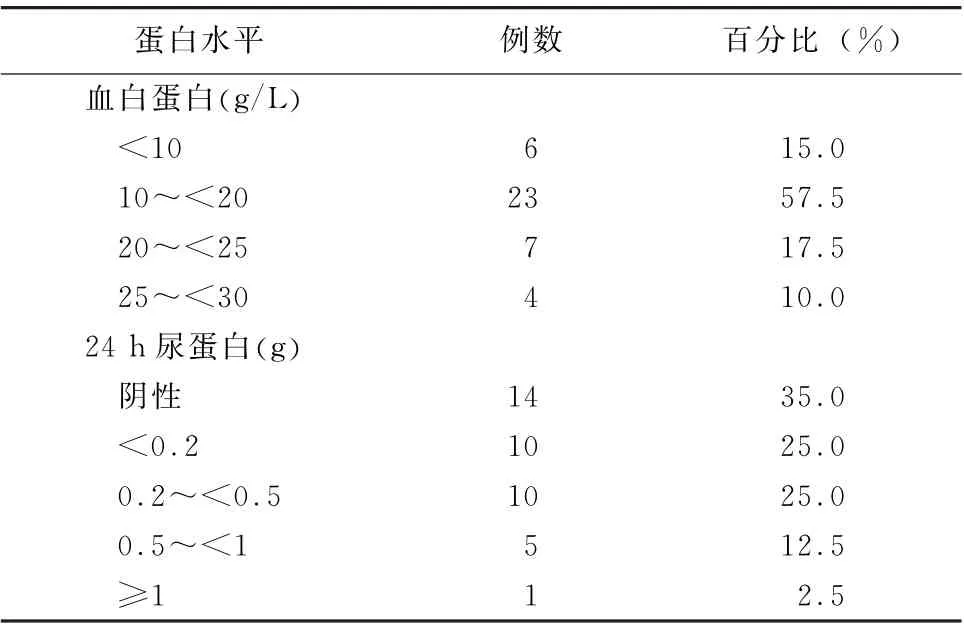
表3 系统性红斑狼疮合并蛋白丢失性肠病患者血/尿蛋白水平
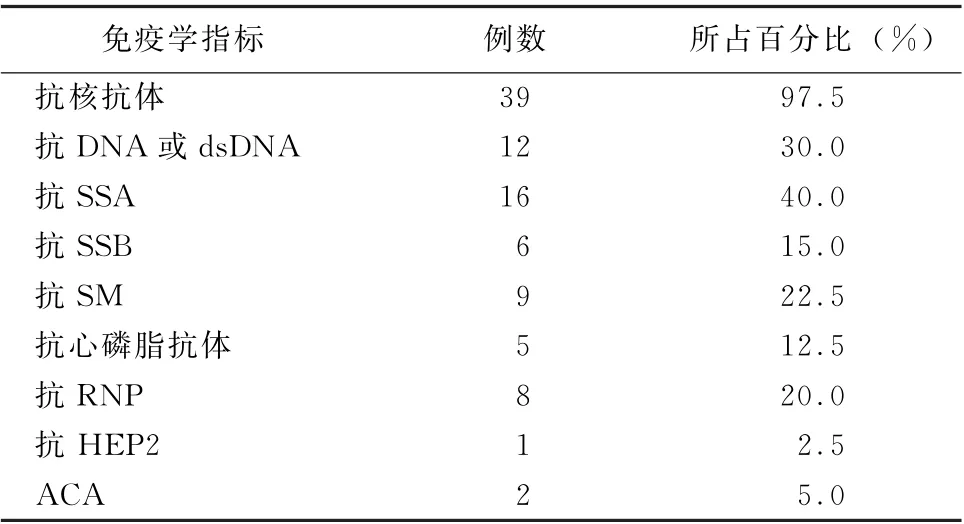
表4 系统性红斑狼疮合并蛋白丢失性肠病患者主要免疫学异常
3.4 病理改变 SLE合并PLE肾穿刺活检往往能够提示SLE诊断。消化道的活检并无明显特异性,肠管病理多提示:绒毛萎缩、炎性浸润(淋巴、单核多见)、黏膜下水肿、静脉炎、淋巴管扩张、补体沉积等,亦有不少报道正常肠黏膜或肠黏膜活检没有血管炎表现或轻微炎症[29]。本病例就在胃窦、十二指肠、横结肠、降结肠、乙状结肠等多处取材,与上述描述类似,尽管无特异性表现,但对于鉴别其他疾病如原发性小肠淋巴管扩张症等有一定价值。
3.5 诊断方法 SLE合并PLE的诊断遵循首先按美国风湿病学会诊断标准诊断SLE,难以诊断的低蛋白血症或多浆膜腔积液考虑PLE 的诊断。目前常用确诊方法有以下几种:99mTc标记白蛋白核素显像扫描(60.0%)、粪便α1抗胰蛋白酶清除率检测(20.0%)、51Cr标记白蛋白或Cr Cl3粪便排泄率检查(12.5%)、I131聚乙烯吡咯烷酮粪便排泄率检查(2.5%)。但由于检查设备并非常用设备,往往诸多病例为临床诊断,在排除其他疾病情况下,如果有临床典型特征可以临床诊断。本病例通过排查导致严重低蛋白血症各系统疾病,结合SLE 的诊断及肠道低张CT 扫描显影及活检病理表现,具备PLE的临床特征,临床诊断SLE合并PLE。
3.6 治疗方法 大多数SLE 合并PLE 对糖皮质激素治疗敏感。对部分激素不敏感者可以联合细胞毒或免疫抑制剂等治疗。不少病例报道联合免疫抑制剂如硫唑嘌呤或环磷酰胺治疗、他克莫司成功治疗激素抵抗的SLE 相关性PLE[30-31]。本例应用小剂量糖皮质激素效果不佳,经冲击治疗联合环磷酰胺后取得良好效果,该疗法可供临床参考。有报道尝试应用皮下注射200μg奥曲肽联合中链甘油三酯饮食治疗有效[32],以及在药物治疗欠佳的情况下,明确有局部蛋白丢失部位的采用小肠切除术治疗有效。由于均为个案,应有更多研究后方可参考。当然临床中对症支持治疗,如补充白蛋白等方法同步应用在有效治疗的基础上能更快地改善临床症状,也是值得参考的。
利益冲突 所有作者均声明不存在利益冲突
