miR-424-5P 对结肠癌细胞增殖的影响及机制探讨
2020-10-12刘友强胡冀陶李保坤席金川王贵英
刘友强,胡冀陶,李保坤,席金川,王贵英,2∗
(1.河北医科大学第四医院外二科, 石家庄 050011; 2.河北医科大学第三医院, 石家庄 050051)
结肠癌(colon cancer)是常见的恶性肿瘤,发病率位居全球第三位[1]。 随着医疗卫生事业的发展,医疗水平取得了显著提升,但结肠癌患者仍然呈现较高复发率[2-3]。 因此,有效的治疗方法仍是临床迫切需求的。 微小RNA(miRNA) 是长度为20 ~25个核苷酸的小型非编码RNA,可通过转录后调控来调节下游靶标的表达[4]。 miR-424-5p 是miRNA 中的一员,研究报道,miR-424-5p 通过靶向ARK5 可抑制肝内胆管癌的转移和侵袭[5]。 一项关于肝癌转移的研究发现,miR-424-5p 异常表达与失巢凋亡和EMT 密切相关, 且其下调明显促进了肝癌的进展[6]。 还有研究显示, miR-424-5p 可以通过下调BCL-2 的表达来抑制肺癌细胞A549 增殖[7]。 这些提示,miR-424-5p 可能在肿瘤中负性调控细胞恶性生物学行为。 但也有研究报道miR-424-5p 可促进肿瘤细胞恶性生物学行为。 一项喉鳞状细胞癌的研究发现,miR-424-5p 可通过介导CADM1 促进细胞侵袭[8]。 而在结肠癌中,miR-424-5p 的生物学作用还不清楚,有待于进一步研究。 本研究以结肠癌HT-29 细胞作为研究对象,通过外源性上调miR-424-5P 水平,观察细胞增殖能力变化,并对其机制进行探讨,为临床治疗结肠癌提供基础理论支持。
1 材料和方法
1.1 实验细胞
人结肠癌HT-29 细胞系购自中科院上海细胞库。
1.2 主要试剂与仪器
胎牛血清( fetal bovine serum,FBS)、RPMI1640培养基、磷酸盐缓冲液( Phosphate Buffer solution,PBS)购自美国Gibco 公司;细胞计数试剂盒8(Cell Counting Kit-8,CCK-8)购自美国MCE 公司;二甲基亚砜(DMSO) 和TRIzol 购自美国Sigma 公司;YAP抗体( 货 号14074 )、 Phospho-YAP 抗 体( 货 号53749)、Src 抗体( 货号2109T)、 Phospho-Src 抗体(货号12432S)、LATS1 抗体(货号3477T)、Phospho-LATS1 抗体( 货号8654S) 购自美国CST 公司;GAPDH 抗体(货号abs830030)、抗兔IgG-HRP 二抗(货号Abs20040)购自上海爱必信公司;总蛋白提取试剂盒、细胞裂解液、结晶紫染液购自上海碧云天公司; 聚偏二氟乙烯膜 ( PVDF ) 膜购自美国Millipore 公司;miR-424-5P 慢病毒表达载体转染试剂盒购自上海吉凯基因公司;逆转录聚合酶链式反应(RT-PCR)试剂盒和实时定量PCR(Q-PCR)试剂盒购自美国Promega 公司。
1.3 实验方法
1.3.1 细胞培养
HT-29 细胞培养于含10% FBS 和1%青-链霉素的RPMI1640 培养基中,细胞置于37℃、5% CO2、95% 空气的培养箱中。
1.3.2 慢病毒转染法上调miR-424-5P 水平
以每孔5×105个细胞接种HT-29 细胞于6 孔板中。 次日进行转染。 转染前稀释病毒液,准备两管含10 μg / mL 聚凝胺的RPMI1640 培养基各1 mL,分别加入100 μL 重组miR-424-5P 基因慢病毒原液和空载病毒原液,混匀。 以上述混合液分别处理细胞,前者设为过表达组( miR-424-5P-OV组),后者设为空载体组(NC 组),同时以等量培养处理的细胞作为空白组( Blank 组),放置在37℃、5% CO2的培养箱中过夜培养,24 h 后更换新鲜的RPMI1640 培养基,48 h 后传代至培养皿中继续培养,嘌呤霉素筛选稳定过表达miR-424-5P 的细胞株。
1.3.3 MTT 法检细胞活力
将各组细胞按每孔9000 个接种于96 孔板中,每组6 个重复孔,72 h 后每孔直接加入20 μL MTT溶液(5 mg / mL),放入细胞培养箱继续避光培养4 h,弃上清,每孔加二甲基亚砜(DMSO)150 μL,于酶标仪上测定各孔490 nm 的吸光度值。
1.3.4 实时荧光定量聚合酶链反应(RTFQ-PCR)检测miR-424-5P 水平
当细胞生长至对数期时收集各组细胞,采用TRIzol 法提取细胞总RNA,并将总RNA 逆转录为cDNA,稀释反转录好的cDNA 至500 μL,充分混匀备用。 取出配制好的各引物,并按上游引物与下游引物1 ∶1稀释,按SYBR Premix Ex TaqTM Ⅱ试剂盒添加各试剂以准备反应体系,在ABI 7300型RTFQ-PCR 系统中进行扩增,设置反应条件:95℃10 s,95℃10 s,60℃60 s,共40 个循环,每组设置6 个重复孔。 2-△△Ct法计算miR-424-5P 的相对表达水平。
1.3.5 平板克隆实验检测各组细胞克隆形成能力
待各组细胞生长至对数期时消化细胞并制备细胞悬液,以每孔500 个细胞接种于6 孔板中,置于培养箱培养18 d,吸出旧培养基,以固定液(4%多聚甲醛)固定10 min,PBS 洗两遍,加入结晶紫染液染色15 min,双蒸水洗去染液。 于倒置显微镜下拍照计数, 克隆形成率(%) = 克隆数/ 接种细胞数×100%。
1.3.6 免疫荧光检测各组细胞YAP 核质分布情况
各组细胞传代于放好爬片的6 孔培养板中,24 h 时以固定液(4%多聚甲醛)固定15 min,室温条件下以Triton X-100 处理10 min。 同时配制5%牛血清白蛋白(bovine serum albumin,BSA) 的PBS 封闭液,封闭细胞2 h,于4℃条件下孵育YAP 一抗(1 ∶500)过夜,PBST 洗3 次,滴加稀释好的荧光二抗(1∶300)避光孵育1 h,PBS 洗3 遍,DAPI 染色5 min,洗去后封片,倒置荧光显微镜观察并拍照。
1.3.7 Western blot 法检测各蛋白表达
配制RIPA 细胞裂解液(使用前RIPA,蛋白抑制剂,磷酸酶抑制剂,多种蛋白酶抑制剂按照100 ∶1:1 ∶1混合)并置于冰上备用,将各组细胞传代至6 cm 培养皿,生长至对数期时取出细胞,PBS 洗两遍,各加入150 μL RIPA 裂解液,冰上孵育20 min,用细胞刮刀刮下各组细胞并转移至1.5 mL EP 管中,4℃、12000 r/ min 离心20 min,吸取上清液至0.5 mL EP 管中,冰上备用,采用BCA 蛋白定量试剂盒测定蛋白浓度, 按需求加入蛋白上样缓冲液( loading buffer)和双蒸水以配制蛋白上样样品。 电泳:10%SDS-PAGE 凝胶电泳进行蛋白分离,每孔蛋白上样量为30 μg。 转膜:将凝胶上的分离蛋白通过转膜仪转印至PVDF 膜上。 室温条件下,以5%脱脂奶粉封闭PVDF 膜2 h,按抗体要求加入Src(1 ∶1000)、p-Src(1 ∶1000)、LATS1(1 ∶5000)、p-LATS1(1 ∶1000)、YAP(1 ∶1000)、p- YAP(1 ∶1000)、GAPDH(1 ∶2000)4℃避光孵育过夜。 TBST 洗膜3 次,每次20 min,加入抗兔IgG-HRP 二抗(1 ∶3000),室温避光孵育1 h,TBST 洗膜3 次,每次20 min。 通过ECL 化学发光试剂盒显色,凝胶成像仪进行成像并读取灰度值,以GAPDH 灰度值进行归一化处理并计算相对蛋白表达量。
1.4 统计学方法
采用SPSS 17.0 和Graphpad 6.0 统计软件对实验结果进行分析处理。 数据以平均数±标准差(¯x±s)表示,所有数据以正态性检验发现均为正态分布,组内两样本数据采用t 检验,多样本采用单因素方差分析,后以LSD-t 检验进行事后检验。 P<0.05 为数据差异具有统计学意义。
2 结果
2.1 各组细胞miR-424-5P 表达水平
各组细胞生长至对数期后, RTFQ-PCR 检测miR-424-5P 水平,结果显示,Blank 组、NC 组及miR-424-5P-OV 组细胞相对miR-424-5P RNA 水平分别为(8.60±0.71)、(9.30±0.72)和(53.22±4.33),组间总体比较存在显著性差异(P<0.01,F = 301.10),事后两两比较发现,相较于NC 组,miR-424-5P-OV组miR-424-5P RNA 水平明显上调(P<0.01,图1)。
2.2 各组细胞活力比较
MTT 结果显示,Blank 组和NC 组细胞活力曲线相类似,而miR-424-5P-OV 组细胞活力曲线较为平缓。 在72 h 时,Blank 组、NC 组及miR-424-5P-OV组细胞活力分别为(306.55±8.20)、(310.89±8.20)和(188.26±3.10),组间总体比较存在显著性差异(P<0.01,F = 288.78),事后两两比较发现,与NC组相比,miR-424-5P-OV 组细胞活力明显减弱( P<0.01,图2)。
2.3 各组细胞克隆形成能力比较
采用平板克隆实验检测各组细胞克隆形成能力,结果显示,Blank 组、NC 组及miR-424-5P-OV 组细胞克隆形成率分别为100%、(106.25 ± 8.20) 和(43.26±3.10),组间总体比较存在显著性差异(P<0.01,F = 140.70),事后两两比较发现,相较于NC组,miR-424-5P-OV 组克隆形成能力明显减弱( P<0.01,图3)。
2.4 各组细胞YAP 核质分布情况
免疫荧光实验观察各组细胞YAP 细胞核和细胞质分布情况,结果显示,Blank 组和NC 组细胞YAP 以核表达为主,细胞质分布较少。 miR-424-5POV 组细胞YAP 可见明显的细胞质和细胞核分布,见图4。
2.5 各组细胞Src、YAP、 LATS1 及磷酸化表达差异
Western blot 法检测各组细胞Src、p-Src、YAP、p-YAP、LATS1、p- LATS1 蛋白表达,结果显示,各组细胞Src、YAP、LATS1 蛋白表达无明显变化,Blank组、NC 组及miR-424-5P-OV 组p-Src 蛋白表达水平分别为100%、(98.60±8.30)%和(23.25±2.03)%,组间总体比较存在显著性差异(P< 0.01,F=238.40),事后两两比较发现,相较于NC 组,miR-424-5P-OV 组p-Src 蛋白表达明显下调(P<0.01);p-YAP 蛋白表达水平分别为( 56.36 ± 5.00)%、(58.92±4.63)%和(179.55±12.50)%,组间总体比较存在显著性差异(P<0.01,F= 220.30),事后两两比较发现,相较于NC 组,miR-424-5P-OV 组p-YAP蛋白表达明显上调(P<0.01);p-LATS1 蛋白表达水平分 别为( 12.30 ± 1.15)%、( 13.58 ± 1.20)% 和(123.75±9.26)%,组间总体比较存在显著性差异(P<0.01,F= 420.40),事后两两比较发现,相较于NC 组,miR-424-5P-OV 组p- LATS1 蛋白表达明显上调(P<0.01,图5)
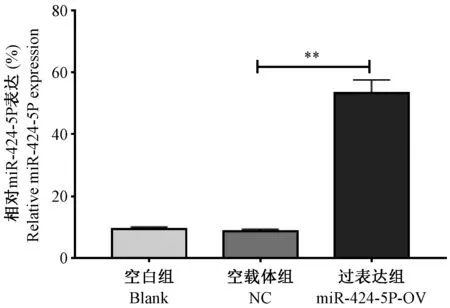
图1 各组细胞miR-424-5P 表达水平Note.Compared with NC group, ∗∗P<0.01.Figure 1 miR-424-5P expression levels in each group

图2 各组细胞活力比较Note.Compared with NC group, ∗∗P<0.01.Figure 2 Comparison of cell viability in each group
3 讨论
miR-424-5P 作为miRNA 家族的一员,已证明在乳腺癌、卵巢癌、肝癌、胰腺癌及肺癌等恶性肿瘤中发挥重要作用[9-10]。 但miR-424-5P 在结肠癌中的生物学功能还不清楚。 本研究通过过表达结肠癌HT-29 细胞miR-424-5P 表达水平,发现细胞活力和克隆形成能力均明显降低。 克隆形成能力可反应细胞群体依赖性和增殖能力变化。 因此提示,miR-424-5P 可抑制HT-29 细胞增殖。 为了观察miR-424-5P 抑制HT-29 细胞增殖的信号机制,本研究在分子水平上进行了研究。 免疫荧光结果显示,miR-424-5P 过表达可增加YAP 的细胞质分布。 观察YAP 相关蛋白表达发现,YAP 及其上游信号蛋白LATS1 的磷酸化水平均显著升高。 一般来说,YAP 磷酸化时定位于细胞质,而去磷酸化后进入细胞核直接参与靶基因的转录, 从而促进细胞增殖[11-13],提示本研究miR-424-5P 对细胞增殖的抑制效应可能与LATS1-YAP 磷酸化激活有关。

图3 各组细胞克隆形成能力Note.Compared with NC group, ∗∗P<0.01.Figure 3 Cell cloning ability of each group

图4 各组细胞YAP 核质分布情况Figure 4 Distribution of YAP nucleus in each group
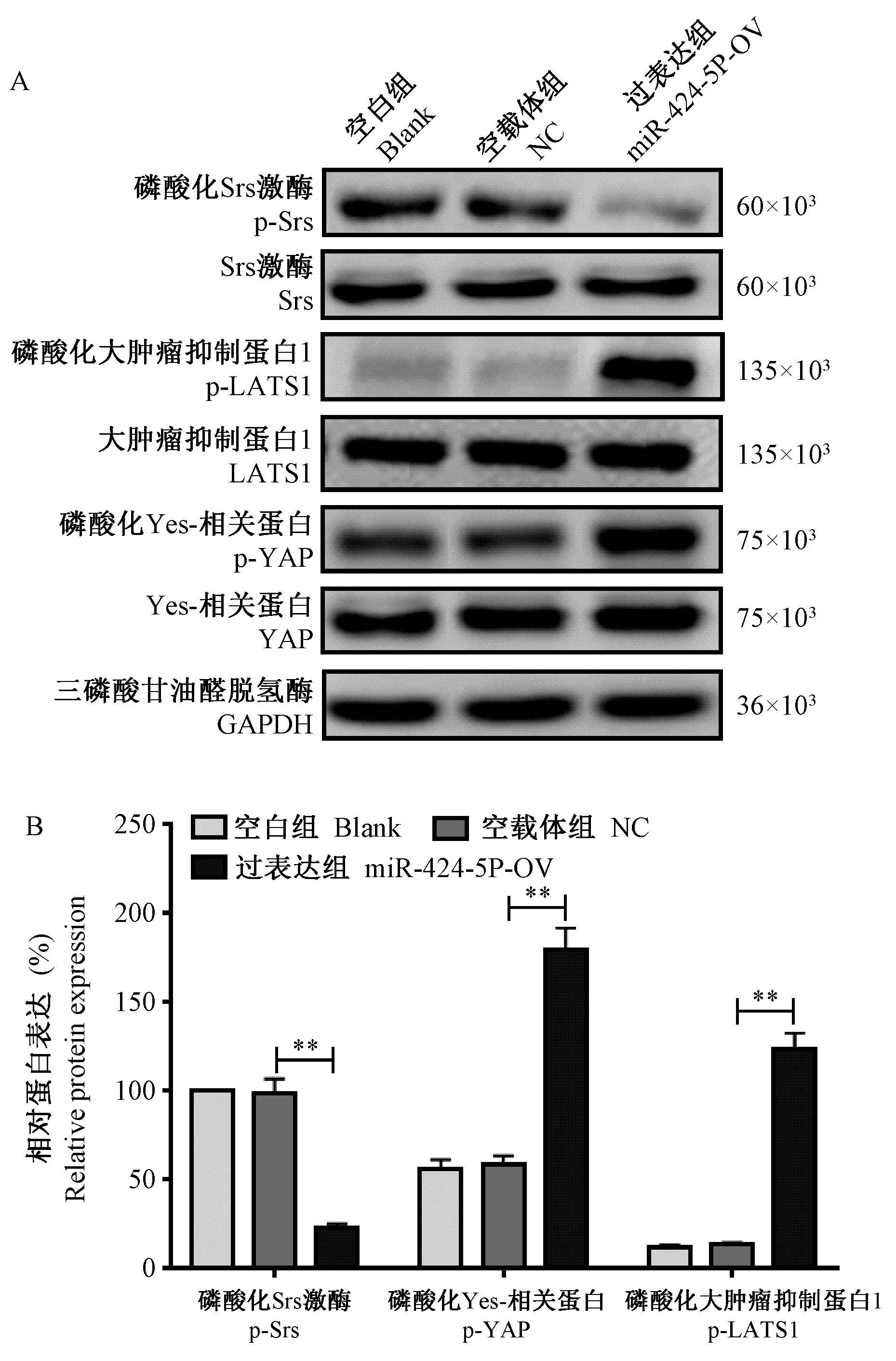
图5 各组细胞Src、YAP、LATS1 及磷酸化表达差异Note.Compared with NC group, ∗∗P<0.01.Figure 5 Different expressions of Src, YAP, LATS1 and their phosphorylation in each group of cells
Src 作为一种癌基因,已发现与多种肿瘤发生发展密切相关,可介导肿瘤细胞的黏附、迁移和侵袭等恶性生物学行为。 同时,研究还发现,Src 在恶性肿瘤细胞增殖中也发挥关键介导作用[14-15]。 最近的研究报道,Src 参与调节YAP 的磷酸化水平,抑制Src 可促进YAP 的磷酸化[16-17]。 基于上述报道,本研究对Src 进行了观察。 结果发现,miR-424-5P过表达后TH - 29 细胞Src 磷酸化水平显著降低。提示, miR-424-5P 可能通过抑制Src, 从而诱导LATS1 磷酸化,进而磷酸化YAP。 但miR-424-5P 对Src 的调控机制还不清楚,有待于进一步研究。
当前,虽然miRNA 仍然是研究热点,但仍有一部分miRNA 的生物学功能待于研究。 本研究发现miR-424-5P 过表达可抑制结肠癌HT-29 细胞增殖,而该作用可能抑制Src 磷酸化,进而磷酸化YAP 并使后者入核减少有关。 这为揭示miR-424-5P 在结肠癌细胞中的生物学功能提供了基础理论支持。但肿瘤具有异质性,miRNA 在不同肿瘤细胞中的功能也不完全一致,这给miRNA 的研究增加了严峻的挑战。 因此,对于miRNA 与肿瘤的关系还需要更多研究进行探讨。
