口腔修复膜和β-磷酸三钙治疗颌骨囊肿术后骨缺损的临床价值
2020-10-12胡爽李春梅张帅源秦硕解晨露牛志兴孙明磊
胡爽 李春梅 张帅源 秦硕 解晨露 牛志兴 孙明磊
1.郑州大学第一附属医院口腔颌面外科,郑州 450052;2.南方医院增城分院口腔科,广州 510515
颌骨囊肿是口腔颌面外科常见病、多发病,在口腔颌面外科常见病中的发生率位居第二位[1]。依据囊肿起源可分为牙源性和非牙源性囊肿,其中牙源性囊肿较为常见。颌骨囊肿可发生于颌骨的任何部位,生长缓慢,早期多无症状,但随病变发展可造成颌骨膨隆及病变区骨质的吸收,常需要手术治疗。研究[2]表明:小型颌骨囊肿骨缺损的平均愈合时间为1年,而中型及大型颌骨囊肿则需要2~5年,术后感染率增加,牙槽嵴高度得不到恢复,增加义齿修复的难度,咀嚼效率降低[3-4],甚至造成病理性骨折。颌骨囊肿术后的骨缺损不仅会增加日后感染的可能,而且会影响颌骨的形态和质量,伴有牙缺失患者可能相当长的时间难以获得良好的种植修复时机。近年来,随着患者诉求的提高和功能性修复性外科理念的深入,如何加快骨缺损的修复和提高新骨修复质量正逐步成为口腔颌面外科医生关注的热点。为促进骨缺损的修复,临床上逐渐应用了骨组织或骨替代材料来充填骨缺损区,如同种骨、同种异体骨、异种骨、人工合成骨材料等[5]。目前,关于在颌骨囊肿治疗中应用植骨、盖膜的相关疗效分析报告较少。本研究将修复膜和人工合成骨修复材料β 磷酸三钙(β tricalcium phosphate,β TCP)应用于颌骨囊肿术后骨缺损的修复,应用锥形束CT(cone beam computed tomography,CBCT)来评价其成骨效果。
1 材料和方法
1.1 临床资料
随机选取2016年6月—2018年6月于郑州大学第一附属医院口腔颌面外科行手术治疗且经病理证实为牙源性颌骨囊肿的81例患者的临床资料进行分析。根据骨缺损的不同处理方式,按随机数字法将其分为3组(每组27例),具体如下。对照组(A组):不放置任何生物材料;盖膜组(B组):用修复膜覆盖骨缺损区表面;植骨盖膜组(C组):即骨缺损区填塞β TCP并覆盖修复膜。纳入标准:1)1.0 cm≤囊腔直径≤4.0 cm;2)病理学确诊为牙源性颌骨囊肿;3)术前行完善的根管治疗;4)排除全身系统性疾病(如糖尿病、骨代谢异常等);5)术中均行颌骨囊肿刮治术;6)病例资料完善。所有患者术前均行CBCT检查,术后3、6、12个月复查CBCT,测量患者骨缺损区的骨密度,用HU值表示。
1.2 材料
CBCT(KaVo公司,德国)管电压:120 kV,管电流:37 mA,曝光时间27 s,3D分辨率0.25 lp·mm-1。β TCP(Synthes GmbH,强生上海医疗器械有限公司);海奥口腔修复膜(烟台正海生物技术有限公司)。
1.3 方法
全麻下采用龈缘切口,并在距囊肿边界0.5 cm外的近远中黏膜正常骨质上做附加切口,确保切口底部有足够的骨性支撑及血供,翻开黏骨膜瓣,显露病变区,去除骨壁,暴露囊壁,以能彻底摘除囊肿为限,尽可能保留唇颊侧骨板,完整摘除囊肿,搔刮骨腔,骨钻磨除骨腔边缘突出及锐利的骨壁,修整骨创缘,生理盐水冲洗骨腔,对于骨壁活动出血点电凝止血。与上颌窦关系密切者,术中在保证囊肿彻底摘除的基础上尽量减少上颌窦黏膜的损伤,小的缺损衬垫修复膜,4-0可吸收缝线妥善固定,与上颌窦大范围穿通者则实施上颌窦根治术。对照组待新鲜血液充满骨腔,严密缝合创口。盖膜组待骨缺损区充满新鲜血液后,将修复膜置于生理盐水中充分浸透,修剪成适合创面大小,覆盖骨缺损区并与骨面紧密贴合,修复膜边缘超出骨缺损区边缘外0.5~1 cm,用4-0可吸收缝线将修复膜近远中端及基底处与所对应处的黏骨膜缝合固定后,松解黏骨膜瓣,达到复位无张力缝合状态,将黏骨膜瓣准确复位后缝合创口。术中注意避免修复膜伸入创口缝合区。植骨盖膜组将β TCP与骨壁新鲜渗出血液混匀后植入骨缺损区,充填至与骨缺损表面平齐,恢复颌骨的解剖形态,表面覆盖修复膜并固定(方法同B组)(图1),将黏骨膜瓣精确复位达到无张力下严密缝合。术后对症支持治疗,口内切口给予半流食,进食后漱口,保持口腔卫生,勿吮吸。
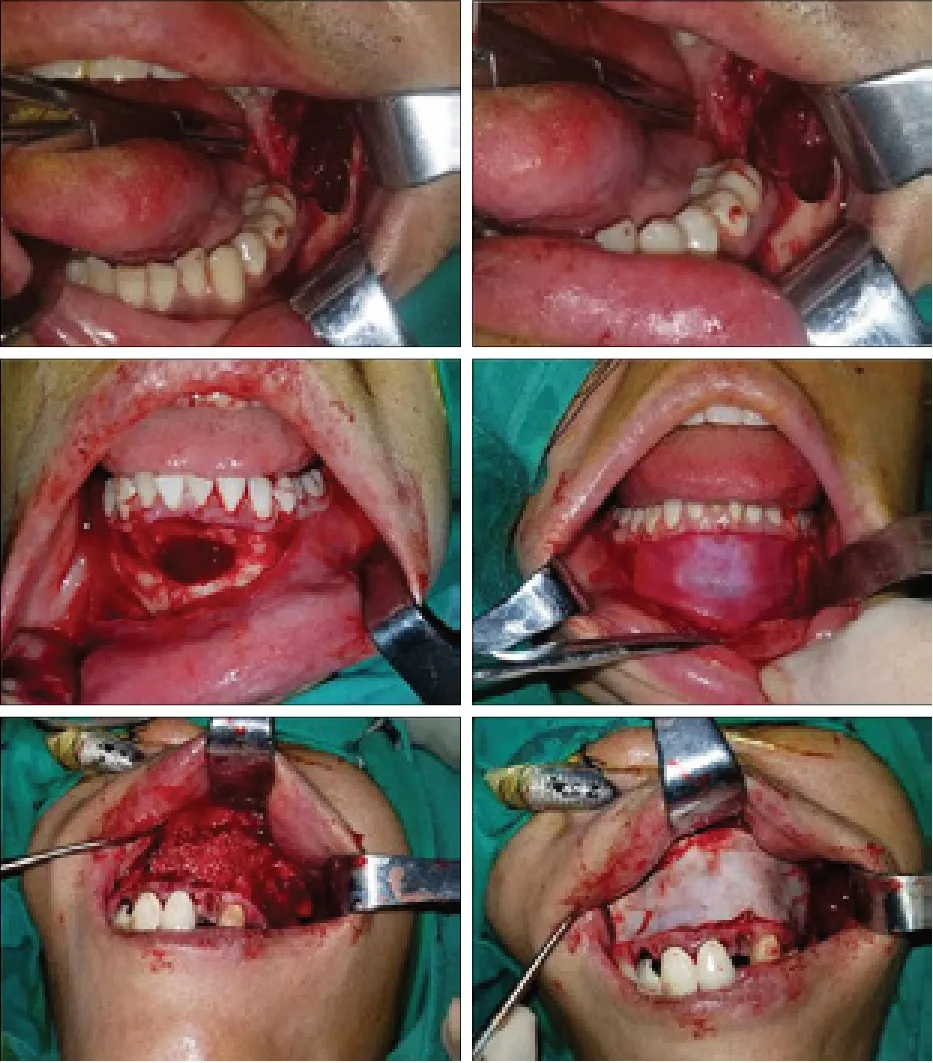
图 1 3组的手术方法Fig 1 The operation methods of the three groups
1.4 评价标准及参数测量
术后3、6、12个月复查CBCT,选取感兴趣区(region of interest,ROI)在三维图像上沿着病变边界勾画,在各个方向尽可能保证ROI大小一致,以降低误差,分别测量并记录颊舌向、近远中向及矢状位方向的CT值,连续测量3次,取均值,用HU值表示,根据HU值行统计学分析来评价骨缺损区的成骨效果。为避免扫描误差,本研究中所有对象的CBCT扫描及测量均由同一位放射科医师完成,拍摄条件一致。
1.5 疗效比较
采用SPSS 21.0统计学软件进行分析,比较3组患者的成骨效果。术前,术后3、6个月之间采用单因素方差分析(F检验);术后12个月数据经正态性检验不符合正态分布,术后3组之间采用非参数多组独立样本Kruskal-Wallis检验分析,P<0.05为差异有统计学意义。
2 结果
纳入研究的81例患者中,男51例,女30例;年龄11~60岁,平均年龄35.6岁;上颌骨前牙区22例,上颌骨后牙区11例,下颌骨体部21例,下颌角及升支27例;与上颌窦关系密切者2例。81例中,术前有合并感染者3例(A组),颊侧瘘道形成者1例(C组),经术前抗生素应用,手术治疗后,该4例患者均伤口愈合良好。对照组术后发生感染1例,经静脉应用抗生素,局部庆大霉素冲洗,2周后顺利恢复。植骨盖膜组有2例出现部分缝合区裂开,给予复方氯己定漱口液,2周后创口顺利愈合。
盖膜组术后6个月骨缺损区与骨壁之间的界限模糊,边缘可见新骨形成,隐约可见骨小梁结构,术后12个月骨缺损区的骨密度明显增高。植骨盖膜组术后6个月植骨区与周围正常骨质间界限已不明显,可见新骨形成的骨小梁结构,术后12个月植骨区与正常骨组织界限模糊,密度基本一致。对照组术后6个月骨缺损区可见较清晰的界限,术后12个月骨缺损区仍显示低密度影,成骨时间和成骨效果明显低于上述2组(图2)。3组患者术前和术后CT值比较结果见表1。统计分析显示,术后3、6、12个月,3组CT值间差异具有统计学意义(P<0.05),B组优于A组(P<0.05),C组优于A组和B组(P<0.05)。
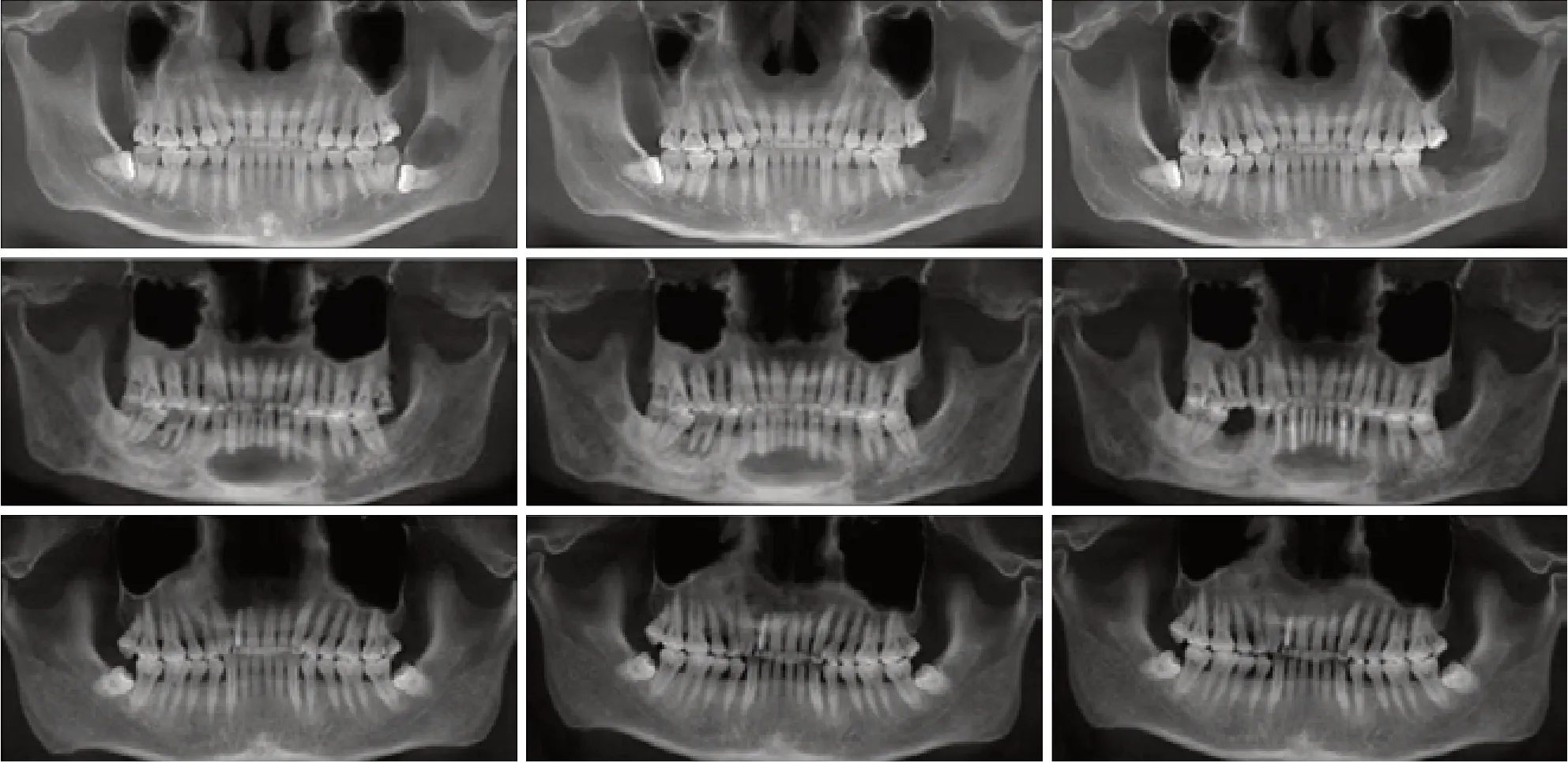
图 2 3组术前和术后的影像学图像比较Fig 2 Comparison of preoperative and postoperative images of the three groups
3 讨论
牙源性颌骨囊肿由成牙组织或牙的上皮或上皮剩余演变而来,生长缓慢,初期无自觉症状,若囊肿继续生长,颌骨膨隆而造成面部畸形。当囊肿发展到严重时,颌骨骨板受压吸收变为极薄,扪压可有乒乓感。颌骨囊肿需手术治疗,常用术式有囊肿摘除术和开窗减压术。开窗减压术作为一种微创术式,对囊肿范围大的病例有其显著的优势,对依从性好的患者有较好的疗效,减压时间一般为6~18个月,部分患者需要二次手术[6]。开窗术需要患者长期佩戴塞治器并反复冲洗,局部有不适感,给患者的生活质量造成一定的影响,其疗效与患者的依从性密切相关。对依从性较差及术后自我管理能力较弱的患者,术式的选择应更为慎重。相对而言,对于依从性较差、囊肿较小、患区存在牙缺失并有迫切修复要求的患者(老年患者为主),刮治术则能体现治疗周期较短的优势。研究[7-8]表明:无论囊肿大小,开窗术骨质形成周期较刮治术同期植入骨粉的周期更长。颌骨囊肿摘除后遗留的无效腔,常是创口延期愈合的主要原因,因此处理好无效腔特别重要。对于小型颌骨囊肿,可以采用血块充填法,即任遗留的骨腔内充满血块待其自行机化、骨化。对于较大的颌骨囊肿,术后遗留的骨腔大,术后感染概率增高[9],另外,牙槽嵴高度或强度得不到恢复,增加了义齿修复的难度,造成咀嚼效率降低或邻牙松动,甚至发生病理性骨折。因此,骨缺损的处理方式将直接影响骨腔修复的质量从而影响患者的愈后和生活质量。

表 1 3组各时间点骨缺损区HU值的比较Tab 1 Comparison of HU value of bone defect area of three groups at different time point x±s
生物膜与骨修复材料相结合的引导骨再生技术(guided bone regeneration,GBR)已逐渐应用于口腔颌面部骨组织的修复,此技术主要是在骨缺损区填塞人工骨粉,并在表面覆盖一层生物膜[10-11]。人工骨粉可支撑起骨缺损修复间隙,在促进新骨形成的同时还可以作为新骨的支架,利于血管和成骨细胞的进入,形成致密骨组织[12-13]。而生物膜可聚集前体成骨细胞,阻止软组织中成纤维细胞及上皮细胞长入骨缺损区,确保了成骨过程在无成纤维细胞干扰的前提下逐渐完成,同时其可有效减缓覆盖组织的压力,促进组织愈合,最后实现缺损区完全的骨修复[14]。
颌骨骨缺损是颌骨囊肿的主要病理特征,骨缺损的修复一般需要较长时间,因此促进缺损部位的骨组织再生是治疗颌骨囊肿相对理想的治疗方法[15]。影响骨组织再生的关键因素之一就是创造良好的骨组织再生环境,利用生物膜的生物屏障引导骨组织向缺损区生长并阻止结缔组织长入骨缺损区的GBR技术即是达成该目标的有效手段。一般来说,囊肿导致骨质吸收破坏或手术操作过程中需要去除部分骨壁等因素均可造成术后骨壁存有缺失,骨壁缺失后的骨腔往往难以充满血液。本研究也发现部分颌骨囊肿术后病理提示伴有不同程度慢性炎症,在骨壁缺失、骨膜破损及炎症状态下,较骨细胞生长速度快得多的成纤维细胞或上皮细胞可能会迅速长入骨腔,严重影响后期新骨的形成。成骨细胞是骨组织再生的细胞学基础,形成良好新骨的关键是保证骨缺损区无非骨生长细胞长入。因此,需人为形成一层屏障膜,保证成骨过程在无干扰环境下完成。本研究中使用的口腔修复膜是牛皮肤组织处理后制备的异种脱细胞真皮基质,主要成分为胶原蛋白,可诱导骨髓和骨膜的成骨细胞贴附在其表面,参与生物降解过程,且降解过程中可释放骨再生所需元素,促进成骨,同时可促进毛细血管再生,具有血管化的作用和良好的机械屏障作用,可阻挡非成骨细胞进入骨缺损区,保障成骨过程顺利完成[16]。研究结果发现:在术后第3、6、12个月时,盖膜组患者的成骨效果明显优于对照组(P<0.05),且未有感染发生。表明口腔修复膜具有良好的生物相容性,能促进骨组织的再生,对骨缺损具有良好的诱导成骨作用,体现了其促进骨缺损区新骨修复的价值。
β TCP是一种经典的骨替代材料,和人骨的无机成分相似,无免疫原性,植入人体后不会发生免疫排斥反应,而且随其吸收降解可以为新生骨所替代,具有良好的生物相容性和降解性[17]。其多孔结构可为骨细胞早期生长提供支撑,并为新骨生长提供足够的空间[18],具有良好的骨传导性。与血液混合,轻度溶解后可形成高钙离子层及微碱性环境,可有效促进成骨细胞的黏附、增殖及分泌基质[19]。与成骨细胞接触后,钙敏感受体激活三磷酸肌醇和促有丝分裂蛋白激酶信号传导通道在成骨细胞上表达,进一步促进成骨细胞增殖,达到良好的诱导成骨[20]。研究结果发现:植骨盖膜组患者的术后第3、6、12个月时的CBCT影像显示的成骨效果不仅显著优于对照组(P<0.05),而且优于单纯盖膜组(P<0.05)。β TCP骨修复材料良好的生物相容性、降解性、骨传导性及骨诱导性,加速了成骨速率,与口腔修复膜的联合应用后,口腔修复膜不仅会保证骨修复材料的稳定性,而且还能阻挡炎性细胞的进入,减少骨吸收,同时为骨壁缺失较大的骨腔提供了良好的黏膜支持,可进一步促进成骨,加快和提高骨缺损区的骨修复效果。
CBCT因其较高的分辨率、较少放射剂量及其良好的三维重建与测量功能,已被成功运用于口腔颌面部骨组织的测量和评估[21]。本研究中,采用CBCT来测量骨密度进行定量分析骨缺损区的成骨效果,结果可靠。
综上,口腔生物膜和β TCP骨修复材料在颌骨骨缺损中具有较好的成骨效果,两者联合应用效果更为显著。CBCT为颌骨骨缺损术后的评价提供了可靠的保证。
利益冲突声明:作者声明本文无利益冲突。
