甲壳素/壳聚糖的分离提取方法及在食品工业中的应用研究现状
2020-10-12袁媛荣雅利杨丰陈露珠施文正汪之和
袁媛,荣雅利,杨丰,陈露珠,施文正,2,汪之和*
1(上海海洋大学 食品学院,上海,201306)2(国家淡水水产品加工技术研发分中心,上海,201306)
随着我国养殖、捕捞技术的进步,我国水产加工业飞速发展,同时也导致水产品加工废弃物激增。然而,这些废弃物中往往含有可利用的高价值物质,包括蛋白质、矿物质,ω-3不饱和脂肪酸、甲壳素、虾青素和其他生物活性物质等[1],其中甲壳素(chitin)是迄今为止仅次于纤维素的第二大可再生天然聚合物,每年的生物合成量约为100亿t[2]。甲壳素资源丰富并具有许多特殊的生物理化性质,被认为是可替代石油的生物燃料和其他功能性化合物的生物质来源[3]。作为二十一世纪环境友好型的新型生物高分子材料,甲壳素具有广阔的应用前景和较高的商业价值。
甲壳素学名为(1,4)-2-乙酰胺-2-脱氧-β-D葡聚糖,相对分子质量从几十万到几百万,在自然界中广泛存在于具壳海洋生物的外壳中[4-5]。甲壳素无毒、可降解,且具有良好的生物相容性,不易引起受体的免疫反应,在医疗方面应用前景广阔。但由于甲壳素疏水性较强,仅溶于氟醇(六氟异丙醇、六氟丙酮等)、碱性冰水混合物等特定溶剂中[3],应用范围受到很大限制,其经济价值长期未能得到应有体现;壳聚糖(Chitosan)学名为(1,4)-2-氨基-2-脱氧-β-D葡聚糖,相对分子质量从数十万至数百万不等[6],是甲壳素N-脱乙酰基的产物,可溶于大部分稀酸中,一般脱乙酰化程度大于50.0% 的甲壳素就被认为是壳聚糖[7]。壳聚糖的氨基上可以连接各种不同的活性基团而表现具有不同的生物活性功能[8],如抗菌性、吸湿性、生物相容性和吸附性等[9-10],可用于食品、医药、农业、日化产业以及水处理等领域,尤其是在食品抗菌、包装、添加剂等方面应用较多[11]。
1 甲壳素研究
1.1 甲壳素的来源和类型
甲壳素由BRACONNOT教授于1811年在蘑菇中首次发现;1823年,ODIER在昆虫的外壳中再次发现同种物质,并命名为Chitin;1859年,ROUGHET发现甲壳素经过化学处理后可以转化为水溶性形式;1870年之后,这种改性甲壳素被命名为壳聚糖[12]。一百多年来,越来越多的生物中被发现含有甲壳素,甲壳素的含量可随生物种类和季节变化而变化[8]。干重条件下,不同生物体甲壳素含量(外壳、菌丝体、软骨等中)见表1。
甲壳素是长链高分子化合物,分子结构见图1-a,由于链的规整性和分子刚性较大,易形成分子内氢键和分子间氢键,有利于晶态的形成和转化成新的衍生物[3]。如图1-b,甲壳素根据分子链排列方式的不同可分为α、β、γ(从左往右)3种不同的类型。其中α-构型甲壳素最为常见,存在于节肢动物和真菌细胞壁中;β-甲壳素多见于软体动物(如鱿鱼、章鱼)软骨中,对溶剂有更高的亲和力[17];γ-甲壳素比较少见,存在于成年蝗虫、蟑螂、螳螂等昆虫中[18]。α-甲壳素分子结构紧密,通过氢键牢牢地固定在一起,呈片层状;β-甲壳素具有较低的层间氢键,易发生膨胀和渗透。

表1 不同来源生物体的甲壳素含量Table 1 Chitin content of organisms from different sources
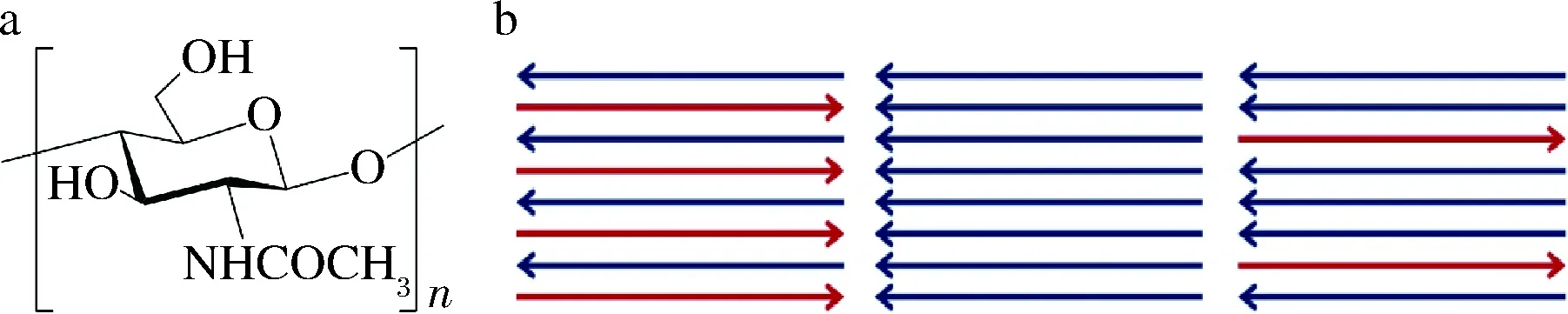
a-甲壳素分子结构;b-甲壳素分子链的3种排列方式图1 甲壳素分子结构及不同构型甲壳素的分子链排列方式Fig.1 Molecular structure of chitin and arrangement of molecular chains of chitin with different configurations
1.2 甲壳素的分离提取方法
我国目前工业生产甲壳素/壳聚糖的主要原料是水产品加工中废弃的虾蟹壳,其中含有约30%~40%的蛋白质、30%~50%的矿物盐(主要是CaCO3)和20%~30%的甲壳素及少量色素(如虾青素)和脂类,提取甲壳素的关键就是去除其中的CaCO3和蛋白质等主要物质[10]。目前甲壳素的提取方法主要有化学法和生物法[19],近年来各种绿色简单的新方法也在不断地被开发。
1.2.1 化学法提取甲壳素
化学法又称酸碱法,是提取甲壳素的传统方法,也是当前产业化法提取的主要方法。化学法包括“三脱”,即脱矿、脱蛋白和脱色,常用酸脱矿、碱脱蛋白、有机溶剂或氧化剂脱色,有时也会通过物理超声或微波辅助优化提取率。李晔等[20]通过超声间歇酸碱法,减少了酸碱使用量,提取物产率为19.6%;蓝尉冰等[21]采用微波消解辅助制备甲壳素,改善了南美白对虾中甲壳素提取的得率和工艺周期。化学法虽然简单高效,但会产生大量的酸碱废液,并且蛋白质、矿物质等有效成分经酸碱处理后无法回收,越来越多的学者尝试开发新的提取方法。
1.2.2 生物法提取甲壳素
未名湖上,黄龙旗航模舰队和太阳旗航模舰队又战成了一团,不过这次战斗的操作方,分别是清华附小和北大附小的同学们……
生物法的原理是利用一些细菌和真菌发酵体产生的有机酸或蛋白酶来去除蛋白质和钙盐,从而达到制取甲壳素的目的,与化学法的比较见图2。用于发酵提取甲壳素的微生物主要有芽孢杆菌属、乳杆菌属、沙雷氏菌属、嗜热链球菌等,其中乳杆菌属研究最多。李丽等[22]以蟹肉罐头下脚料为原料,在自然pH条件下筛选出较优的蛋白酶酶解脱蛋白,再通过柠檬酸脱钙、H2O2脱色,制得甲壳素得率13.71%;LIU等[23]用鼠李糖乳杆菌和淀粉芽孢杆菌连续两步发酵法从对虾虾壳中提取甲壳素,保持了与市售甲壳素相似的理化和结构特性。生物法提取的甲壳素具有较高的营养价值,可作为动物饲料甚至营养保健品;但是该方法耗时长、成本较贵,与化学法的优缺点比较见表2。
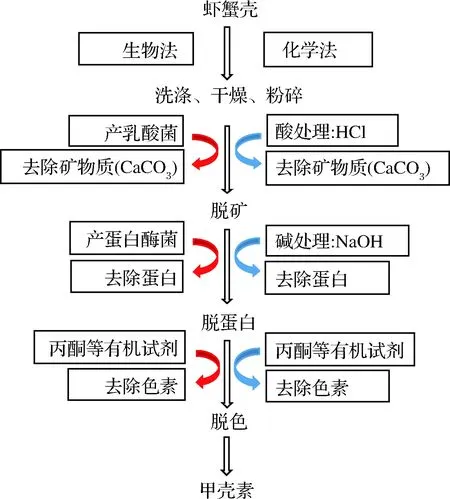
图2 化学法和生物法提取甲壳素的工艺流程Fig.2 technological process of chitin extraction by chemical and biological methods
国内外也有许多学者采用酶法和化学法相结合的新思路来制备甲壳素,条件温和,不仅解决了污染问题,而且其中的蛋白与钙盐也得到了回收利用,段元斐等[24]以螃蟹壳为原料,采用复合酶降解蛋白、有机酸脱钙、乙醇脱色制取食品级甲壳素,并循环利用柠檬酸脱钙后的废液,制取柠檬酸钙晶体;YOUNES等[25]用1.5 mol/L的稀HCl溶液脱矿,再用Bromelain和Alcalase两种商业蛋白酶在60 ℃酶解实现虾壳废料脱蛋白,得到纯度较高的甲壳素。
1.2.3 其他提取甲壳素的新型方法
近几年来,针对甲壳素的提取,国内外许多学者尝试使用其他新型绿色方法制备高品质甲壳素,以减少传统化学法带来的环境污染和生物法工艺周期长的问题。

表2 化学法和生物法提取甲壳素的比较Table 2 Comparison of chitin extraction by chemical method and biological method
(1)乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)辅助法:EDTA是一种优良的金属螯合剂(如Ca2+、Mg2+),可代替酸脱矿并且对甲壳素分子链的影响较小。王婷[26]利用EDTA螯合剂代替酸去除矿物质,制得克氏原螯虾甲壳素的提取率为20%,高于生物发酵法。
(2)电解水法:电解水法的原理是通过电解稀盐(通常是NaCl)溶液产生酸性和碱性电解液代替传统工艺中使用的HCl和NaOH提取甲壳素,与传统工艺相比,电解水法产品品质更高,污染更小。韩晓梅等[27]采用乳酸与碱性电解水联合处理脱除蟹壳中的矿物质与蛋白质,制备乳酸钙和甲壳素,大大减少了酸碱使用量。
(3)离子液体(ionic liquids,IL)法:离子液体是一种由有机阳离子和有机或无机阴离子组成的低温熔融盐,在适当温度和时间条件下能够溶解矿物质、蛋白质和甲壳素,再在混合体系加入反溶剂(如H2O)沉淀甲壳素,其他物质则从离子液体废液中被脱除,提取温度、时间和离子液体种类对甲壳素得率有很大影响[28]。LETA等[29]使用多种铵基离子液体(乙酸二异丙基乙基铵、丙酸二异丙基乙基铵和乙酸二甲基丁铵)在110 ℃下反应24 h提取甲壳素,得率可达13.4%。
(4)低共熔溶剂(deep eutectic solvent,DES)法:DES是一种由氢键供体(如多元醇、尿素和羧酸等)和氢键受体(如氯化胆碱等)形成的二元/三元体系的共晶溶剂[30],作为一种与IL性质类似、但毒性和成本更低的新型绿色溶剂,可替代IL用于甲壳素等天然有机成分的分离提取。SARAVANA等[31]利用不同类型的DES从虾壳中提取甲壳素并制成膜,发现用DES-8(氯化胆碱丙二酸)合成的甲壳素得率最高,达19.41%,并且DES膜的力学、溶胀和生物降解性能与标准膜相似。
以上新型方法旨在提高甲壳素产品质量、减少提取周期和环境污染,但仍存在不少弊端限制了其工业化大规模生产。其中EDTA辅助法的一次性投资较大;电解水法得率较低且较耗时;IL法的产品安全性并未得到求证、成本较高;DES法的溶剂黏度较高、操作困难,且得到甲壳素的热稳定性不及传统法[30,32]。基于以上弊端,以上新型方法仅限于实验室规模研究。
2 壳聚糖研究
2.1 壳聚糖的结构与性质
壳聚糖是甲壳素经脱乙酰化的产物,是接合菌细胞壁的重要组分,也存在于担子菌、子囊菌和藻菌纲的菌丝体、茎秆和孢子中[33]。壳聚糖分子基本结构如图3,也可分为 α、β、γ 3个构型。
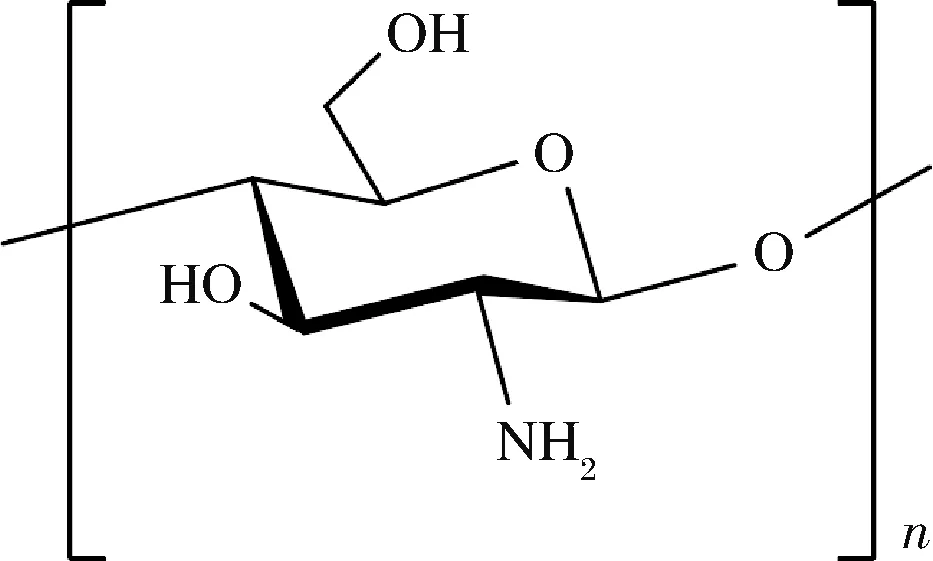
图3 壳聚糖的分子结构图Fig.3 Molecular structure of chitosan
壳聚糖含有3个反应性官能团,1个氨基和位于C6和C3位的2个羟基。氨基正电荷的存在使得壳聚糖成为自然界中唯一一种带阳离子的天然多糖,—NH2的多寡同时也反映了壳聚糖的脱乙酰化程度。同时,氨基和羟基在经过酰化、羟基化、醚化、烷基化、酯化、接枝共聚、交联、螯合等一系列化学修饰后[34],形成的壳聚糖衍生物能进一步改善壳聚糖的溶解性和生物活性;这些官能团也为壳聚糖提供了加工成凝胶、涂层膜、包装膜、纳米纤维、支架、海绵状物质、微粒和纳米颗粒的条件,提高其生物抗氧化性、抗菌性和渗透性[35]。此外壳聚糖可直接进一步水解得到低聚壳聚糖,相对分子质量降至103左右[16],同水解前相比,水解后的低分子质量壳聚糖的抑菌活性大大提高[3]。
2.3 壳聚糖的制备方法
2.3.1 化学法制备壳聚糖
化学法制备壳聚糖的常规做法是将甲壳素与40%~50%NaOH加热混合,不同脱乙酰度的壳聚糖与反应温度、时间和碱溶液浓度有关。碱处理后可将甲壳素中的N-乙酰基-D-氨基葡萄糖转化为带有游离—NH2基团的D-氨基葡萄糖单元[36]。但碱处理易造成环境污染,同时制得的壳聚糖易发生热降解和分子链的过度水解,从而降低壳聚糖的品质。因而有学者提出采用资源化法从水产品中制备壳聚糖[1,16],工艺步骤如图4所示。这项技术的关键,一是将虾、蟹壳中的有用成分都转化为有用之物,二是在海边的生产厂家可使用海水,减少淡水的消耗。化学法使壳聚糖的脱乙酰度快速增加,进而提高溶解度,但制得的壳聚糖易发生热降解和分子链的过度水解,从而影响壳聚糖的品质。
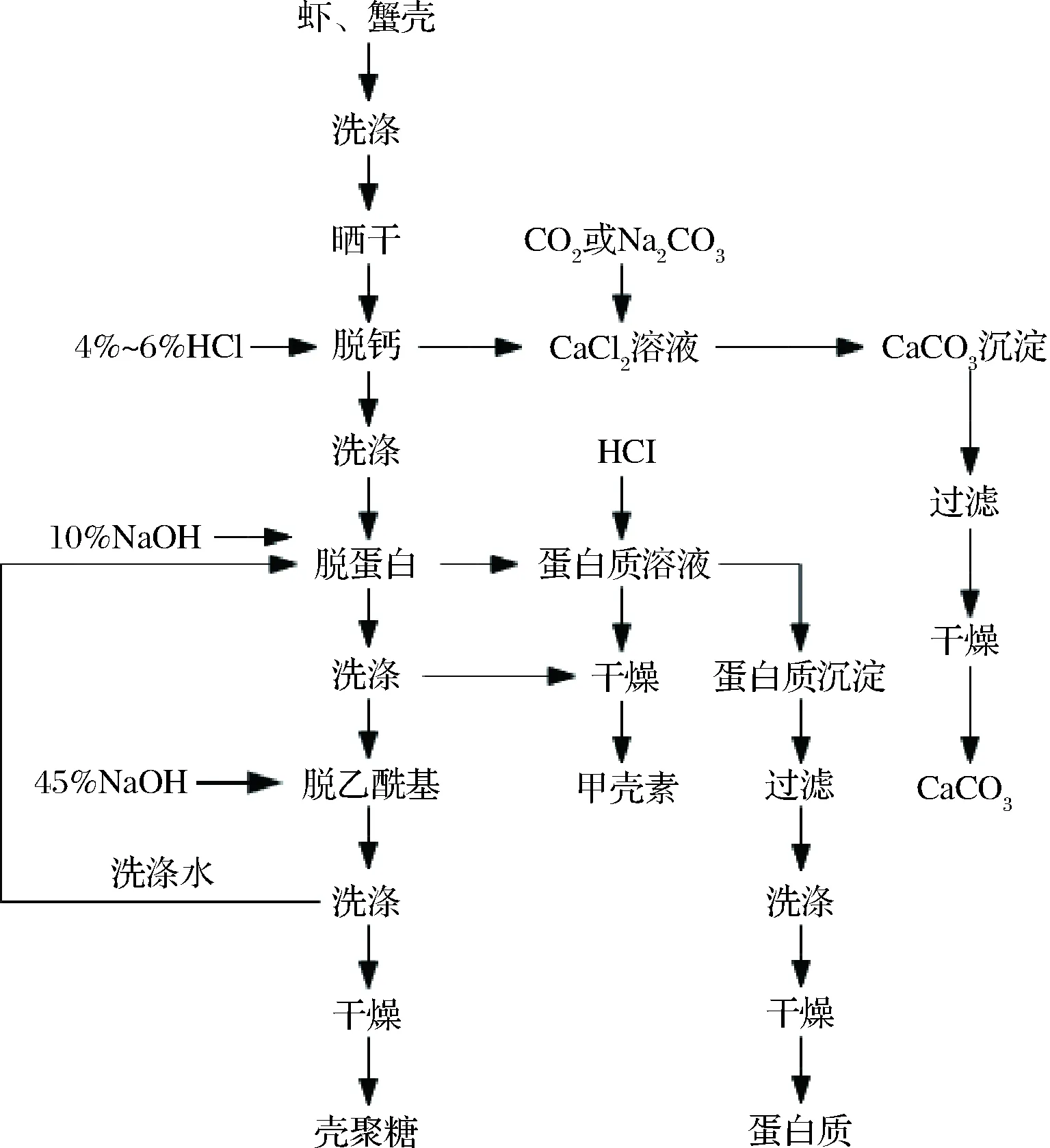
图4 资源化法制备壳聚糖Fig.4 Preparation of chitosan by resource method
2.3.2 生物法制备壳聚糖
生物酶法制备壳聚糖的原理是利用专一性酶对甲壳素进行脱乙酰基反应,可特异性、选择性地切断壳聚糖的 β-(1,4)糖苷键,降解过程和分子质量易于控制,条件温和,对环境污染较少[2]。酶法制备壳聚糖是利用专一性酶对甲壳素进行脱乙酰基反应,该法的关键是获得甲壳素脱乙酰酶(chitin deacetylase,CDA)。CDA酶解没有标准的脱乙酰路径,不同的CDA会在不同位置的N-乙酰基发生反应。温度、pH值、金属离子的作用对酶的活性具有很大影响。CDA存在于多种真菌及部分海洋细菌中,产CDA真菌分为(1)细胞质中存在CDA的Mucorrouxii和Absidiacoerulea;(2)胞外菌种培养中分泌CDA的Aspergillusnidulans及Colletotrichumlindemuthianum,海洋细菌CDA主要源于弧菌属如Vibrioparahaemolyticus和Vibriocholerae[37]。目前CDA研究对象主要来源于废弃的真菌,而细菌CDA的开发需要耗时耗力的菌种采集、初筛、复筛、鉴定和复杂的生物信息学表征,我国海洋资源丰富,细菌CDA的研究随着宏基因组学和基因测序的发展具有更大的研究空间[38-39]。与化学法相比,生物法制备壳聚糖减少了环境污染,且具有较高的纯度和品质,适用于食品工业。然而,由于产CDA菌株的来源少、产酶菌株活力不高、酶活较低等问题,该法仍停留在实验室研究阶段。
3 甲壳素/壳聚糖在食品工业的应用
甲壳素/壳聚糖成本低廉,并且对人体无毒无害,在食品工业中的应用尤其广泛。国内外的各种机构都在积极研究这一物质的应用,日本开发的以甲壳素/壳聚糖为原材料的食品就达二十多种,对我国的食品工业有一定的启示作用,近年来我国也在积极开展该产品在食品工业的应用研究。
3.1 功能性食品
甲壳素/壳聚糖作为一种天然高分子多糖,是一种优良的功能性食品和保健品,甚至被称作是继维他命丸、卵磷脂以及螺旋藻之后的第三代保健食品[40]。壳聚糖的阳性氨基基团能捕捉人体中带负电的脂肪和Cl-,也能通过静电作用结合胆汁酸,低分子质量壳聚糖甚至可渗透并修复胰岛细胞,在降血脂、降血糖、降胆固醇、稳定血压等方面发挥着巨大作用[41]。LÜTJOHANN等[42]给116名肥胖患者服用壳聚糖后发现,患者血清中低密度脂蛋白和胆固醇含量显著降低。PANITH等[43]发现壳聚糖可与胆固醇和胆汁酸有效结合,同时具有一定的脂肪结合能力并随其分子质量的提高而显著提高。
3.2 食品保鲜剂
壳聚糖具有成膜性和无毒性,将壳聚糖涂抹于果蔬表面可减少果蔬蒸腾作用,阻挡外界O2进入膜内,提高果蔬组织内CO2含量和减少乙烯逸出,达到果蔬保鲜的效果[44]。为了进一步提高壳聚糖膜的性能,常使用增塑剂和交联剂,将壳聚糖与纳米粒子、纤维和晶须等填料嵌入或与天然提取物和精油以及其他天然和合成聚合物混合,但该方法大多仍处于实验室研究阶段[45]。谭福能等[46]采用质量分数为1% 羧甲基壳聚糖、0.8%(质量分数)海藻酸钠和纳米二氧化硅为原料配制成复合保鲜液,对新鲜草莓进行涂膜处理后发现,复合保鲜液涂膜处理组的草莓保鲜效果最好,能有效阻止草莓水分的散失并抑制代谢,且随着羧甲基壳聚糖取代度的增大,复合涂膜的保鲜效果有一定的提升。壳聚糖共混膜涂在水产品或肉制品表面,能与其中带负电荷的脂质结合,减缓贮藏期间其脂质过氧化反应的发生,并抑制腐败性细菌的繁殖[47]。ZHANG等[48]用壳聚糖-明胶基材包埋龙蒿精油装载的纳米胶囊复合膜涂于猪肉表面,提高猪肉的抗氧化、抗菌效果和感官品质。XIONG等[49]研制的葡萄籽提取物/nisin复合的壳聚糖-明胶可食膜体系,1%壳聚糖能有效地抑制猪肉氧化和微生物腐败;1%壳聚糖与3%明胶和0.5%葡萄籽提取物加入后能进一步提高肉的抗氧化效果。
3.3 可食用包装膜
壳聚糖的氨基基团可与微生物细胞膜表面的负电荷物质结合,也可以络合微生物细胞中的金属离子(通常作为酶的辅助因子),制成薄膜后可对多种食物中有毒细菌和真菌表现出优异的抗菌活性,可以作为一种无毒、可食用、可降解的新型绿色包装膜[34,50]。壳聚糖包装膜的性能和其脱乙酰度、溶剂pH、溶剂类型、分子质量等因素有关,也通常与多糖、蛋白质、合成聚合物等共混提高膜的机械性能、O2和水蒸气阻隔率[45]。MORADI等[51]以壳聚糖-低密度聚乙烯双层膜为材料,采用低温等离子体结合夏季香精油制膜对鸡肉保鲜,结果表明等离子体处理可以改善薄膜的性能,夏香精油的壳聚糖/聚乙烯薄膜降低了水蒸气和氧透过率,也提高了膜的拉伸强度和断裂伸长率,从而提高鸡肉的货架期。
3.4 食品絮凝剂
壳聚糖分子上存在游离的带正电氨基,能够和酸及多酚类物质进行反应,并且它的长链线状结构可在同一分子上吸附多微粒杂质并形成絮团,达到澄清液体食品的效果,不会影响食品的原有营养成分和风味,操作方便成本低[52-53]。ABDELMALEK等[54]使用壳聚糖作为澄清剂加入苹果汁中,其透光率从原本的7.9%提高到91.1%。GASSARA等[55]研究了甲壳素和壳聚糖作为非均相絮凝剂在啤酒中的絮凝效果,通过比较啤酒的浊度、黏度、总固形物、总悬浮物、总多酚和zeta电位等指标,发现甲壳素和壳聚糖均能絮凝啤酒中的胶体颗粒,且优于传统絮凝剂。
3.5 水处理吸附剂
壳聚糖分子结构中含有大量氨基N原子上的孤对电子,可进入到重金属离子的空轨道中,通过配位键结合,形成很好的螯合物,能吸附如Pb(Ⅱ),Cr(Ⅵ),Cu(Ⅱ)重金属离子,形成稳定的螯合物,使直链的壳聚糖形成交链的高聚物,净化废水[56 ]。但壳聚糖在酸性条件下有不稳定、易溶解等缺陷,限制了其广泛应用。近年来,通过合成壳聚糖复合材料选择性地去除食品废水中的金属离子[57],也可通过对壳聚糖自身引入化学基团以提升其水溶性、电荷密度、相对分子质量及选择性[58]。SONG等[59]制备了一种新型磁性硫/季铵化壳聚糖复合吸附剂,在中性条件下对所有被测金属离子(As(Ⅴ)、As(Ⅲ)、Cu2+、Hg2+、Zn2+、Cd2+、Pb2+)的去除率均较高,对Pb2+的吸附量高达235.63 mg/g,且具有良好的再生性能。
4 结论与展望
甲壳素/壳聚糖是一种新兴的生物高分子材料,具有无毒性和较高的生物活性。甲壳素/壳聚糖来源范围广泛,工业上主要从废弃的虾蟹壳提取,提取方法主要可分为化学法和生物法。化学法作为现行的工业化提取工艺,虽然简单高效,但是提取过程中使用的大量酸碱,容易造成环境污染和降低甲壳素/壳聚糖的品质,不符合绿色环保的循环经济理念。生物法是节能、环境友好型的生产技术,可以生产优质的甲壳素和壳聚糖,但成本昂贵、产酸产酶速度慢、脱矿脱蛋白不充分、CDA 菌株活力不高等弊端,也成为了限制其工业化进程的关键问题。甲壳素/壳聚糖可应用在诸多领域,尤其是在食品工业中运用广泛,可用作功能性食品、食品保鲜剂、可食用包装膜、食品絮凝剂、水处理吸附剂等,但仍旧存在工业化程度低、产品性质不稳定、溶解性差的问题。鉴于以上诸多问题,可以从以下几个方面进行改进:
在分离提取方面:(1)将化学/生物/物理法有机结合探索新的提取工艺,提高产品品质和资源利用率,扩大工业化规模;(2)通过诱变筛选优良高产菌种,优化发酵参数从而提高发酵效率,加强CDA源细菌的采集和基因库的完善。另外,为了扩大甲壳素/壳聚糖成品在食品工业的应用范围,可从以下方面入手:(1)对甲壳素/壳聚糖进行高品质的纯化和深加工,探索控制产品分子质量、黏度和溶解性的方法。(2)进一步加大对甲壳素及壳聚糖衍生物的研发力度,提倡绿色环保的同时,进一步探索不同衍生物的生物活性,增加高附加值产品的产出,实现其更广泛的应用。
