整合素β1在大鼠两种脑损伤模型中的差异性表达
2020-10-12
(皖南医学院法医学院,安徽 芜湖 241002)
颅脑损伤的致伤方式推断是法医病理学的重要任务之一,不同的致伤方式如直线加速运动与旋转加速运动造成的损伤各具特征。目前对这些特征的检验,仍以大体形态观察与传统组织病理学检验为主。一些成熟的技术如免疫组织化学方法却未得到广泛应用,致使较多信息不能及早发现甚至遗漏,对致伤方式的推断产生不利影响。颅脑损伤过程中,机械力传导途径包括细胞外基质-整合素-细胞骨架系统、膜离子通道、膜受体及信号传导系统等,其中整合素是关键环节[1-2]。本研究对直线加速与旋转加速大鼠脑损伤模型脑组织内整合素β1(integrin β1)的表达差异性进行比较,初步探讨利用免疫组织化学方法检测integrin β1在脑组织内表达的特征推断颅脑损伤致伤方式的可行性。
1 材料与方法
1.1 材料
1.1.1 实验动物与分组
健康SD大鼠120只,雌雄不限,体质量(300±20)g,随机分为直线加速损伤组、旋转加速损伤组、假手术组及正常对照组,每组30只。损伤组按损伤发生经过时间再分为伤后30min、3h、6h、12h、3d和7d组,假手术组与正常对照组也分别于上述相应6个时间点处死大鼠。
本实验经皖南医学院伦理委员会审核通过,符合《实验动物福利伦理审查指南》要求。
1.1.2 实验试剂
integrin β1抗体、SABC试剂盒和DAB显色试剂盒(英国Abcam公司),多聚赖氨酸防脱玻片(北京中杉金桥生物技术有限公司),聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜(美国Millipore公司),辣根过氧化物酶标记山羊抗兔IgG(上海碧云天生物技术有限公司),RIPA裂解液(美国Sigma公司)。
1.2 方法
1.2.1 动物模型制作
大鼠直线加速脑损伤模型采用液压冲击法[3]。用2%戊巴比妥钠溶液(40mg/kg)腹腔注射麻醉,麻醉成功后,使大鼠呈俯卧位,将头部固定于脑立体定向仪(安徽正华生物仪器设备有限公司)上,剪去顶部皮毛,碘附消毒,沿正中线切开头皮,暴露颅骨,在距前囟后方5mm中线处开直径5mm圆形骨窗,保持硬脑膜完整。将打击管通过骨窗水平安置于硬脑膜外,并严密固定在颅骨上。将打击管接到液压冲击颅脑损伤仪(北京思睿维科技有限公司)打击口,保持打击管内为密闭空间。将摆锤按实验设计液压压力要求轻度打击(1个标准大气压,约100kPa),对大鼠颅脑造成冲击损伤。
大鼠旋转加速脑损伤模型采用单摆式打击法[4]。同上述方法麻醉大鼠,剪去顶部皮毛,暴露颅骨,不开颅,打击锤以120°初始角度下落,打击大鼠枕外隆突。
假手术组同上述方法麻醉大鼠,剪去顶部皮毛,暴露颅骨,钻孔至硬脑膜而不形成骨窗。
正常对照组不做任何处理。
将各组大鼠在设定的时间用颈椎脱臼法处死,迅速取出大鼠全脑,将额叶、丘脑、枕叶及脑干左右等分,一半用于常规石蜡包埋切片和integrin β1免疫组织化学染色,另一半用于Western印迹法检测。
1.2.2 免疫组织化学染色
免疫组织化学染色参照SABC试剂盒说明书进行,步骤如下:石蜡切片常规脱蜡至水,3%H2O2室温灭活10min,复合消化液修复20min,5%牛血清白蛋白(bovine serum albumin,BSA)室温封闭20 min,一抗室温孵育2 h,二抗室温孵育30 min,SABC室温孵育30min,DAB显色,苏木精轻度复染,脱水,透明,封片。以细胞出现棕黄色或棕褐色产物为阳性结果。以磷酸盐缓冲液(phosphate buffer saline,PBS)取代一抗作为空白对照。
1.2.3 Western印迹法检测
冰上快速分离待检脑组织,加入裂解液,二喹啉甲酸(bicinchoninic acid,BCA)法蛋白质定量后,聚丙烯酰胺凝胶电泳,PVDF膜电转印,封闭,加一抗integrin β1抗体,按1∶1 000稀释,4℃孵育过夜,二抗(山羊抗兔)按1∶5 000稀释,室温孵育2 h,增强化学发光(enhanced chemiluminescence,ECL)显色。内参 βactin抗体(1∶1000)同法进行Western印迹法检测。
1.2.4 图像分析及统计学处理
使用Motic Images Advanced 3.0图像分析系统统计integrin β1免疫阳性表达物。随机选择5个相邻视野,400倍光镜下计算阳性表达细胞数,最终取5个视野的平均值,各组所获得的数据用±s表示。采用SPSS 18.0软件进行单因素方差和q检验。检验水准α=0.05。
2 结 果
2.1 大体及HE染色结果
直线加速损伤组和旋转加速损伤组大鼠损伤后大脑表面基本正常,未见挫伤出血灶。镜下见伤后不同时间点大鼠脑组织内神经元肿胀、胞质红染加深,胶质细胞肿胀、增生及噬神经细胞现象,细胞间质水肿等征象。上述征象主要见于枕部脑组织内。假手术组及正常对照组大鼠脑组织无明显形态学改变。
2.2 免疫组织化学染色结果
大鼠在脑损伤后30 min即可观察到integrin β1阳性表达,枕部打击部位脑组织尤为明显,阳性产物呈黄褐色,位于胶质细胞细胞膜、微血管周围,随着损伤经过时间的延长也可见部分神经元周边胶质细胞增生并呈阳性表达,同时伴有细胞间质水肿、胶质细胞肿胀等征象。integrin β1阳性表达与损伤发生经过时间相关,损伤经过时间越长,表达越强,表现为染色加深、阳性细胞数增多及分布范围扩大,伤后6h达高峰并维持3d左右,随后呈下降趋势,1周内仍有表达,呈现时序性变化规律。正常对照组及假手术组有少数部位胶质细胞周边、微血管壁integrin β1呈弱阳性表达。
大鼠脑损伤后脑组织中integrin β1阳性表达并非呈均匀分布,致伤方式不同其空间分布呈现不同特点。直线加速损伤组大鼠integrin β1在枕叶脑皮质(直接打击部位)、额叶脑皮质等部位阳性表达较强,尤其是直接打击部位表达最强,脑干部位表达则弱;旋转加速损伤组大鼠integrin β1表达主要分布在枕叶脑皮质(直接打击部位)、丘脑、脑干等部位,也以直接打击部位表达最强,额叶脑皮质处表达较弱(图1)。在同一时间窗口期,额叶处integrin β1阳性细胞数在直线加速损伤组明显高于旋转加速损伤组(P<0.05),旋转加速损伤组脑干处integrin β1阳性细胞数则高于直线加速损伤组(P<0.05),而在枕部打击点及丘脑部位integrin β1阳性表达差异则无统计学意义(P>0.05)。详见表1。
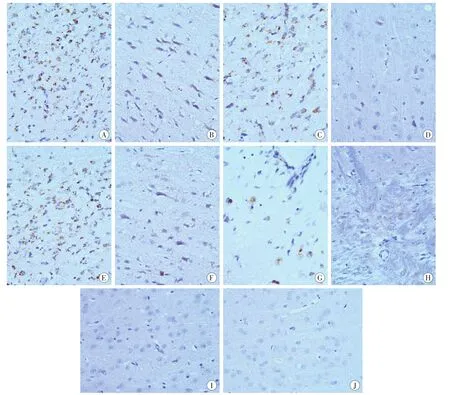
图1 两种脑损伤模型大鼠伤后6h脑组织内integrin β1的表达(苏木精复染,SABC×400)Fig.1 Expression of integrin β1 in two traumatic brain injury models of rats 6h after injury(Hematoxylin counterstaining,SABC×400)
表1 两种脑损伤模型大鼠伤后不同时间点额叶、脑干、枕叶和丘脑中integrin β1的表达Tab.1 Expression of integrin β1 in the frontal lobe,brain stem,occipital lobe and thalamus of rats in two traumatic brain injury models at different time points after injury (n=30,±s)
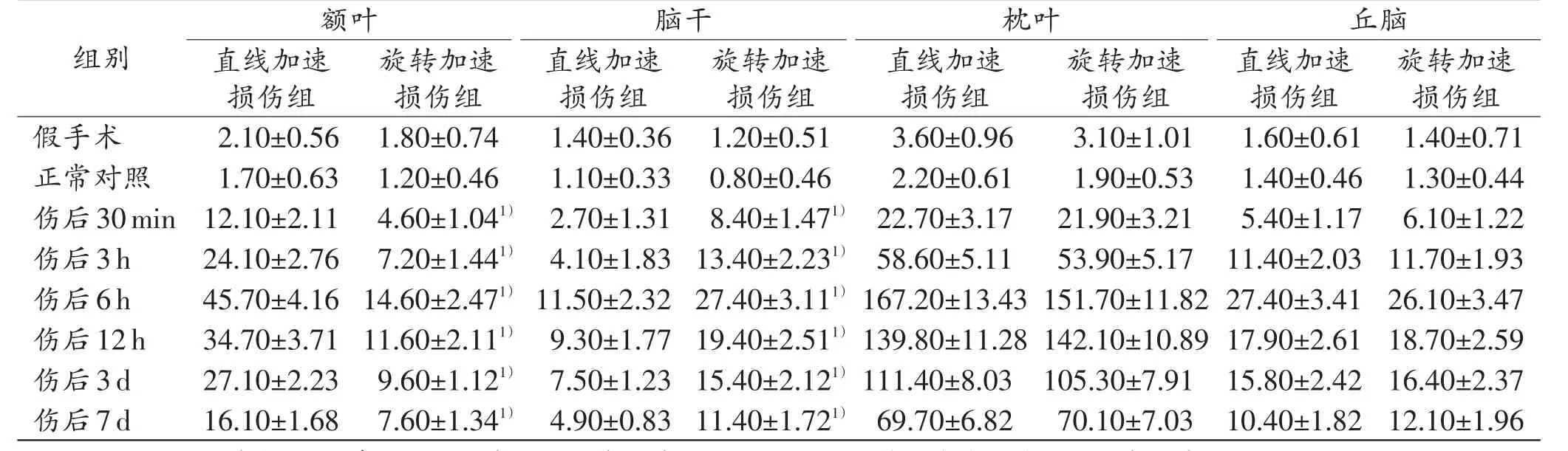
表1 两种脑损伤模型大鼠伤后不同时间点额叶、脑干、枕叶和丘脑中integrin β1的表达Tab.1 Expression of integrin β1 in the frontal lobe,brain stem,occipital lobe and thalamus of rats in two traumatic brain injury models at different time points after injury (n=30,±s)
注:各损伤组与假手术组、正常对照组及相邻上组相同部位比较,P<0.05;1)与直线加速损伤组相同部位比较,P<0.05。
组别假手术正常对照伤后30min伤后3h伤后6h伤后12h伤后3d伤后7d额叶直线加速损伤组2.10±0.56 1.70±0.63 12.10±2.11 24.10±2.76 45.70±4.16 34.70±3.71 27.10±2.23 16.10±1.68旋转加速损伤组1.80±0.74 1.20±0.46 4.60±1.041)7.20±1.441)14.60±2.471)11.60±2.111)9.60±1.121)7.60±1.341)脑干直线加速损伤组1.40±0.36 1.10±0.33 2.70±1.31 4.10±1.83 11.50±2.32 9.30±1.77 7.50±1.23 4.90±0.83旋转加速损伤组1.20±0.51 0.80±0.46 8.40±1.471)13.40±2.231)27.40±3.111)19.40±2.511)15.40±2.121)11.40±1.721)枕叶直线加速损伤组3.60±0.96 2.20±0.61 22.70±3.17 58.60±5.11 167.20±13.43 139.80±11.28 111.40±8.03 69.70±6.82旋转加速损伤组3.10±1.01 1.90±0.53 21.90±3.21 53.90±5.17 151.70±11.82 142.10±10.89 105.30±7.91 70.10±7.03丘脑直线加速损伤组1.60±0.61 1.40±0.46 5.40±1.17 11.40±2.03 27.40±3.41 17.90±2.61 15.80±2.42 10.40±1.82旋转加速损伤组1.40±0.71 1.30±0.44 6.10±1.22 11.70±1.93 26.10±3.47 18.70±2.59 16.40±2.37 12.10±1.96
2.3 Western印迹法检测结果
两个损伤组大鼠脑组织内integrin β1均于伤后30min开始增加,伤后6h达高峰,持续1周左右。直线加速损伤组与旋转加速损伤组大鼠integrin β1阳性表达区域均以枕部为主。但在额叶处直线加速损伤组integrin β1阳性表达明显强于旋转加速损伤组,而在脑干处直线加速损伤组大鼠integrin β1阳性表达则较旋转加速损伤组减弱(图2)。假手术组与正常对照组大鼠脑组织内仅检测到少量integrin β1阳性表达。

图2 两种脑损伤模型大鼠伤后6h脑组织内integrin β1的蛋白表达(Western印迹法)Fig.2 Protein expression of integrin β1 in two traumatic brain injury models of rats 6h after injury(Western blotting)
3 讨 论
细胞力学研究结果表明,机械应力传入细胞存在传导与转导过程。传导是以机械波的形式传入细胞,使细胞骨架进行整体重排引起细胞形态改变,并通过与细胞膜上的分子直接联系,将力在细胞内传递分布,所发出的调节信息以力的形式传递[5],再经过效应分子将力学信号最终表现在效应点上[6]。当力传导到细胞的效应部位时,力信号转导为生理和生化信号,引起细胞的生理和生化应答。整合素是机械应力传导和转导的关键。作用在细胞表面的应力通过整合素受体及时响应传递到细胞内各区,将响应的机械力信号有选择地转换到细胞和核内不同结构部件上,实现力化学转化[7]。
整合素在脑内广泛分布,存在潜伏型和激活型两种构型。在脑损伤后信号传递过程中,整合素胞外域与细胞外基质作用,通过跨膜域连接胞内域,胞内域与信号转导分子相结合,介导细胞内外之间的双向信号传递[8-9]。integrin β1是中枢神经系统多种整合素的共同组成部分,在神经细胞损伤后表达明显上升[10],诱导神经胶质细胞[11]、成神经干细胞[12]迁移至损伤脑组织处,对脑损伤进行修复。本研究结果表明,脑损伤发生后integrin β1被快速激活,伤后30min即可检测到阳性表达,于伤后6h达高峰,随后呈下降趋势,持续1周时,仍可检见阳性表达。
本研究观察到integrin β1阳性表达并非呈全脑反应,在两种脑损伤模型的大鼠脑组织中,均以枕部(打击点处)integrin β1阳性表达最为显著。直线加速损伤组大鼠额叶处integrin β1阳性表达明显强于旋转加速损伤组大鼠该部位的integrin β1阳性表达,而在脑干处旋转加速损伤组integrin β1阳性表达则较直线加速损伤组明显。这种空间分布的差异性与颅脑损伤的生物力学特征相符合,即颅脑受到压缩力、伸张力或剪切力等不同性质的机械暴力作用后形成的机械应力不同,神经细胞所产生的应力响应特征如响应部位、响应程度等也存在区别。直线加速运动对冲部位因负压产生空化现象导致对冲部位脑组织损伤[13-15],旋转加速产生的压力梯度可引起脑干内的剪切变形及运动性损伤[16]。
本研究结果表明,不同的生物力学机制对integrin β1阳性表达部位的分布产生不同的影响,integrin β1阳性表达部位与颅脑损伤的致伤方式存在关联性。根据integrin β1阳性表达部位的差异,运用逆向工程原理,可以推断颅脑损伤的致伤方式。而在大鼠两种脑损伤模型中,integrin β1阳性表达均以暴力作用点处脑组织最为显著,对暴力击打部位的确定有实用价值。暴力作用点的确定及脑损伤致伤方式的推定有助于脑损伤过程重建。
神经细胞对机械应力响应是一个连续的过程,在整合素介导下,经多种信号通路[17-21]激活下游蛋白因子如即早基因(c-fos、c-jun)、神经巢蛋白(nestin)、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)等,检测脑损伤后各种蛋白因子表达部位、表达程度、表达范围等与暴力作用方式的关联性,是开展法医学颅脑损伤的细胞力学研究的有益补充。
