有机垃圾厌氧产氢及其氢化酶影响因素探究
2020-10-10曾静赵兴玲柳静刘士清吴凯王昌梅杨红尹芳张无敌
曾静,赵兴玲,柳静,刘士清,吴凯,王昌梅,杨红,尹芳,张无敌
(云南师范大学 能源与环境科学学院,云南 昆明 650500)
有机垃圾,是指生活垃圾中含有有机物成分的废弃物。从2017年3月开始,随着 《生活垃圾分类制度实施方案》的发布,垃圾分类开始在全国各地进行推广。据统计,约80%~90%的城市将有机垃圾纳入分类类别[1]。由于其数量不断增加,对有机垃圾的处理也显得尤为重要。有机垃圾底物中富含碳水化合物,相关报道碳水化合物是发酵生物制氢的较优底物[2]。因此,通过发酵生物制氢技术处理有机垃圾不仅实现了污染物的处理,同时还实现了氢源的回收[3]。
目前,许多学者对有机垃圾进行了大量研究。王勇等[4]学者研究了初始pH和温度对餐厨垃圾厌氧发酵制氢的影响;贾璇等[5]学者在湿热预处理对餐厨垃圾生物制氢潜力的影响方面进行了研究;高常卉等[6]学者研究了餐厨垃圾厌氧干发酵的产氢特性。可以发现,在垃圾发酵产氢的影响因素、厌氧消化方式、预处理等方向已做了相关研究。但是,针对有机垃圾发酵制氢过程中氢化酶的影响因素的探究鲜有报道。
发酵制氢是在氢酶的催化作用下,有机物被产氢微生物利用降解产生氢气,同时生成挥发性脂肪酸 (VFA)、乙醇等代谢产物的过程[7]。氢酶也称为氢化酶,是一类存在于微生物体内的生物酶,它能可逆催化氢气的氧化还原反应[8]。氢化酶是能量代谢过程中氢释放的最后限速酶系,在产氢代谢过程中发挥着重要作用[9]。根据氢化酶的催化功能可分为三类[10]:产氢氢化酶、耗氢氢化酶、双向性氢化酶,其中产氢氢化酶能够表征产氢系统中的产氢能效[11]。在微生物代谢产氢的过程中,影响氢化酶活性的影响因子有很多,如温度、pH、m(C)/m(N)、金属离子、底物浓度等。
本研究通过设置不同发酵料液含量的有机垃圾进行发酵制氢,得出制氢过程中的产氢潜力,并对整个过程产氢量和氢化酶活性之间的变化关系以及氢化酶的影响因素进行了探究。得出不同浓度有机垃圾产氢过程中氢化酶的影响因素,为后期控制多因素对氢化酶的影响从而提高有机垃圾产氢效率的研究提供了理论依据。
1 材料与方法
1.1 实验材料
实验原料来源于云南师范大学能环学院办公室内日常丢弃的有机垃圾。为保证每批次原料组成成分相同,有机垃圾按m(果皮)∶m(剩饭)∶m(废弃菜叶)∶m(茶渣) =1∶1∶1∶1进行配比。其相关理化性质如表1所示。接种物是在取部分实验室长期驯化的接种物的基础上,再加入少量有机垃圾和猪粪作为营养物,在35±1℃下恒温驯化,从而达到使用要求。经测定,接种物TS为12.87%,VS为59.78%,pH为7。

表1 有机垃圾的理化性质Table 1 Physical and chemical properties of kitchen waste
1.2 实验装置
采用自行设计的批量式反应装置,由500mL的厌氧发酵瓶、排水瓶和集气瓶和温控系统组成。厌氧发酵瓶作为反应容器,其有效容积为400mL,整个过程通过恒温磁力搅拌水浴锅控制厌氧反应温度,保持在35±1℃。装置示意图如图1所示。
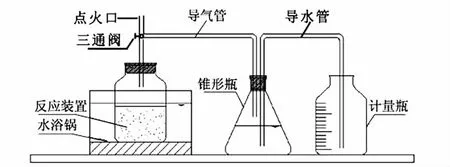
图1 实验装置示意图Fig 1 Schematic diagram of the experimental device
1.3 实验设计
本实验设定温度为35±1℃,其中设置了三个实验组和一个空白组,每组均重复设置三个平行实验,具体发酵料液的配制如表2。

表2 发酵料液配比Table 2 Ratio of fermentation liquid
1.4 测定方法
通过每天测量排水量记录每个处理的沼气产量[12]。采用福立GC9790II型气相色谱仪测定各处的氢气浓度,甲烷浓度和挥发性脂肪酸含量[13]。pH值、TS和VS是根据实验室以往所采用的方法测量的[14]。粗纤维采用国家标准 (GB6434-86)所描述方法进行测定。粗蛋白采用凯式定氮法[15]进行测定。m(C)/m(N)中C利用TOC-2000仪进行测定,N用凯式定氮法进行测定。
产氢氢化酶活性的测定:首先在酶试剂盒中加入待测样品10μL和甲基紫精试剂40μL混匀,封板后37℃反应30min。洗涤液洗板5次加入HRP酶标试剂50μL,封板后37℃反应30min。再洗板5次加入TMB显色剂和酸显色剂37℃显色10min。最后加入终止液终止反应,颜色的深浅和样品中的氢化酶呈正相关。15min内使用酶标仪在450nm波长下测定吸光度 (OD值)。
2 结果与讨论
2.1 不同浓度的有机垃圾的制氢潜力
从实验发酵开始,每隔12h记录一次产气量和测定其沼气中的氢气含量,整理数据并进行绘制,如图2所示。

图2 不同浓度有机垃圾氢气变化图Fig 2 Changes of hydrogen in kitchen waste at different concentrations
图2(a)为三个实验组过程中单位产氢量及氢气含量变化图,图2(b)为累积产氢量图。从图2(a)发现,各实验组氢气含量的整体变化均呈现出先上升后下降再上升最后下降的趋势,且每个实验组都出现了两个峰值。有机垃圾中的有机质主要包括碳水化合物、蛋白质和脂肪等,碳水化合物相对于蛋白质和脂肪更容易被微生物利用,因此在整个反应过程中碳水化合物会优先被利用[16]。伴随着原料内的大量碳水化合物被利用,8%和10%实验组在第24h出现第一个峰值,此时为氢气含量最大值,分别为46%、50%。由于原料增多,水解速度相对较缓,12%实验组在第36h出现第一个峰值,也为最大峰值,为49%。随着碳水化合物的消耗,此时微生物开始利用原料内的蛋白质等大分子物质制氢,8%、10%、12%实验组分别在第60h、72h、72h出现第二个氢含量峰值,此后氢含量开始下降,但始终保持在30%左右。单位产氢量呈现出现上升后下降的趋势,所有实验组单位产氢量的峰值与氢气含量峰值出现的时间一致,说明此时体系内产氢微生物处于最佳活跃状态,不断利用有机质进行代谢产氢。此后单位产氢量开始下降趋于平缓,直至产氢结束。从图2(b)看出,8%和10%实验组发酵共进行了96h,12%进行了108h。8%和10%实验组在发酵前72h累积产氢量显著增加,12%实验组在前84h累积产氢量显著提高,均占总累积产氢量的95%以上。随后,各实验组累积产氢量增长缓慢直至结束。其中,8%实验组产氢率为154mL/g,10%实验组产氢率为139mL/g,12%实验组产氢率为132mL/g。可以发现,随着原料添加量的增加,产氢率逐渐降低,发酵时间相应有所增加。
修正的Gompertz方程可以用来描述厌氧发酵过程中的产氢情况[17],方程如 (1):

式中:y(t)表示时间t时的累积产氢量 (mL),当t→∞时,y(t)→a,有Hm=a为最大累积产氢量 (mL);Rm=a·c/e为最大产氢速率 (mL/h);λ=(b-1)/c,λ为发酵滞留时间 (h)。e为exp(1)=2.71828。实际数据处理过程中,利用origin软件对参数a、b、c进行拟合,然后转换为Hm、Rm、λ的值,如表3。

表3 有机垃圾发酵制氢的动力学参数Table3 Kinetic parameters of hydrogen production from kitchen waste fermentation
由表可知,三个实验组经过方程拟合后的相关系数R2均大于0.99,说明修正的Gompertz方程能很好的描述有机垃圾发酵制氢过程中的产气情况。各实验组的累积产氢量和TS产氢率与实际值基本接 近,TS产 氢 率 分 别 为154mL/g、137mL/g、132mL/g,8%实验组产氢率高于其余两个实验组。最大产氢速率分别为39mL/h、65mL/h、84mL/h,12%实验组产氢速率最快。可以发现,浓度越高的实验组虽然产氢速率更快但是其TS产氢率却较低,可能出现的原因是原料添加量的增加,微生物在水解酸化阶段反应相对较缓,导致体系内酸物质的积累从而影响产气。三个实验组的发酵滞留时间相差不大并且时间都较短,说明利用垃圾作为原料发酵制氢能较快的启动实验。
2.2 有机垃圾发酵制氢发酵类型
液相末端发酵产物在厌氧发酵产氢过程中能够反映系统内的代谢特征和微生物群落结构变化,不同的液相末端发酵产物组成也代表着系统内不同的发酵类型[18]。图3表示了不同发酵浓度发酵过程中VFAs的变化,观察到所有实验组在开始发酵前系统内液相产物主要以乙酸为主,含量均高达80%以上,并含有少量其他脂肪酸。随着实验的进行,各实验组的挥发性脂肪酸含量均发生了变化。其中,所有实验组结束后系统内液相末端产物主要由乙酸和丁酸居多,二者之和高达96%以上。因此,有机垃圾为原料的厌氧发酵产氢类型为丁酸型发酵。宋佳秀等[20]认为丁酸型发酵是产氢最有效的发酵类型之一。在实验过程中除乙酸、丁酸外,还伴随着少量的丙酸、戊酸、异丁酸等末端液相产物生成。发酵结束后8%实验组中丁酸占比较发酵前增加了32%,10%实验组中丁酸占比较发酵前增加了52%,12%实验组中丁酸占比较发酵前增加了50%。结合图3中氢气含量变化发现,丁酸占比增加得多,相应实验组氢气含量峰值越高,丁酸的产生一定程度上可以调节由于乙酸积累产生的NADH+H+和NAD+之间的一种生理上的平衡,从而促进产氢细菌的作用[21]。

图3 各实验组中VFA各组分随时间的变化Fig 3 Changes of VFA components in each experimental group over time
2.3 产氢量与氢化酶活性之间的变化
在发酵制氢的能量代谢过程中,氢化酶作为氢释放的最后限速酶系,产氢细菌的能量代谢直接受其活性的高低以及表达周期的长短影响,并且其活性和表达周期也会间接影响到氢气的释放速度和产量[22]。从图4看出,各实验组氢化酶活性与产氢量均呈现出一致的先上升后下降的趋势。在三个实验组中,实验前72h左右产氢细菌活跃,具有很强的产氢活性,此时产氢速率也较高,随后细菌活性逐渐降低,产氢速率也随之下降,直至细菌衰亡产氢停止。实验进行至第24h,8%和10%实验组产氢氢化酶活性均出现最大值,此时产氢速率也最快,分别为43mL/h和81mL/h,这个时候两个实验组中的产氢氢化酶均处于最活跃状态,能够快速进行代谢产氢。在12%实验组中,实验到达第36h时,产氢速率出现峰值为86mL/h,然而此时产氢氢化酶活性没有出现最大值,而是在第48h出现峰值,可能是因为在第36h时如脱氢酶系等其他与产氢有关的酶系出现且较活跃,共同作用促进氢气的生成导致在此时出现了最快产氢速率。峰值过后,氢化酶活性衰弱,产氢量也快速下降,当氢化酶基本失活时,产氢量趋于平缓至结束。可以看出,产氢氢化酶的活性一定程度上会影响产氢细菌的代谢和表达,并且有机垃圾发酵液浓度越高,其氢化酶酶活出现峰值的时间会往后有所推移。
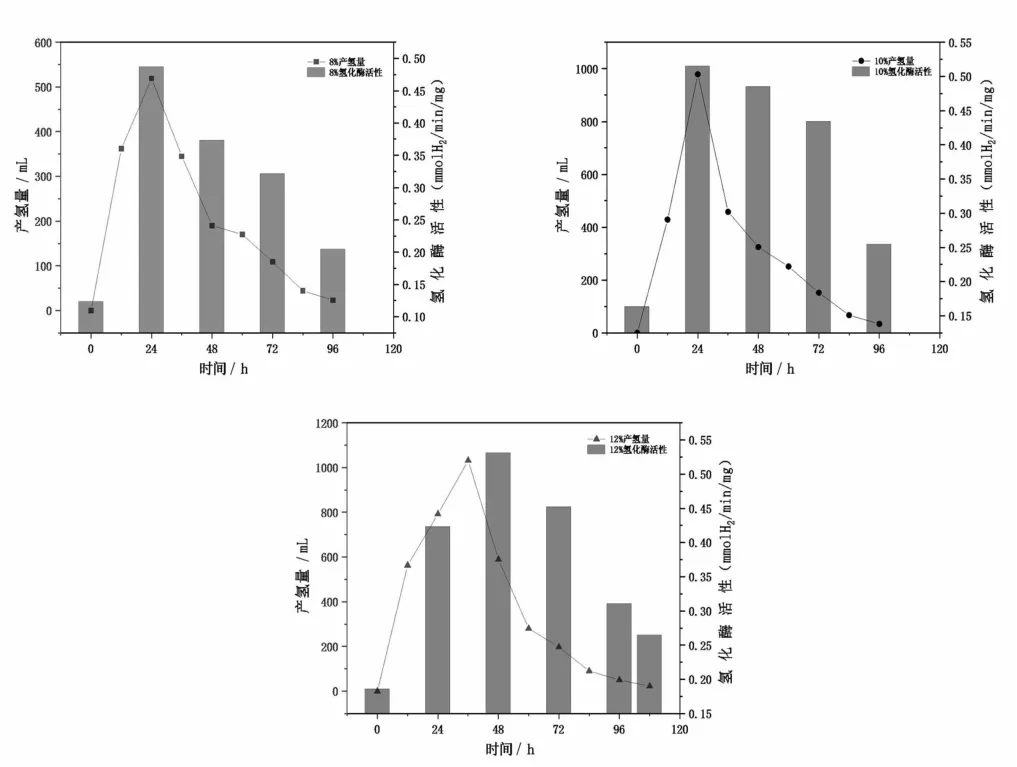
图4 氢化酶活性与产氢量随时间的变化关系图Fig 4 Relationship between hydrogenase activity and hydrogen production over time
2.4 pH与氢化酶活性的变化情况
在有机垃圾进行水解酸化的过程中,由于大量有机酸的积累,导致此时体系内pH值不断下降,影响产氢微生物细胞内氢化酶的活性和代谢途径等,从而影响产氢菌的产氢能力,当pH值降低至一定程度时,将导致发酵产氢过程的停止。从图5得出,三个实验组分别在前72h、72h、96h都由于有机酸的积累导致pH快速下降,当pH下降至过低范围时,会抑制体系内微生物的作用,从而导致产气趋于停止,与前面累积产气量的变化趋势一致。在pH下降过程中,各实验组氢化酶活性均呈现出先上升后下降的趋势。8%实验组在pH下降至5.5时获得氢化酶酶活最大值,10%实验组也是在pH为5.5时获得了氢化酶酶活最大值,12%实验组在pH为5.0时获得了氢化酶酶活的最大值,当pH下降缓慢趋于稳定时,此时酶活也随之丧失。可以发现,当pH在5~5.5范围内时,氢化酶活性相对较强,能够很好的促进产氢细菌的作用,并且,pH过高或过低不仅会影响氢化酶的酶活,降低其产氢能力还会影响整个发酵过程的产气情况。因此,在利用有机质制氢的过程中,控制其pH范围极为重要。

图5 各实验组氢化酶与pH随时间的变化Fig 5 Changes of hydrogenase and pH in each experimental group over time
2.5 m(C)/m(N)与氢化酶活性的变化情况
在微生物的生长和代谢过程中,C和N这两种营养元素起着不可或缺的作用。m(C)/m(N)作为发酵制氢的一个重要参数,能影响有机物在微生物体内的生物氧化过程和通过微生物自身的合成代谢过程进一步导致厌氧微生物细胞内的NADH+H+/NAD+比率和发酵产物数量变化[23]。代谢产物积累、微生物生长、代谢途径以及酶活性水平等都受m(C)/m(N)的影响。其通过影响氢化酶活性的表达,从而影响产氢能力。m(C)/m(N)与氢化酶活性的变化情况见图6。

图6 各实验组氢化酶与m(C)/m(N)随时间的变化Fig 6 Changes of hydrogenase and m(C)/m(N)over time in each experimental group
从图6看出,在8%实验组中,当m(C)/m(N)值为20时,氢化酶活性最强,10%实验组中,当m(C)/m(N)值为23时,获得氢活酶活性最大值,12%实验组中,当m(C)/m(N)值为21时,获得氢化酶活性最大值。所以,当m(C)/m(N)范围在20~25左右时,氢化酶活性相对较强,产氢细菌可以更好的被利用进行代谢制氢。张璐[24]在探究m(C)/m(N)对YUAN-3产氢能力及氢化酶活性的影响实验研究中发现,随着m(C)/m(N)比的提高,YUAN-3的氢化酶活性不断加大,当m(C)/m(N)比为22.4时,YUAN-3获得最大氢化酶活性,本实验结论与其一致。
3 结论
1)探究8%、10%、12%三个不同的生活垃圾发酵制氢实验发现,各实验组产氢潜力分别为154mL/g、139mL/g、132mL/g,最大产氢速率分别为43mL/h、81mL/h、86mL/h。结合产氢潜力、最大产氢速率、发酵时间考虑,当发酵浓度为8%时,制氢效果最好。产氢过程中液相末端产物主要为乙酸和丁酸,两者之和占比高达90%以上,发酵类型为典型的丁酸型发酵。
2)氢化酶活性与产氢量有着密切的相关性,当氢化酶活性达到最大值时,产氢速率基本趋于最快。发酵液浓度越高时,其氢化酶酶活出现峰值的时间会往后有所推移。
3)有机垃圾发酵制氢过程中,单独分析了pH和m(C)/m(N)分别对氢化酶活性的影响发现,当pH在5~5.5范围内、m(C)/m(N)在20~25范围内时,氢化酶活性相对较强,能够很好的促进产氢细菌的作用,进行代谢产氢。为后续研究多因素共同作用对氢化酶活性的影响提供了参考。
