miR-363通过PDZD2对骨肉瘤细胞调控的分子机制研究
2020-10-10何帆江武丁国明范小良朱六龙
何帆 江武 丁国明 范小良 朱六龙
骨肉瘤的发病率约占原发恶性骨肿瘤的15%~23%[1],是儿童和青少年癌症死亡的主要原因。miR-363在多种类型的癌症中表现出肿瘤抑制作用,而其在骨肉瘤中的抑制功能还需要进一步研究。PDZD2是促进胰岛瘤细胞增殖的多PDZ结构域蛋白,研究发现其在前列腺癌(AIPC)中被激活,是一种6-PDZ结构的蛋白[2]。PDZD2在骨肉瘤发生中的作用目前仍不清楚。2016年12月至2019年3月作者通过实验研究,分析miR-363和PDZD2在骨肉瘤细胞MG-63中的功能及其相互作用,探讨miR-363对骨肉瘤细胞的调控作用及其分子机制。
1 材料与方法
1.1 细胞和试剂 骨肉瘤细胞株(MG-63,HOS和Saos2)和正常人成骨细胞株(hFOB1.19)均购自中国科学院上海细胞所。骨肉瘤细胞株用加入10%胎牛血清(FBS;美国Thermo Fisher Scientific公司)的DMEM培养基(美国HyClone公司),37℃和5%CO2浓度条件下培养。hFOB 1.19细胞用DMEM/Ham's F12培养基(DMEM/F12;1:1w/w混合物)在34℃,5%CO2浓度条件下培养。GAPDH抗体,E-钙黏着蛋白抗体,增殖细胞核抗原(PCNA)抗体,caspase-3抗体和波形蛋白抗体购自美国Cell Signaling Technology公司;PDZD2抗体购自美国Abcam公司。miR-363模拟 物(5'-AAUUGCACGGUAUCCAUCU GUA-3') 和阴 性 对 照(5'-UUCUCCGAACGUGU CACGUTT-3')寡核苷酸序列购自上海吉玛制药技术有限公司。靶向 PDZD2(siRNA-PDZD2)的小干扰RNA(siRNA)(139,5'-GCUGAACUUUGCUGUGGGGAUU-3';580,5'-CUCUG AACCAGGAGAAACAUU-3'; 和 1027,5'-GCUGGGAAUUCAGGUUAGUUU-3'),pcDNA 3.1-NEAT1和阴性对照购自广州RiboBio 公司。PDZD2的psiCHECK2-UTR(野生型和突变型)由上海吉玛制药技术有限公司提供。
1.2 RNA分离和逆转录定量聚合酶链反应(RT-qPCR) 根据标准RNA分离方案,使用TRIzol试剂(美国Thermo Fisher Scientific公司)从组织或细胞系中提取总RNA。用于qPCR的反应条件如下:95℃,60sec;然 后95℃,5s进 行40循 环;然后60℃,34s。通过在ABI 7500快速序列检测系统(美国Thermo Fisher Scientific公司)上使用SYBR Premix Ex Taq(大连Takara生物技术有限公司)对miR-363和PDZD2水平进行定量。将miR-363和PDZD2的水平分别标准化为U6和GAPDH的水平。引物分别为:miR-363,正向5'-ACACTCCA GCTGGGAATTGCACGGTATCCATC-3'和 反 向5'-CT CAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGTAC AGATG-3';U6,正向 5'-CTCG CTTCGGCAGCACA-3'和 反 5'-AACGCTTCACGAATTTGCGT-3';PDZD2,正 向5'-TCTGTACTGTGTACCTCACCAA-3'和 反向 5'-CCCTGCGCTTTTCACCATAG-3';GAPDH,正 向5'-TGTTCGTCATGGGTGTGAAC-3'和 反 向5'-ATGGCATGGACTGTGGTCAT-3'。使用公式 2-△△Ct(21)计算mRNA表达的相对倍数变化。
1.3 蛋白质印迹分析(Western blot) 用RIPA细胞裂解缓冲液(美国Santa Cruz Biotechnology公司)提取组织或细胞系中的总蛋白,并用BCA分析试剂盒(美国Thermo Fisher Scientific公司)确定这些蛋白的浓度。每组蛋白质样品(30µg)通过15%SDS-PAGE电泳,然后转移到硝酸纤维素膜上(美国GE Healthcare),5%脱脂牛奶在室温下封闭1h,用含0.1%Tween-20(TBST)的一抗,4℃孵育过夜。用TBST缓冲液洗涤,与二抗在室温下孵育1h。最后,用ECL-Plus试剂(美国Millipore)观察印迹。实验用GAPDH作为对照。
1.4 免疫荧光试验 采用免疫荧光试验测定肿瘤细胞中E-钙粘蛋白,波形蛋白和PDZD2的水平。用含4%多聚甲醛的PBS液固定细胞。将细胞在-20℃下用100%甲醇渗透10分钟,用含3%牛血清白蛋白(BSA)的PBS液封闭60min,然后加入一抗,4℃,孵育过夜(抗PDZD2为美国Abcam公司产品,抗E-钙粘蛋白为美国Cell Signaling Technology公司产品,抗波形蛋白为美国Cell Signaling Technology公司产品)。PBS冲洗,并置于盖玻片上,与偶联有荧光染料的二抗在室温下于黑暗中孵育1h。用DAPI染色细胞核后,中性树胶固定,并在FV10i共聚焦显微镜(日本Olympus Corporation)下观察细胞。
1.5 免疫组化 采用免疫组化测定PDZD2在肿瘤中的表达。把切片在二甲苯中孵育5min,依次用100%和95%乙醇孵育10min,进行抗原暴露,然后在室温下用3%过氧化氢将载玻片封闭30min。将切片与抗PDZD2的一抗在4℃孵育过夜,然后再接种抗二抗。使用EnVision检测系统试剂盒(丹麦达格)评估免疫染色结果。
1.6 细胞转染 接种MG-63细胞,用PBS洗涤细胞,分别用 miR-363 mimics(50nM),siRNA-PDZD2(1µg/ml)和相应的阴性对照(NC)转染24、48和72h。转染方法参照100 nM Lipofectamine 2000转染试剂说明书(美国Thermo Fisher Scientific公司)。
1.7 CCK-8实验检测细胞活性 取转染成功的MG-63细胞,按每1ml完全培养基加入10µl CCK-8将二者混合均匀后,每孔加入10µl CCK-8液,孵育1h,用酶标仪在450nm处测量吸光度。CCK-8试剂盒为日本Dojindo Molecular echnologies公司产品。
1.8 克隆形成能力检测 取转染后的单细胞悬液进行计数,将细胞悬液的细胞密度调整为1×103/ml;在培养板中分3种浓度接种细胞:分别接种50个细胞/孔、100个细胞/孔、200个细胞/孔;接种完毕后,所有孔中均补加培养基至液体量300µl/孔;在37℃、5%CO2条件下培养2~3周;定时观察,当培养皿中出现肉眼可见的细胞克隆时,即终止培养。去除上清液,加4%多聚甲醛液固定细胞20min。用结晶紫染料进行细胞染色。染色成功后洗去未附着的染色液,细胞培养板置于空气中自然晾干;最后拍照,计算细胞集落数。
1.9 细胞凋亡和细胞周期分析 Hoechst 33258检测细胞凋亡:取转染后的MG-63细胞,用4%低聚甲醛固定,将固定的细胞用0.1µg/ml的Hoechst 33258溶液(德国Sigma-Aldrich公司)染色,并在荧光显微镜(日本Olympus公司)下观察核形态的变化,荧光的激发波长设定为460nm。流式细胞仪检测细胞凋亡和细胞周期:流式细胞仪为美国BD公司产品。将2µl膜联蛋白V与2µl碘化丙啶(PI)(美国Thermo Fisher Scientific公司)混合,每流式管加入1×105个细胞,避光孵育30min,上机检测。TUNEL分析:将肿瘤组织用福尔马林固定,石蜡包埋,4µm切片,使用细胞凋亡原位检测试剂盒(日本和光纯药工业株式会社),按说明书对肿瘤切片进行染色。随机选择每个切片的五个非重叠视野,并在荧光显微镜下观察。为确定细胞周期的相位分布,将细胞用PI染色液(10µg/ml RNase A;50µg/ml PI)在37℃下避光染色30min,然后使用流式细胞仪进行分析。
1.10 细胞侵袭能力检测 Transwell小室试验:将转染后的MG-63细胞加入到含0.2%BSA的无血清培养基中,调整培养基中细胞的密度为2×105个/ml。取调整好的细胞悬液,加入到Transwell小室上孔中,每孔内接种2×104个细胞;然后再向Transwell小室的下室中加入含有10%FBS血清的完全培养基,每室加入700µl培养基。加注完成后将Transwell小室放入到二氧化碳细胞培养箱中,箱内条件为:5%CO2、37℃。培养48h后取出小室,将小室洗净后,用结晶紫染色液进行染色。将小室用中性树脂封片。在OLYMPUS CX41正置显微镜下观察小室与拍照,观察时每个小室选取4个视野进行测量,用IPP软件进行细胞计数。每个实验重复3遍。
1.11 动物模型试验 将30只雄性小鼠(4~5周;20~22g;购自天津赛尔生物技术有限公司)置于25℃的无菌室中,进行12h的明/暗循环,并在室温下灭菌,可自由进食、进水。准备已转染miR-363mimics、miR-363(NC)和对照组人MG-63单细胞悬液,调整细胞浓度至1×107个/ml,每只裸鼠后胁腹部皮下注射50µl细胞混悬液(每组10只小鼠)。从第2周起测量肿瘤的大小,1次/隔3d,计算肿瘤体积:V(cm3)=宽度2(cm2)×长度(cm)/2。
1.12 统计学方法 PCR实验数据按照2-△△Ct方法处理数据[3]。采用SPSS 19.0统计学软件。计量资料以(±s)表示,两组或多组间比较用t检验、单向方差分析或双向方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 体外细胞试验证实过表达miR-363可抑制骨肉瘤细胞的生长 发现miR-363在骨肉瘤细胞株中呈现低表达状态,其中MG-63细胞的miR-363低表达与其他骨肉瘤细胞相比较显著。Hoechst染色表明,过表达miR-363的MG-63细胞具有较高的凋亡率(见图1)。流式细胞仪结果表明miR-363过表达可以诱导MG-63细胞中的G1/S阻滞(见图2)。

图1 Hoechst33258染色显示miR-363过表达组细胞凋亡增多

图2 流式细胞仪检测显示miR-363过表达组细胞中处于G1期的细胞数量增加,处于S期的细胞数量显著减少
2.2 过表达miR-363可以调节上皮-间质转化(EMT)表型,从而抑制骨肉瘤细胞的侵袭能力 Transwell小室试验表明,miR-363过表达后,MG-63细胞的侵袭能力受到抑制(见图3)。免疫荧光和蛋白质印迹分析结果显示,miR-363过表达后,上皮标记E-钙粘着蛋白的表达被上调,而间质标记波形蛋白(Vimentin)被下调,细胞增殖标志物PCNA的表达降低,而caspase-3的裂解增加。

图3 miR-363过表达组细胞侵袭能力减弱
2.3 PDZD2是miR-363的直接靶标且可以在体外促进骨肉瘤细胞MG-63细胞增殖 本研究利用在线预测软件miRWalk 寻找miR-363的潜在靶标,最后发现PDZD2为其靶基因。进一步分析发现PDZD2 mRNA的3'非翻译区(UTR)具有miR-363的结合位点;因此,在骨肉瘤细胞中研究PDZD2与miR-363的相互作用。结果表明,MG-63细胞中miR-363的过表达显著抑制其产生PDZD2 mRNA和蛋白的能力(见图4)。为确认PDZD2是miR363的直接靶标,将具有PDZD2全长3'UTR(野生型或突变型)的萤光素酶报道载体转染到MG-63细胞中,用双萤光素酶试验分析,结果发现,miR-363 mimics削弱野生型PDZD2 3'UTR的萤光素酶活性,但未影响对照组的突变型PDZD2 3'UTR,表明miR-363直接靶向骨肉瘤细胞中的PDZD2,以降低PDZD2蛋白水平(见图5)。

图4 免疫荧光检测MG-63细胞中PDZD2的表达

图5 用全长3'UTR转染MG-63细胞(野生型和突变型)PDZD2,并使用萤光素酶报告基因法测定
2.4 骨肉瘤细胞中PDZD2蛋白水平降低的影响 在通过siRNA有效敲低MG-63细胞中PDZD2的表达后,测定细胞的凋亡,克隆形成能力和侵袭能力。结果表明,敲低PDZD2可以诱导细胞凋亡并减弱细胞的集落形成和侵袭能力。
2.5 miR-363通过下调体内PDZD2水平限制肿瘤生长 结果表明,注射过表达miR-363的MG-63细胞的小鼠发展出明显较小的肿瘤,显示出生长延迟(见图6)。对肿瘤组织mRNA和蛋白质水平的检测证实miR-363上调和PDZD2下调;通过检测肿瘤细胞的凋亡率证明miR-363在体内显著诱导骨肉瘤细胞的凋亡(见图7)。这些调节作用与PCNA表达降低,caspase-3裂解增加及EMT表型受损有关(见图8)。
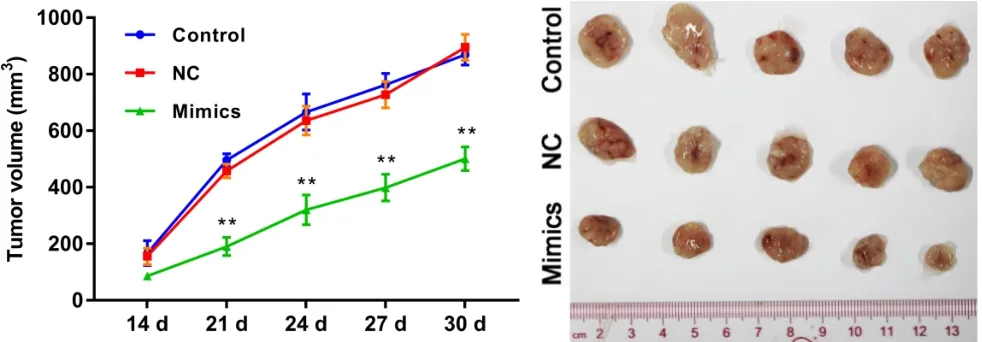
图6 miR-363 mimics组的裸鼠体内肿瘤生长速度较慢

图7 TUNEL染色估算肿瘤切片中的细胞凋亡率(×200)
3 讨论
骨肉瘤是一种间叶组织来源的恶性肿瘤。虽然对骨肉瘤形成过程中miRNA的致癌和抑癌功能已有相关文献报道,但miRNA调控的靶基因等分子机制仍待研究。本研究通过体外和体内试验发现,肿瘤抑制因子miR-363在骨肉瘤细胞中被下调并通过直接靶向PDZD2促进肿瘤生长。PDZD2最初被认为是一种癌基因,其表达在前列腺肿瘤细胞系和人原发性前列腺肿瘤中上调。本研究表明PDZD2表达与骨肉瘤进展有关。一项与肾细胞癌相关的单核苷酸多态性的最新研究表明,PDZD2的rs10054504与中国人群肾细胞癌的风险显着相关[4]。本研究显示,PDZD2的抑制促进骨肉瘤细胞的凋亡,并抑制骨肉瘤细胞系的迁移和侵袭能力。此外,PDZD2的敲低显著降低细胞增殖标志物PCNA的表达,诱导caspase-3的裂解,并损害骨肉瘤细胞中的EMT表型。与miR-363/PDZD2相关的下游信号及其在骨肉瘤细胞中的功能有待进一步研究。
肿瘤发生期间miRNA的失调是恶性转化的标志。抑癌基因miR-363属于miR-92a家族,是一组高度保守的miRNA,包括miR-25,miR-92a-1,miR-92a-2和 miR-363[5]。已有研究显示,miR-363-3p在具有淋巴结转移的结直肠癌(CRC)组织标本中被下调,从而通过增加体内和体外SRY-box 4(Sox4)的表达促进CRC细胞的迁移、侵袭并诱导EMT[6]。在前列腺癌中,PC-3细胞中高水平的miR-363通过靶向抑制MYC原癌基因来促进细胞增殖,诱导细胞转化并促进EMT[7]。目前研究表明,骨肉瘤细胞中的miR-363水平被下调,进而导致其靶基因PDZD2的表达上调。在骨肉瘤细胞中恢复miR-363表达会损害细胞活力,集落形成,迁移和侵袭,同时通过PDZD2诱导凋亡和细胞周期停滞。这些影响可能与PCNA,caspase-3和EMT表型的降低有关。同样,Wang等[8]研究认为,miR-363通过靶向SOX4抑制骨肉瘤细胞的增殖和侵袭。表明,miR-363可以在多种类型的癌症中充当通用的肿瘤抑制因子。总之,PDZD2作为骨肉瘤细胞中抑癌基因miR-363的新靶标;miR-363的过表达或PDZD2的抑制可促进caspase-3相关肿瘤细胞凋亡,抑制EMT,并诱导骨肉瘤消退。
