牡蛎对浮游植物群落下行控制作用的围隔实验研究
2020-10-09王兆慧张光涛
王兆慧 , 张光涛
(1. 中国科学院海洋研究所, 山东 青岛 266071; 2. 中国科学院大学, 北京 100049; 3. 青岛海洋科学与技术试点国家实验室, 山东 青岛 266237)
因为强大的滤食能力, 牡蛎对浮游植物生物量有重要的下行控制[1], 甚至可以用作富营养化修复[2]。虽然通常认为牡蛎摄食选择性较低, 能够滤食细菌、浮游植物和碎屑等几乎所有的颗粒有机物, 但是有研究表明它也能对浮游植物群落结构造成显著影响[3]。由于目前研究还比较少, 还无法确定具体的影响和作用机制。在盐沼河口区的观测认为牡蛎优先利用自养微型藻类[3], 另外的研究则发现对小型浮游植物的影响最显著[4]。
综合所有滤食性贝类的研究结果, 摄食作用对浮游植物群落结构的直接影响主要与微藻体型有关。首先是大型或者链状浮游植物无法直接被摄食,从而在群落中的优势度逐渐提升。这一点在淡水生态系统最明显, 入侵的贻贝会导致链状蓝藻水华[5]。桑沟湾的研究也发现, 扇贝养殖区链状硅藻丰度明显高于非养殖区[6]。第二是浮游植物群落的小型化,因为在相同的捕食压力下小型种类的种群扩增更快。在泻湖生态系统的长期变化过程中, 伴随贝类生物量倍增, 浮游植物总丰度降低的同时小型浮游植物优势度提升[2]。
另外, 牡蛎等滤食性贝类摄食对浮游植物群落的影响之所以因地而异, 还与环境特征和营养盐对浮游植物群落的上行控制有关。摄食直接去除浮游植物, 但是代谢产生的营养盐又会刺激浮游植物生长。本研究选择硅氮营养水平较高的养殖池塘探究牡蛎摄食对浮游植物种群动态变化的影响。实验环境中持续的磷酸盐限制是决定浮游植物群落的根本因素, 假设牡蛎的营养盐再生作用无法完全克服磷酸盐限制, 那么通过养殖和非养殖围隔的对比就可以揭示牡蛎摄食对浮游植物群落结构的直接影响。
1 材料与方法
1.1 实验设计
现场围隔实验于2019 年4 月在即墨鳌山湾沿岸养殖池塘内进行。池塘水体营养盐结构表现为明显的磷酸盐限制(N/P>100, Si/P>70)。围隔采用透明聚乙烯材料, 为上层开口直筒型塑料袋, 上部以PVC塑料管为骨架, 周围绑有浮球, 并用绳索将其固定在池塘水平面表面, 围隔底面积为0.7 m × 0.7 m, 高1.2 m。 实验用长牡蛎(Crassostrea gigas)取自临近养殖海域。选取体长约6 cm 的长牡蛎为实验对象, 刷去其表面附着物, 并在实验前提前驯养72 h。长牡蛎的放养方式采用网兜挂养法, 网兜孔径约0.5 cm, 悬挂于围隔底部上层10 cm 处。实验周期15 天, 实验设4 个处理, 每个处理设3 个平行, 共12 个围隔。各围隔进水400 L, 并用200 μm 筛绢过滤一次, 每组分别放养长牡蛎0 只(C 组)、5 只(L 组)、10 只(M 组)、20 只(H 组)。实验期间天气状况良好, 日间水温从15℃到22℃逐渐升高。
1.2 样品处理与分析
样品的采集、处理和保存均按照国家标准《海洋调查规范》第 4 部分海水化学要素调查(GB/T12763.4-2007), 第 6 部分海洋生物调查(GB/T12763.6-2007)执行。取样隔日进行, 每次量取300 mL 水样, 现场用0.7 μm 的Whatman GF/F 玻璃纤维滤膜(使用前450℃灼烧4 h)抽滤后, 滤液用聚乙烯塑料瓶贮存, 用 QuAAtro-SFA(Bran+Luebbe GmbH Co., Germany)营养盐自动分析仪测定五项营养盐(包括PO4-P、NO3-N、NO2-N、NH4-N 和SiO3-Si)的含量; 滤膜用锡纸包裹, –20℃冷冻保存, 带回实验室用5 mL 体积分数为90%的丙酮溶液萃取24 h后, 用Turner7200 荧光计测定水体叶绿素的变化。量取500 mL 水样, 并用15 mL 甲醛溶液固定, 放到样品储藏室储存, 用以后期进行浮游植物的种类鉴定和计数。由于实验样品过多, 我们选取了部分样品进行鉴定和计数, 每个处理组各选取一个围隔。量取27 mL 的水样到沉降杯内, 用倒置显微镜对样品进行鉴定和计数。
1.3 数据分析
浮游植物群落的优势种是由每个种群的优势度值(Y)所决定的。优势度的计算方法为Y=(ni/N)×fi, 其中ni为样品中i 种群丰度, N 是样品中所有种群丰度的总和, fi为该种在所有样品中出现的频率。当Y>0.05 时, 该种为优势种。采用SPSS 22.0 进行单因素方差分析, 以P<0.05 为判断统计显著性的标准,确定各处理组间叶绿素水平的差异。采用Origin9.0软件绘制各实验指标变化趋势图。
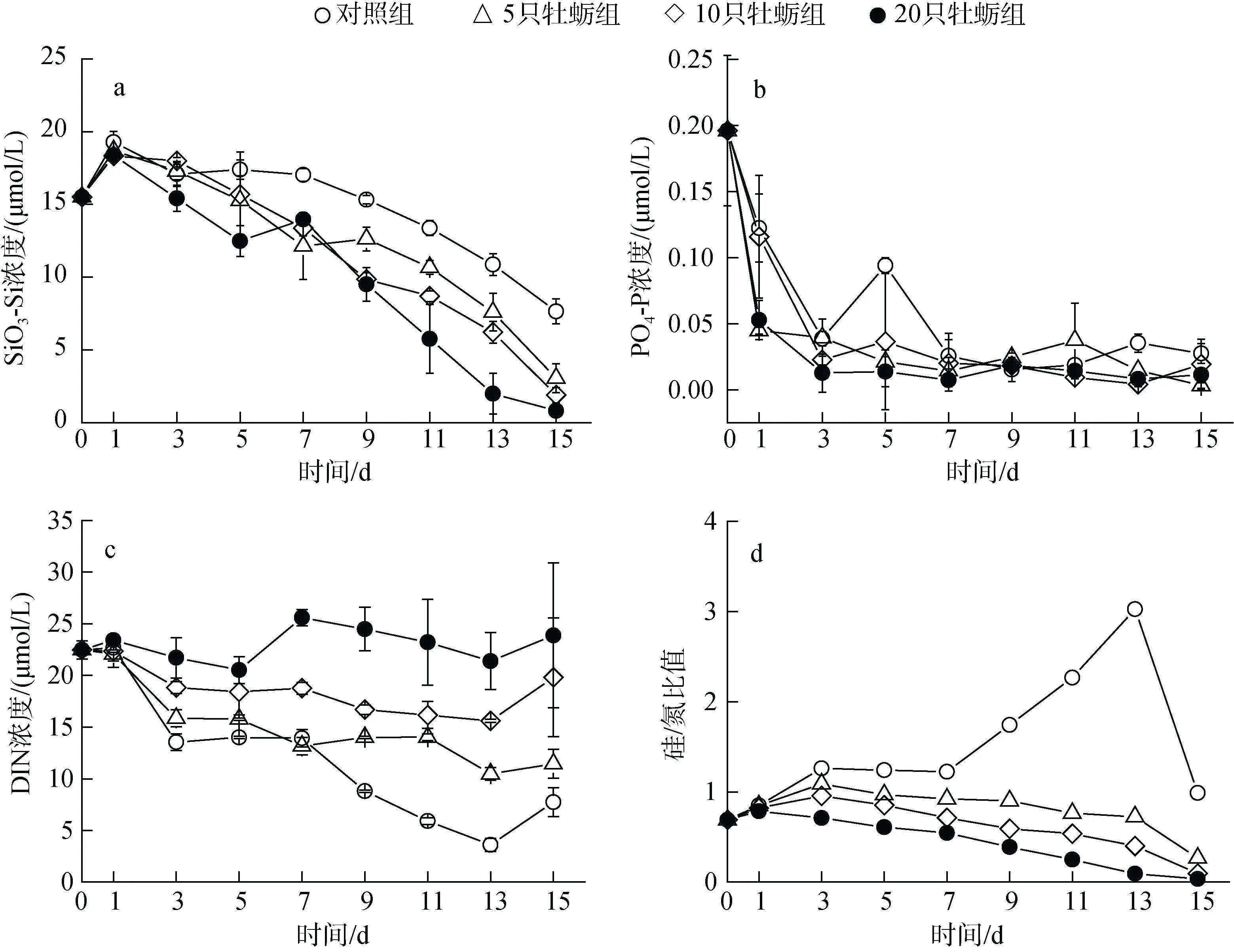
图1 营养盐浓度和结构的时间变化Fig. 1 Temporal variation in nutrient concentration and structure
2 结果
2.1 营养盐浓度和结构
由于浮游植物对硅的吸收利用, 各围隔内硅酸盐浓度逐渐降低, 且下降幅度与牡蛎放养密度呈正比关系。其中, 高牡蛎密度的H 组硅酸盐浓度减小幅度最大, 最低降到0.82 μmol/L, 小于浮游植物吸收最低阈值(图1a)。实验期间, 磷酸盐快速消耗且没有明显的组间差异。从实验第三天开始, 各围隔内磷酸盐的绝对浓度就降到了0.1 μmol/L 以下, 此后一直处于磷限制状态(图1b)。总无机氮(DIN)浓度虽然也有降低的趋势,但是幅度较小, 并且下降幅度随牡蛎养殖密度升高而降低, 特别是在H 组中, DIN 不仅没有被消耗, 反而有了一定的累积(图1c)。与对照组相比, 3 个牡蛎养殖围隔中, 其硅/氮比值呈现显著下降的趋势, 原因就在于牡蛎养殖增加了氮的累积和硅的消耗(图1d)。
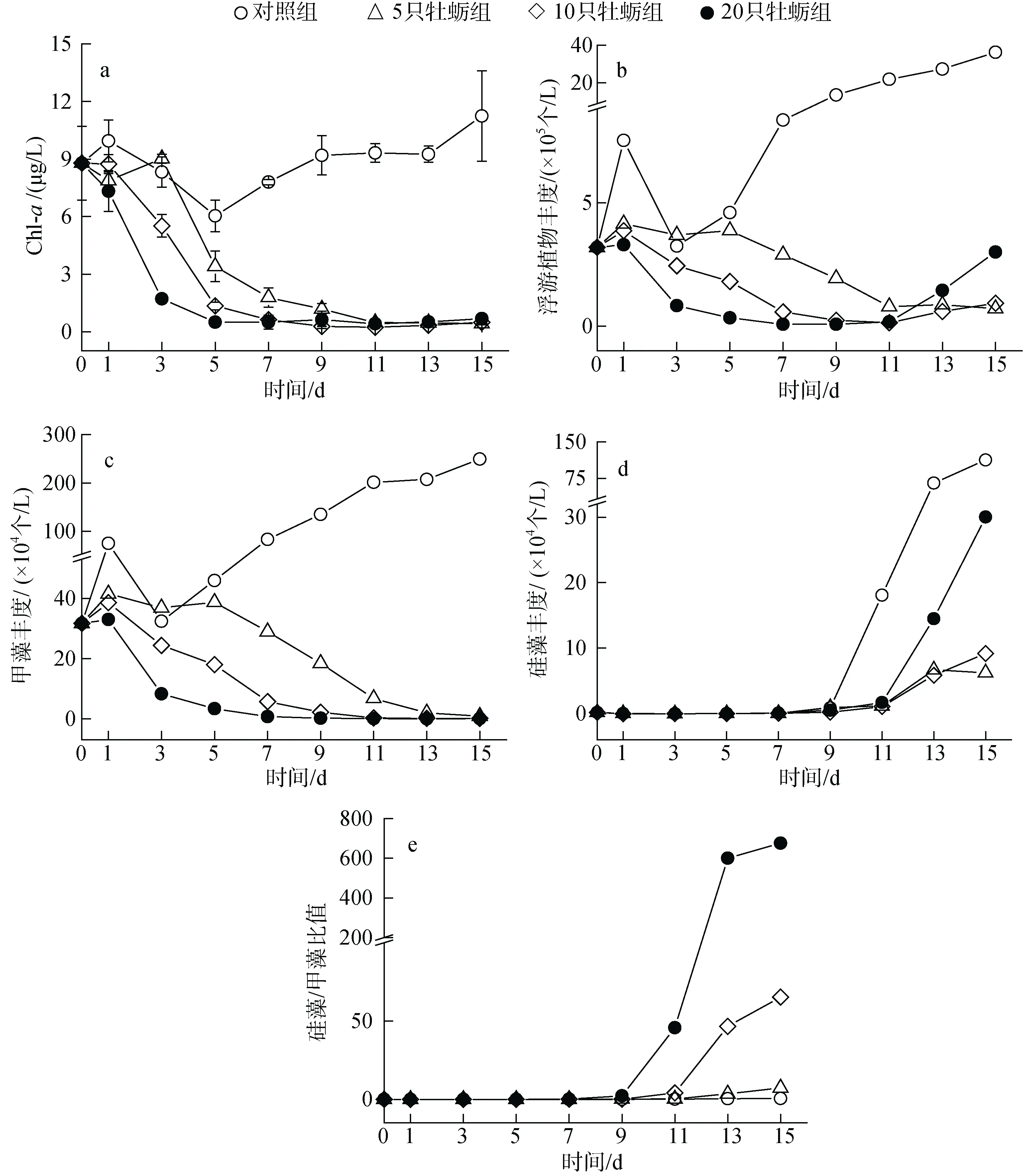
图2 养殖试验中不同处理下浮游植物的丰度和组成Fig. 2 Effect of treatment on cultured phytoplankton abundance and composition
2.2 浮游植物丰度的变化
对照组中, 浮游植物总丰度呈现前期波动, 实验后期逐级升高的趋势。从叶绿素浓度来看, 最终浓度为11.24 μg/L, 较实验开始升高了28%。然而, 细胞丰度的增加更加明显, 从开始的3.2×105个/L 升高到36.2×105个/L, 其中硅藻和甲藻丰度分别增加了11.3×105个/L和21.7×105个/L。牡蛎实验组浮游植物总量下降速率与养殖密度呈正比, 其中高密度组在第3 天叶绿素浓度降低了80%, 且不同处理组间变化差异显著(P<0.05),细胞丰度降低了74%。随着时间推移, 不同牡蛎密度组间的浮游植物生物量差异逐级消失。以叶绿素浓度计, 第9 天后维持在0.27~0.68 μg/L 的极低水平上, 如图2a—图2b 所示。
通过对一组围隔水体的浮游植物种类镜检, 共鉴定出浮游植物3 门30 属, 其中甲藻门和硅藻门的种类占绝大多数, 占比96.7%。实验初期, 围隔内甲藻处于绝对优势地位, 同时硅藻种类虽多但丰度占比只有0.5%。在对照组中, 甲藻持续增殖的同时硅藻在实验第9 天开始呈指数式增长。牡蛎实验组中细胞丰度的降低主要是由甲藻群落的衰退导致的,但是值得注意的是, 在此期间浮游植物细胞丰度却表现出明显的组间差异, 主要是甲藻丰度维持在较低水平的同时硅藻丰度出现增长, 并且在高牡蛎密度组增长最显著, 如图2c—图2e 所示。
2.3 优势种群
根据这3 种藻每天的实时丰度以及在每3 个平行围隔间出现的频率, 选取实验第1 d、5 d、9 d、13 d四个时间节点, 优势度指数Y大于0.5 的只有3 种, 分别是纤细原甲藻(Prorocentrum gracile)、扁压原甲藻(Prorocentrum compressum)和新月柱鞘藻(Cylindrotheca closterium)(表1)。
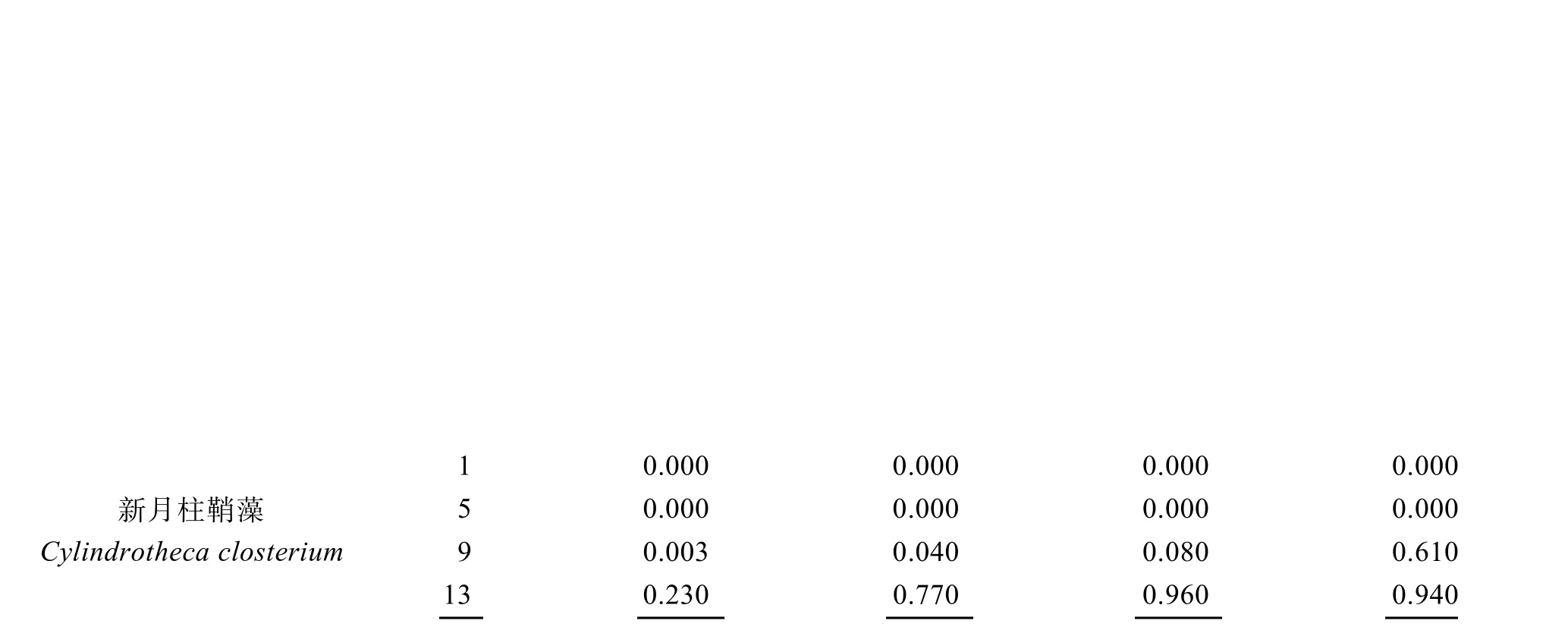
表1 3 种浮游植物优势种的时间变化特征Tab. 1 Temporal variation in three dominant phytoplankton species
水体初始环境中主要以纤细原甲藻和扁压原甲藻为优势种, 其中纤细原甲藻丰度最高,占浮游植物总丰度的 86%以上, 对照组中丰度最高时达到6.79×105个/L, 占据绝对优势地位; 但在牡蛎组中,随着时间的前进, 各围隔内纤细原甲藻丰度迅速降低, 在第五天时被摄食殆尽, 如图3 所示。同时在实验的前5 天内, 随着纤细原甲藻种群的衰退, 扁压原甲藻迅速增殖, 成为水体内的主要优势种, 其在各围隔内的优势度Y值皆达到了0.97 以上, 这种情形在未投放牡蛎的空白组中一直存在, 即使在实验末期, 其Y值依然有0.77, 扁压原甲藻在空白组中持续增殖, 其丰度最终达到了24.9×105个/L。但在投放牡蛎的围隔内, 随着纤细原甲藻被逐渐耗尽, 牡蛎选择摄食扁压原甲藻, 其在围隔内的优势地位逐渐降低。在投放牡蛎的围隔内, 浮游植物群落结构的变化主要体现在甲藻的衰退以及硅藻的增值上, 增值的硅藻主要是新月柱鞘藻。随着甲藻群落的衰败, 新月柱鞘藻逐渐成为围隔内新的优势种, 在实验末期, M组围隔中优势度Y值达到了0.96。这种优势种的转变, 与牡蛎的投放有关, 牡蛎培养密度越大, 新月柱鞘藻的优势度增加越快。
3 讨论
本研究中对照组和牡蛎组的浮游植物群落结构演替表现出截然不同的趋势。对浮游植物群落丰度的测定结果显示, 对照组中浮游植物持续增殖、叶绿素水平升高, 投放牡蛎的围隔中浮游植物丰度、叶绿素水平迅速降低。这与我们的预期相符合, 许多研究也表明养殖贝类的下行控制作用可以影响甚至控制特定水域浮游植物的生长, 影响海区浮游植物生物量。Cloern 发现在有大量营养盐输入的浅水海湾, 即使出现富营养化, 浮游植物的生物量依旧很低, 而浮游动物的摄食压力仅占很小的一部分, 高密度的贝类滤食压力是出现这种情形的首要原因[1]。贻贝每日水体中悬浮颗粒物的去除率达总悬浮颗粒物的64%, 降低水体中悬浮颗粒物和叶绿素-a的浓度, 增强了生物沉积速率[7]。我们的围隔实验结果显示, 牡蛎密度越高的围隔, 其浮游植物总丰度和叶绿素-a水平越低, 说明牡蛎摄食作用是造成浮游植物低生物量的主要原因。
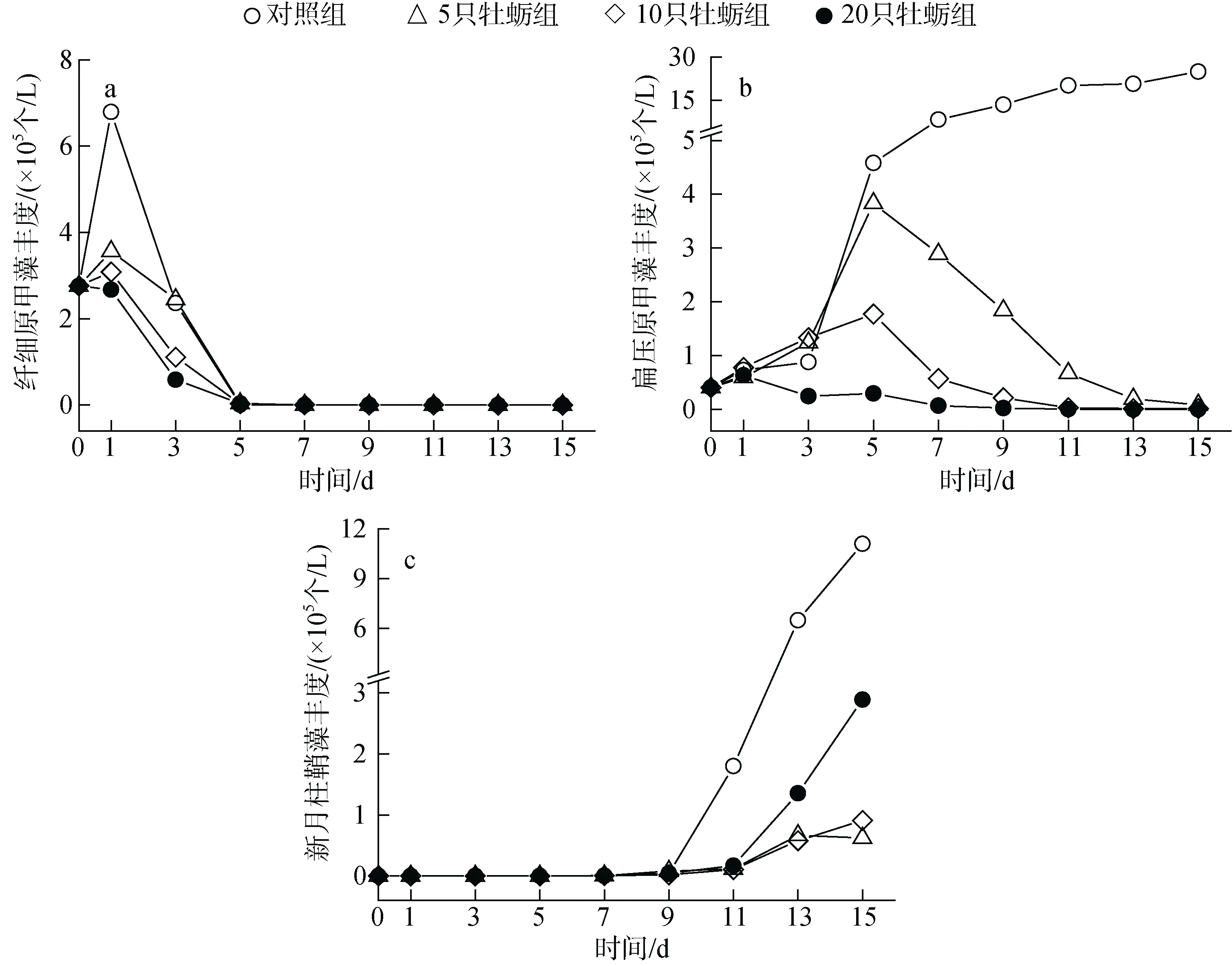
图3 不同处理组浮游植物优势种丰度的变化Fig. 3 Effect of treatment on the abundance of dominant cultured phytoplankton species
浮游植物是贝类的重要饵料, 是贝类生长的主要贡献者, 贝类超负荷养殖势必造成浮游植物群落结构的改变[8]。贝类的选择性摄食可以导致生长速率快或贝类较难滤食的种类容易成为优势种, 例如扇贝养殖对甲藻密度的控制作用[6], 同样, 我们的数据显示, 在投放牡蛎的围隔中, 浮游植物种群的变化在时间序列上得以显现, 浮游植物群落结构表现为由甲藻优势向硅藻优势转变的趋势明显。
由于两种原甲藻都是水华种[9], 无法判断其优势地位更替的原因。围隔环境与原来环境相比最大的差别是隔绝了沉积物营养盐的补充, 而从营养盐浓度时间变化来看受影响最大的是磷酸盐, 各围隔内磷酸盐含量在短短的一两天内就降到了极低水平,而硅氮含量下降相对较慢。耐受性实验表明, 赤潮藻的最大比生长速率随着氮磷比的降低而降低[10], 所以推测是扁压原甲藻竞争磷酸盐的能力更强。在牡蛎实验中, 这两种甲藻丰度在实验前期和中期都明显受到牡蛎养殖密度的制约, 因此摄食作用对其种群规模起到了重要的控制作用。从营养盐浓度看, 牡蛎组相比对照组只有硅酸盐浓度是显著降低的, 由此排除了营养盐再生的影响, 支持摄食的控制作用。
从新月柱鞘藻的丰度比较来看, 牡蛎对它也有控制作用, 但是强度不及原甲藻。对照组中丰度高于牡蛎组, 如果再考虑到牡蛎对其他摄食硅藻的原生动物也有去除作用, 那么牡蛎对它的摄食压力可能还要高于本研究的观测值。但是, 与原甲藻结果不同,新月柱鞘藻的丰度并没有表现出对牡蛎密度的依赖,反而是高密度组丰度最高, 说明牡蛎的摄食效率不及原甲藻。从营养盐的结果来看, 牡蛎养殖密度越高,再生的氮含量越多, 较高的氮磷比更加支持新月柱鞘藻的生长[11]。
虽然硅甲藻转变的趋势在所有养殖牡蛎的围隔内都有发生, 但不同处理组间的转变程度显著不同,养殖密度越大, 浮游植物群落结构受影响越剧烈。首先, 所有牡蛎组中叶绿素浓度都在3~5 天内就降到了较低水平, 但在高密度摄食压力下, 浮游植物丰度降低更迅速。同时, 牡蛎生长代谢释放大量的氨氮,养殖密度越高的围隔具有更高的氮磷比和更低的硅氮比, H 组围隔中在实验第九天就出现了明显的硅藻群落的爆发, 新月柱鞘藻丰度占比达61%, 要远远地高于L 组和M 组。因此, 牡蛎摄食能力和代谢能力的强弱, 造成了在不同养殖密度下, 浮游植物群落结构的变化出现显著差异。
实验结果支持摄食导致浮游植物小型化的观点。在实验后期新月柱鞘藻为主要的优势种, 其粒径要远小于两种原甲藻。这一点与桑沟湾的研究结果一致, 即滤食作用提高了微型硅藻的优势度。虽然另外的研究观察到相反的转换趋势, 但是硅/甲藻的转换并不是直接摄食, 而是诱发营养盐(硅)限制的结果[12-13]。在非选择性摄食压力下, 养殖贝类以同等的速度去除所有物种, 小型浮游植物具有较高的比生长速率[14]。较大摄食压力下更有利于小型硅藻的生长, 粒径大、周转周期长的甲藻数量逐渐减少, 而粒径小、周转周期短的硅藻成为优势。这种现象可能与小型浮游植物有更强的环境适应力有关。有研究表明, 小型浮游植物可以从贝类代谢、生物沉积等作用改变海湾营养物质循环中获益[15], 首先, 再生氮主要以氨[16]的形式存在, 通过生理活动或碎屑分解直接释放, 在模型研究中, 小型藻类在氨控制系统中通常具有最高的比生长速率[17]。其次, Si︰N 比值的降低可以促进甲藻的生长, 或者使链状中心硅藻生长到一些非常小的形态[18]。
在小型硅藻中, 中肋骨条藻和丹麦细柱藻都有形成赤潮的报道[18], 在贝类养殖海域也是常见的优势种。厘清其种群规模与贝类摄食的关系, 对于合理养殖和环境保护有重要的意义。
4 结论
本文通过围隔生态实验方法, 探究在不同摄食压力下, 养殖水体内浮游植物群落结构的变化, 主要结论如下:
牡蛎摄食作用调节浮游植物群落结构, 降低浮游植物生物量和叶绿素水平, 牡蛎培养密度越大,对浮游植物的摄食压力越大; 投放牡蛎的围隔内,浮游植物群落结构由甲藻优势向硅藻占优势转变,牡蛎摄食没有硅藻特异性, 有效去除甲藻, 提升硅/甲藻比, 浮游植物群落粒径变化呈小型化的趋势。
