新型冠状病毒肺炎与肾脏疾病
2020-10-09丁小强邓跃毅龚劭敏
丁小强 邓跃毅 龚劭敏
自2019年12月新型冠状病毒肺炎(COVID-19)疫情暴发以来,目前全球新型冠状病毒感染人数超过700万例,死亡超过40万例,COVID-19已经成为大流行疾病。COVID-19是由新型冠状病毒引起的以急性呼吸系统病变为主要表现,同时可累及肾脏、心血管、消化、血液、神经等多系统、多器官的急性传染病。该病临床表现复杂多样,肾脏是最常受累的肺外器官,肾脏受累与该病的预后不良相关,一旦COVID-19重症患者需接受肾脏替代治疗,其病死率显著升高[1-2]。此外,新型冠状病毒传染性强,COVID-19患者和无症状感染者均能成为传染源;除了可经飞沫和密切接触传播,在相对密闭的污染环境中,还存在气溶胶传播风险[3],因而需加强CKD患者(尤其是应用糖皮质激素和免疫抑制剂治疗的患者)、透析患者、肾移植患者的感染防控。本文对COVID-19合并肾损伤患者的临床表现、发病机制、诊疗要点、防控措施进行阐述。
1 COVID-19患者肾损伤的临床和病理学表现
1.1 临床表现 COVID-19患者的主要临床表现为发热、干咳、乏力等,少数患者伴有鼻塞、流涕、咽痛、肌痛和腹泻等症状。肾脏受损是常见而严重的肺外表现,包括蛋白尿、血尿和急性肾损伤(acute kidney injury,AKI)。①蛋白尿和血尿:Li等[4]报道的193例病毒感染患者中59%合并蛋白尿,44%合并血尿。②AKI:COVID-19患者出现AKI预示病情严重。国内研究[5-7]报道的COVID-19患者的AKI发生率差异较大,可高达14.7%,其中部分患者需接受肾脏替代治疗,发生率的差异可能与样本量和患者纳入标准偏倚有关。随着全球病例数不断攀升,近期美国一项研究[8]报道,根据改善全球肾脏病预后组织(kidney disease improving global outcomes,KDIGO)指南定义,5 449例COVID-19住院患者中1 993例发生AKI(36.6%),其中AKI网络(AKIN)定义的 1、2、3期患者分别为46.5%、22.4%、31.1%,14.3%的AKI患者需要行肾脏替代治疗。可见,肾脏是COVID-19患者常见的肺外受累器官,应重视尿液、肾功能检测及其动态随访。
1.2 病理学改变 常见的病理学改变如下。①急性肾小管损伤: COVID-19患者肾损伤的病理学改变以急性肾小管损伤最为常见。光学显微镜下可见弥漫性近端小管刷状缘消失,小管上皮细胞空泡样变性甚至坏死,偶见含铁血黄素颗粒和色素管型。红细胞聚集阻塞毛细血管管腔[9]。②急性间质性肾炎:部分患者肾间质可见淋巴细胞、炎症细胞浸润[10]。③肾小球病变:一般比较轻微。研究[11-14]报道了3例患者肾穿刺活组织检查(简称活检)的病理学表现,结果为塌陷型局灶节段性肾小球硬化(FSGS),排除人类免疫缺陷病毒(HIV)、乙型肝炎病毒、丙型肝炎病毒、Epstein-Barr (EB)病毒等感染,推测FSGS与新型冠状病毒感染有关。这3例患者均为非洲裔,且2例肾组织APOL-1基因G1序列呈现杂合变异,患者肾小管内新型冠状病毒核蛋白抗体免疫染色呈阳性[9-10]。电子显微镜下可在肾小管上皮和足细胞细胞质内发现具有特征性的钉突结构的冠状病毒颗粒[9-11]。值得注意的是,新型冠状病毒感染患者肾脏病理学的改变可能受到多种因素影响,发生AKI时需要排除其他病毒相关性肾病,以及血容量不足、药物肾毒性和药物所致的变态反应等,并重视有无基础肾脏疾病[15]。合并CKD病史的患者,要注意评估其既往肾脏疾病是否加重,特别是免疫复合物介导的肾病和其他病毒相关性肾病。所有合并AKI患者均应进行肝炎病毒标志物、HIV、EB病毒、抗中性粒细胞胞质抗体(ANCA)和抗肾小球基底膜(GBM)抗体等自身抗体,以及免疫固定电泳等检测,排除其他继发性肾脏疾病[16]。COVID-19患者肾脏疾病从病理学和解剖学的角度可以分为肾小管、肾间质损伤和肾小球病变,同时还可以评价肾功能进一步分类。见图1。
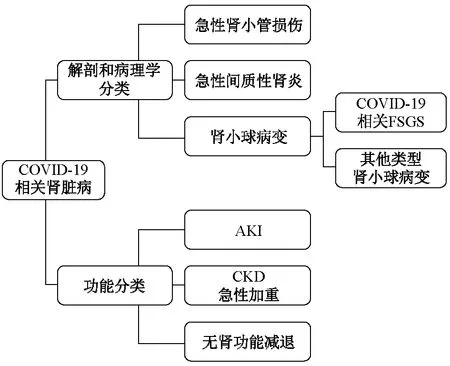
图1 COVID-19相关肾脏病分类
2 新型冠状病毒感染导致肾损伤的相关机制
新型冠状病毒感染导致肾损伤的相关机制包括病毒直接打击、细胞因子损伤、器官交互作用和全身系统性反应。①病毒直接打击:在病变的肾组织中发现的病毒核蛋白和颗粒提示病毒对肾脏具有直接毒性作用。目前认为,血管紧张素转换酶2(angiotensin converting enzyme 2,ACE2)是新型冠状病毒受体。ACE2 是Ⅰ型跨膜蛋白,主要表达在血管、肾脏、肺、心脏、回肠等组织,生理条件下ACE2通过将血管紧张素Ⅰ转换为血管紧张素1-9,血管紧张素Ⅱ转换为血管紧张素1-7,降低循环中血管紧张素Ⅱ水平。在新型冠状病毒感染时,ACE2与新型冠状病毒结合会减少血管紧张素Ⅱ的清除;肾脏的ACE2表达量较高,新型冠状病毒与近端肾小管ACE2结合可直接造成病毒相关性肾损伤[9]。新型冠状病毒和肾小球ACE2结合则促使足细胞空泡样变性、足突融合[17]。肾活检结果也提示,在肾小管、足细胞表达ACE2的部位存在新型冠状病毒核蛋白及其颗粒。②细胞因子损伤:COVID-19患者TNF-α、IL-1、IL-6、IL-12、IFN-α等水平明显升高[18],提示细胞因子风暴存在,炎症因子介导的全身炎症反应失控,引起肾血管通透性增加,有效循环容量下降,最终导致肾损伤。③器官交互作用:急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)发生时可存在“肺-肾对话”。AKI时血清IL-6水平升高与肺泡毛细血管通透性增高、肺泡出血有关,损伤的肾小管促进IL-6表达上调,则进一步加重炎症反应。ARDS还会导致肾脏髓质缺氧,加重肾小管损伤[19]。此外,高流量机械通气时腹腔内压力增高,肾血流量减少也会诱发或加重AKI。“心-肾对话”是COVID-19患者发生AKI的另一个可能机制。炎症因子引起心肌病、急性病毒性心肌炎时,静脉淤血、低血压、肾脏灌注降低,促使患者发生急性心肾综合征。④全身系统性反应:在危重情况下出现容量过负荷,第三间隙体液丢失引起的容量相对不足、低血压、横纹肌溶解、脓毒症等都是潜在的AKI病因[20]。 综上所述,新型冠状病毒通过与ACE2结合,直接损伤肾脏。细胞因子风暴通过免疫机制介导引起肾损伤,并通过“肺-肾对话”“心-肾对话”等加重肾损伤。见图2、3。CKD、肥胖、高龄、糖尿病、高血压、肿瘤、病毒性肝炎、HIV感染、器官移植和使用免疫抑制剂的患者是COVID-19相关性肾损伤的易感人群。
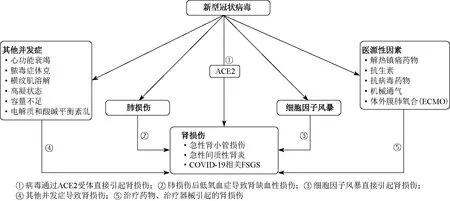
图2 COVID-19相关性肾损伤的机制
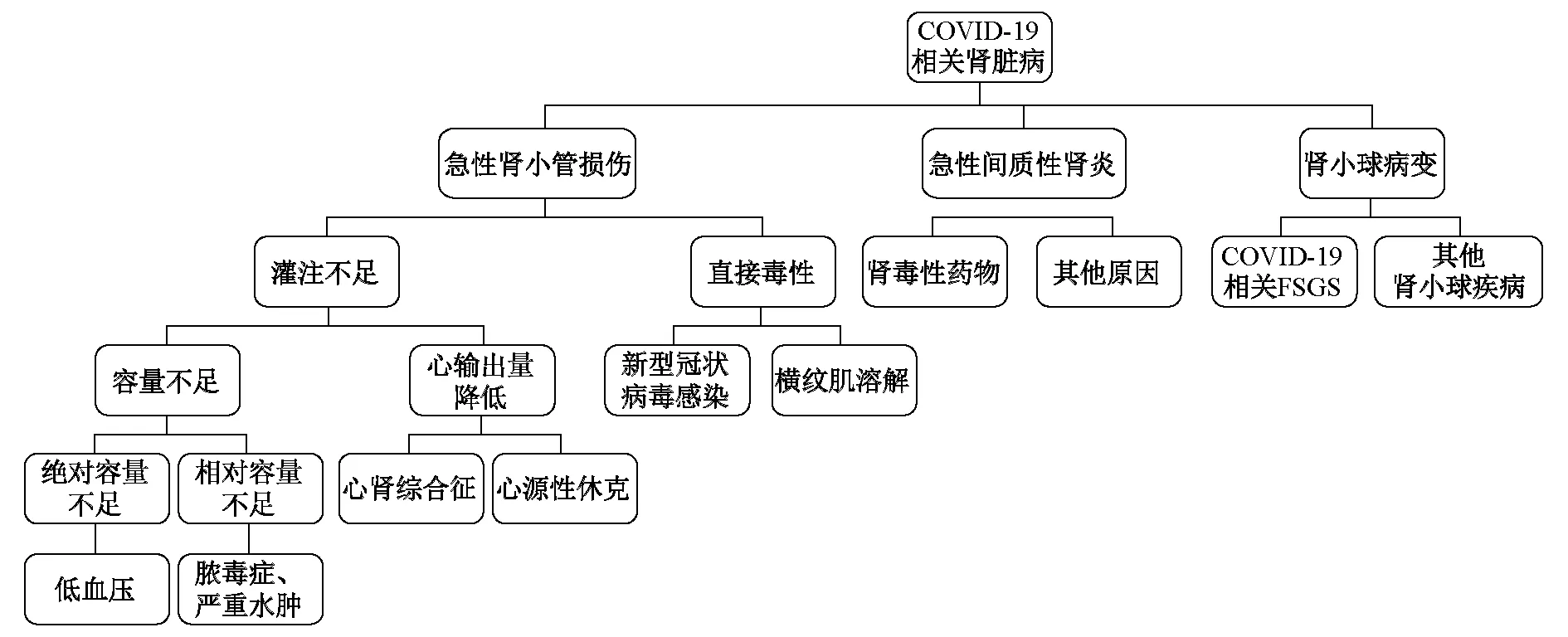
图3 COVID-19相关肾脏病的病因诊断
3 新型冠状病毒感染导致AKI的治疗策略
一般治疗包括休息、积极支持治疗、避免肾毒性药物(如NSAID)、积极改善心肺功能、控制继发感染。
肾脏替代治疗是AKI治疗的重要手段,血液净化治疗是首选方案[21]。治疗指征包括AKI≥2期、严重容量超负荷、电解质和酸碱平衡紊乱、合并严重ARDS、脓毒症休克、急性肝衰竭或多器官功能衰竭、高炎症因子水平或持续无法控制的高热。应对重型和危重型COVID-19患者制订以目的为导向的治疗策略。一般治疗目的包括:①氮质和代谢产物的清除。②容量清除和维持血流动力学稳定。③纠正电解质、酸碱平衡紊乱,保持内环境平衡。④清除炎症因子,重塑免疫稳态。⑤控制高热。⑥联合ECMO等进行多器官功能支持。技术包括连续性肾脏替代治疗(CRRT),血液和(或)血浆灌流、吸附,血浆置换,其他形式的血液净化技术。重型和危重型COVID-19患者存在高凝状态和肝衰竭等[7],故推荐个体化抗凝方案,包括普通肝素、低分子肝素和枸橼酸抗凝等。枸橼酸抗凝的起始治疗剂量为3.5 mmol/L,维持滤器后离子钙浓度为0.25~0.35 mmol/L。枸橼酸抗凝可能降低出血风险,延长滤器使用寿命,但需监测血钙和进行心电监护。低分子肝素抗凝剂量为3.5 mg/h,普通肝素抗凝初始剂量为10~15 U/(kg·h)[22]。
4 特殊人群新型冠状病毒感染的防治
CKD患者、肾移植患者、透析患者存在免疫功能缺陷,是COVID-19的高危人群。①长期使用免疫抑制剂的CKD患者,一旦疑似或者确诊COVID-19应立即停用细胞毒性药物[23],轻症感染者建议减少糖皮质激素用量[泼尼松0.2 mg/(kg·d)],可以保留低剂量钙调神经磷酸酶抑制剂,取得完全缓解超过12个月的患者可考虑停用免疫抑制剂。重症患者停用免疫抑制剂[24],并密切监测其免疫功能。②肾移植患者发生感染后建议立即停用细胞毒性药物,减少钙调神经磷酸酶抑制剂剂量[25]。维持性血液透析患者感染新型冠状病毒后,发热、咳嗽等呼吸道症状常不明显,但使用呼吸机的患者比例和病死率均显著高于非透析患者[26]。而且病毒存在通过被尿液、粪便等污染的气溶胶传播风险,所以针对血液透析中心患者的安全防护措施丝毫不能松懈,必须严格执行国家规定的消毒隔离措施。疑似或确诊COVID-19的维持性血液透析患者需转至定点医院的隔离病房行CRRT 等床旁肾脏替代治疗,并配备专门医师和护理人员[27]。研究[28]发现,血液透析患者感染新型冠状病毒后能够分泌免疫球蛋白G(IgG)抗体,但病毒血症的消失要迟于症状消失,所以建议至少连续2次病毒核酸检测阴性后方可解除隔离。腹膜透析患者也应响应卫生政策要求,减少外出,严格做好防护工作[29]。
5 中医药多靶点、多途径防治COVID-19
在当前尚无特效药物治疗COVID-19的前提下,中医药治疗在临床实践中取得了一定疗效,并且已升级为国家战略,其治疗的理念不在于单纯抗病毒,而是通过抑制炎症因子、调节免疫、RAS等多个靶点来治疗COVID-19,从而发挥中药的优势。
现代中成药制剂的形成与发展,能使中医药更为便捷地应用于疾病的预防和治疗,体现了中医“未病先防”“既病防变”的治疗理念。现收集几种经临床证实对COVID-19疗效较为肯定的清热解毒类中成药,并分析其作用靶点和机制。
临床对131例未进行中医分型的COVID-19患者观察发现,经甘露消毒丹汤剂联合治疗的治愈率100%,不良反应为0,显示出该中药制剂的普遍适用性和安全有效性[30]。邝玉慧等[31]通过网络药理学分析发现,甘露消毒丹除了针对ACE2和3CL水解酶(Mpro)两个关键的靶点外,还可以通过丝裂原激活蛋白激酶(MAPK)3、IL-6、血管内皮生长因子α(VEGFα)、表皮生长因子受体(EGFR)、MAPK1等核心靶点起到抗病毒、抗炎症、调节免疫等整体调控,从而发挥治疗COVID-19的作用。宣肺化浊方是专家组结合甘肃省COVID-19病例特点拟订的中医药治疗早期COVID-19的基础治疗方,药物组成为蜜麻黄、连翘、前胡、法半夏、麸炒苍术、广藿香、羌活、酒大黄、陈皮、黄芩。冯彩琴等[32]的研究基于COVID-19的发病特征,结合ACE2、IL-6受体(IL-6R)分子结构,利用靶点反向预测、分子对接等方法分析发现,宣肺化浊方中的化合物发挥抗病毒、抗氧化、抗炎症的潜在作用靶点为磷脂酰肌醇3激酶调节亚单位1(PIK3R1)、SRC(肉瘤基因)、丝氨酸/苏氨酸蛋白激酶1(AKT1)、AR(雄激素受体)和EGFR等。曹如冰等[33]对《新型冠状病毒肺炎诊疗方案(试行第七版)》中推荐的医学观察期4种口服中成药藿香正气胶囊(丸、水、口服液)、金花清感颗粒、连花清瘟胶囊(颗粒)、疏风解毒胶囊(颗粒)治疗COVID-19的潜在共性作用机制进行探讨,结果共发现化学成分为97个,共涉及靶点基因55个,其中半胱天冬酶3(casp3)、TP53、IL-10、TNF、IL-6、CXCL8、CCL2、MAPK8、FOS、MAPK1等基因可能是上述4种中成药发挥作用的重要共性靶点,其与IL-17、TNF、C型凝集素受体等信号调控通路和脂多糖反应、细菌分子反应、细胞因子刺激反应等多个生物过程有关,而共有化学成分多为黄酮类化合物,提示黄酮类化合物对COVID-19可能具有重要的作用。
综上所述,在缺乏特效药物治疗的情况下,中医药可以发挥多途径、多靶点治疗的优势,为防治COVID-19提供手段和方法。在对COVID-19合并肾损伤的相关靶点基因和机制进行深入探讨后,有针对性地使用中药治疗有利于进一步验证其作用机制并实现中药行业发展的现代化。
6 展 望
目前COVID-19疫情在全球仍未得到控制,国内仍需警惕疫情反弹。在缺乏有效疫苗的情况下,仍需加强肾脏病患者的感染防控,深入研究COVID-19的致病机制,优化合并AKI重症患者的救治策略,以期不断改善预后。疫情当前,肾脏科医师仍任重而道远。
