多胺对高温胁迫下小麦灌浆的影响及生理机制研究
2020-10-09靖建国李卫华
靖建国,郭 翔,俞 蓉,李卫华
(石河子大学农学院/兵团绿洲生态重点实验室,新疆 石河子 838202)
小麦(TriticumaestivumL.)属于喜凉的C 3作物,灌浆过程中能接受的最高温度为32 ℃[1,2]。籽粒质量作为最后形成的产量要素,主要由灌浆时间和灌浆速率决定,但小麦灌浆期常出现持续高温天气,引起小麦体内生理代谢紊乱、植株早衰,从而导致灌浆时间减少,灌浆速率降低,最终造成小麦减产,严重时产量只有正常条件的80%[3]。因此,采用有效的调控措施缓解高温胁迫对小麦籽粒灌浆的抑制作用,对小麦的高产稳产具有重要意义。
多胺是生物体代谢过程中产生的具有生物活性的低分子量脂肪族含氮碱[4,5],具有调节植物生长发育和增强植物抵御环境胁迫等多方面的生理功能[6,7]。研究表明,多胺显著影响禾谷类作物籽粒灌浆,在水稻上,腐胺(Put)对籽粒灌浆有抑制作用,而精胺(Spm)和亚精胺(Spd)显著促进水稻籽粒灌浆[8,9],在玉米上,正常籽粒中多胺含量明显高于败育籽粒[10],在小麦上,游离Put随种子成熟脱水过程的变化不明显,而游离Spd和Spm水平明显上升[11],抗旱性强的小麦品种其体内较高的Spm和Spd含量能够拮抗干旱对小麦生长的抑制作用[6]。但有关高温胁迫下Spm和Spd对小麦籽粒灌浆的调控及其生理机制还缺乏相关研究。因此,本研究采用田间搭建PVC棚模拟高温处理,分析外源喷施Spm和Spd对高温胁迫下小麦籽粒灌浆动态、旗叶超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性和丙二醛(MDA)含量等指标的影响,以期为减轻高温对小麦生产造成的危害提供理论依据和技术指导。
1 材料与方法
1.1 材料和处理
实验于2018年3—7月在石河子大学农学院实验站进行,土壤含全氮0.76 g·kg-1,碱解氮0.058 g·kg-1,速效磷0.025 g·kg-1,全钾149 g·kg-1,有机质12.5 g·kg-1,土壤pH值为7.6。2017年9月基施磷酸二铵(含N量为16.5%,含P2O547.5%)155 kg·hm-2;2018年在小麦3叶期、拔节期、抽穗期和灌浆前中期(花后14 d左右)随水分别追施尿素70、150、80、80 kg·hm-2,供试材料为耐热品种新春6号和热敏感品种新春31号[11]。实验材料于3月24日播种,5月28日进入开花期。高温处理前选取生育进程与长势基本一致的植株用毛线进行标记,花后7 d田间搭建PVC棚对材料进行高温胁迫,连续处理5 d,每天10:00—18:00时放下塑料布(离地20 cm左右为通风区)进行棚内增温,其余时间段揭去塑料薄膜。用自动温度记录仪(RC-4 HA/C,江苏精创电气股份有限公司)记录处理期间棚内、外温度(温度计悬挂于小麦冠层上方30 cm处)。图1为处理期间棚内、外温度变化曲线图,由图1可看出,除18:00时外,其余各时间点棚内温度显著高于棚外温度,处理期间棚内平均温度为34.92 ℃,棚外平均温度为30.52 ℃,达到了热胁迫的效果。
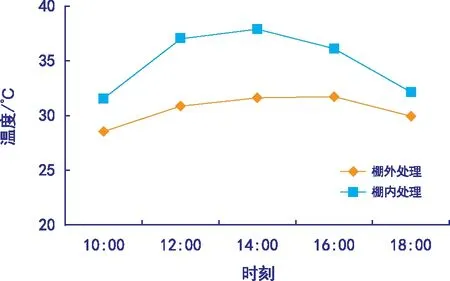
图1 处理期间大棚内外平均温度日变化
处理及标记方式为:对照(棚外正常生长条件),记为ck;田间模拟高温,记为HT;田间模拟高温+外施精胺(1 mmol·L-1),记为HT+Spm;田间模拟高温+外施亚精胺(1 mmol·L-1),记为HT+Spd。
外源多胺喷施从高温处理前1 d开始,连续处理5 d,处理时间为每天20:00时,喷施于旗叶和果穗,每次喷施量为20 mL(ck和HT处理喷清水)。
1.2 测试项目与方法
1.2.1小麦强、弱势粒粒重
分别于高温处理0、5、15、20、25 d进行取样,将小麦籽粒按照谭秀山等[13]的分类方法分为强势粒和弱势粒,经105 ℃杀青后70 ℃烘干称重。
1.2.2抗氧化酶活性
取冷冻的小麦旗叶,利用南京建成生物工程研究所生产的SOD、POD、CAT测试盒对抗氧化酶活性进行测定。
1.2.3丙二醛质量摩尔浓度、可溶性糖含量及脯氨酸含量
取冷冻的小麦旗叶,利用南京建成生物工程研究所生产的可溶性糖和脯氨酸测试盒测定可溶性糖和脯氨酸含量;采用张蜀秋等[14]的方法测定MDA质量摩尔浓度。
1.3 数据分析
处理数据和作图采用Microsoft Excel 2010软件,显著性检验采用SPSS 22.0软件。
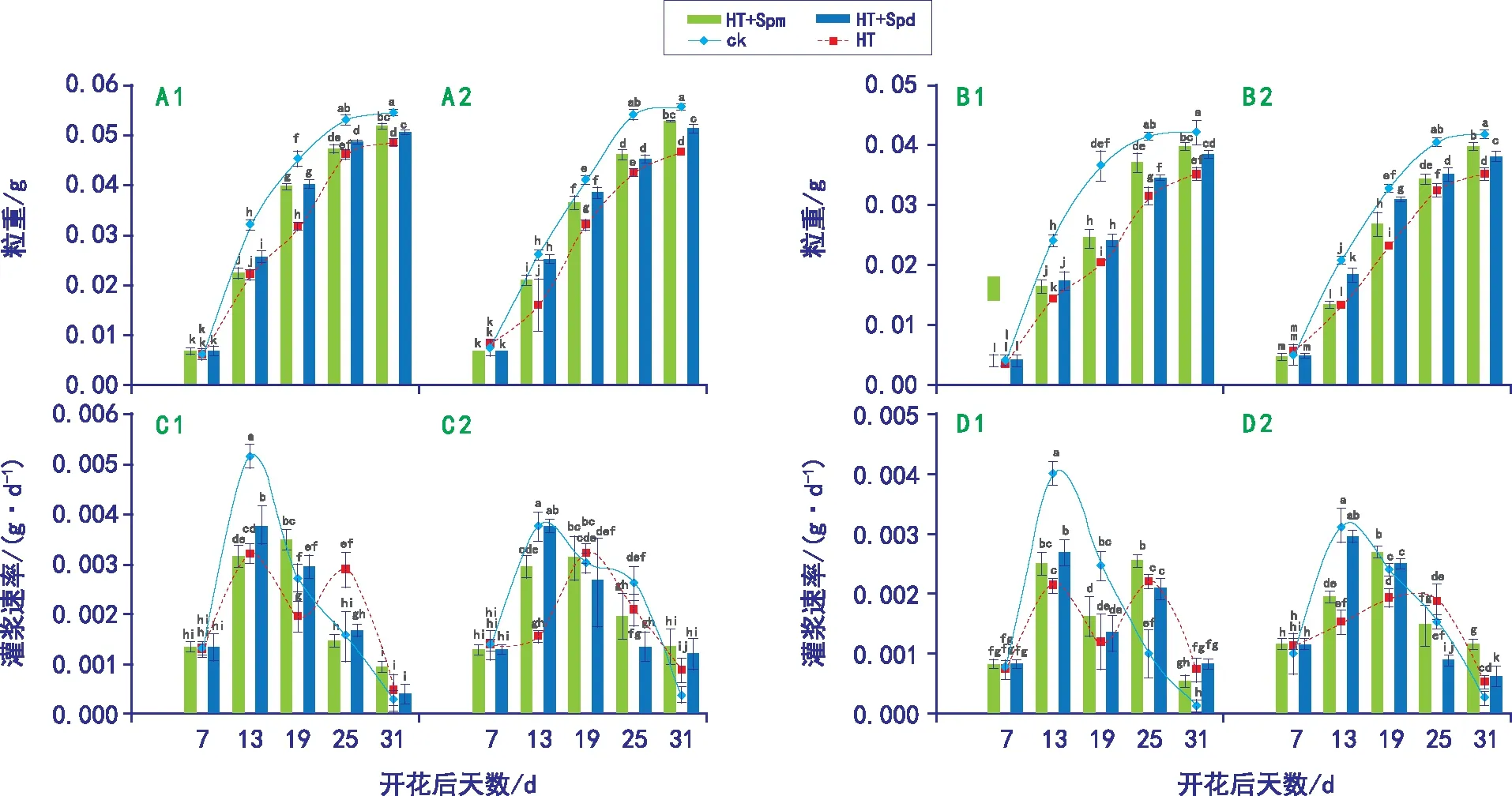
注:图中A、B、C、D分别表示强势粒重、弱势粒重、强势粒灌浆速率和弱势粒灌浆速率,1和2分别表示新春6号和新春31号;不同字母表示处理间差异显著(p<0.05)。下同。图2 不同处理下小麦强、弱势粒质量和籽粒灌浆速率
2 结果与分析
2.1 外源多胺对高温胁迫下籽粒灌浆的影响
由图2可知,高温胁迫对新春6号和新春31号强、弱势籽粒灌浆均有显著抑制作用,从花后13 d开始,HT处理的强、弱势粒质量显著低于ck,从2个品种强、弱势终粒重来看,HT处理对弱势粒(降低17%和16%)的影响大于强势粒(降低11%和16%),与ck相比,新春31号(降低16%)的强势粒质量下降幅度大于新春6号(降低11%),这说明不同品种在耐高温胁迫方面存在差异,新春6号优于新春31号,且维持高温胁迫下强势粒的灌浆能力是造成品种差异的主要原因;从花后19 d开始,HT+Spm和HT+Spd处理的强、弱势粒质量均显著高于HT,但显著低于ck,这说明外源Spm和Spd显著缓解高温胁迫对小麦籽粒灌浆的抑制作用,且从2个品种强、弱势终种粒质量来看,Spm的缓解效果优于Spd;从籽粒灌浆速率的曲线可以看出,除新春6号HT处理外,其它处理强弱势籽粒灌浆基本跟随灌浆进程呈先增大(花后13 d左右达到峰值)后降低的单峰变化趋势,HT处理下,新春6号强、弱势粒灌浆速率呈先增后减又增的变化,这说明新春6号在高温处理下能及时做出响应高温胁迫的调整。
由表1可知,HT处理下2个品种强、弱势籽粒的最大灌浆速率、最终粒质量和平均灌浆速率均显著低于ck,2个品种的活跃灌浆期表现为HT+Spd≥HT+Spm≥HT>ck,但差异均不显著,说明灌浆前期对小麦进行高温胁迫可能起到热锻炼的作用,延长了小麦的生育期,且高温胁迫主要通过影响籽粒灌浆速率进而影响粒质量;HT+Spm和HT+Spd处理下2个品种强、弱势籽粒的最大灌浆速率、最终粒质量、平均灌浆速率和活跃灌浆期均高于HT,HT+Spd处理下2个品种的最大灌浆速率大于HT+Spm,但最终粒质量和平均灌浆速率低于HT+Spm,这说明高温胁迫下喷施Spd只有阶段的缓解效果,而喷施Spm具有持久的缓解效果。
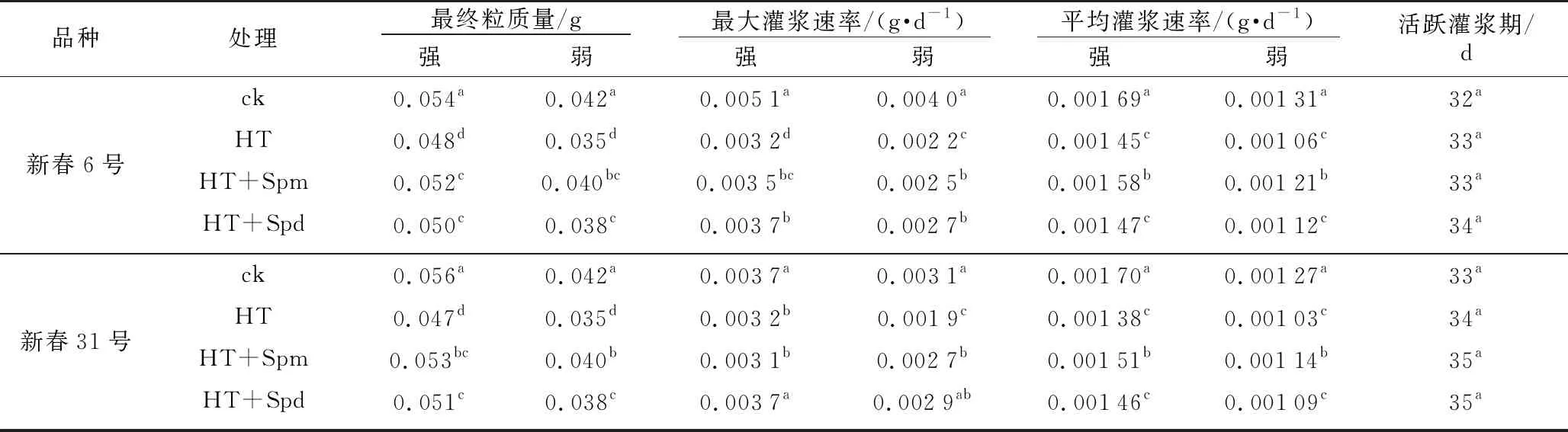
表1 不同处理下小麦强、弱势籽粒灌浆参数
2.2 外源多胺对高温胁迫下小麦旗叶抗氧化酶活性及丙二醛含量的影响
如图3所示,花后13 d,2个品种旗叶SOD活性和MDA含量表现为HT处理最高,均显著高于ck,说明灌浆前期高温胁迫引起旗叶细胞膜质过氧化,导致细胞膜系统受损,同时由于植物自身的抗逆系统存在,高温诱导旗叶SOD活性升高,减轻高温伤害;新春31号SOD活性和MDA含量高于新春6号,说明2个品种耐热性存在差异,新春6号优于新春31号;高温胁迫下喷施外源Spm和Spd的SOD活性和MDA含量低于HT,说明外源喷施Spm和Spd可以减少O2.-的增加,从而缓解细胞膜的过氧化,减轻细胞膜受损程度;从SOD活性和MDA含量的降低效果来看,喷施Spd缓解高温伤害效果优于Spm。
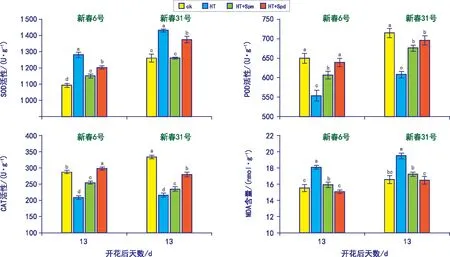
图3 不同处理下小麦旗叶抗氧化酶活性及丙二醛含量变化
花后13 d,2个品种旗叶POD和CAT活性表现为HT处理最低,显著低于ck,这说明高温胁迫抑制了POD和CAT的保护作用,降低了它们清除H2O2的能力;高温胁迫下喷施外源Spm和Spd的POD和CAT活性高于HT,说明外源喷施Spm和Spd可以缓解高温胁迫对POD和CAT活性的抑制,从提高高温胁迫下POD和CAT活性的效果来看,Spd优于Spm。
常温条件下,新春31号的SOD、POD和CAT均高于新春6号,说明品种间抗氧化保护系统存在差异,结合花后13 d的粒重和灌浆速率来看,较低的抗氧化酶活性可能是新春6号粒重增加速率大于新春31号的原因。
2.3 外源多胺对高温胁迫下小麦旗叶可溶性糖和脯氨酸含量的影响
如图4所示,花后13 d,HT处理下新春6号旗叶可溶性糖含量为11.85 mg·g-1,新春31号旗叶可溶性糖含量为13.89 mg·g-1,与ck相比显著降低了38%和25%,这与花后13 d HT处理的粒重增加速率及净光合速率相对应,说明高温胁迫加速了光合产物向籽粒运输,且新春6号运输速率大于新春31号;2个品种高温处理下喷施外源Spm和Spd的旗叶可溶性糖均显著高于HT,且外源Spm的可溶性糖含量高于外源Spd,说明高温胁迫下外源Spm和Spd可以通过提高旗叶细胞内的可溶性糖含量提高渗透调节能力,从而提高籽粒的灌浆速率,且Spd提高灌浆速率效果优于Spm。

图4 不同处理下小麦旗叶可溶性糖含量和脯氨酸含量变化
花后13 d,2个品种HT处理的旗叶脯氨酸含量均显著高于ck,且新春6号的增加幅度高于新春31号,说明高温胁迫下小麦可以通过提高脯氨酸含量提高渗透调节能力响应高温胁迫,且新春6号这种响应高温胁迫的能力优于新春31号;2个品种高温处理下喷施外源Spm和Spd的旗叶脯氨酸含量显著高于HT,且外源Spm的脯氨酸含量高于外源Spd,说明高温胁迫下外源Spm和Spd可以通过提高旗叶细胞内的脯氨酸含量提高渗透调节能力,缓解高温胁迫对旗叶伤害,且Spm缓解效果优于Spd。
3 讨 论
3.1 外源多胺对高温胁迫下小麦籽粒灌浆的影响
籽粒质量作为最后形成的产量要素,主要由灌浆时间和灌浆速率决定[15]。但近年来由于全球变暖和生态环境的变化,小麦在其灌浆期间会受到不同程度高温胁迫,导致灌浆时间减少,灌浆速率降低造成粒重降低[16],有研究表明,非生物胁迫显著影响禾谷类作物籽粒灌浆,干旱胁迫下,小麦、水稻和玉米等作物籽粒灌浆过程均受到显著抑制[17-19]。本研究发现,高温胁迫对小麦籽粒灌浆有显著抑制作用,且对弱势粒的抑制作用大于强势粒,这与杨建昌等[20]研究得出的“强势粒重在不同环境条件下相差不大,而弱势粒重的波动较大”结论相一致。多胺作为一种新近发现的植物激素,参与调节植物生长发育和增强植物对环境胁迫抵抗能力[6,21,22]。外源喷施Spm和Spd能显著提高高温胁迫下2个品种强弱势粒的终粒重和最大灌浆速率,这与张伟杨等[17]和刘凯等[18]的研究结果一致;另外,高温胁迫下外源喷施Spd提高灌浆速率和粒重的效果在灌浆前期优于外源Spm,外源喷施Spm的提高效果在生育后期优于Spd,结合外源Spm显著提高2个品种强弱势粒的平均灌浆速率,而外源Spd虽然使平均灌浆速率提高,但与HT处理差异不显著。因此,外源Spm对高温胁迫下小麦籽粒灌浆的提高优于Spd。
3.2 外源多胺对高温胁迫下小麦籽粒灌浆的调节与旗叶生理代谢关系
旗叶作为小麦灌浆期的主要源器官,能否维持正常的生理功能与籽粒灌浆密切相关,高温胁迫会影响植物一系列的代谢平衡,导致酶代谢失活[23],大量积累活性氧,引发氧化胁迫,进而破坏细胞膜结构,最终造成减产[24]。本研究发现,高温胁迫下2个品种旗叶SOD活性、脯氨酸和MDA含量均显著高于ck,旗叶SOD活性和脯氨酸含量的升高,可能与小麦自身调节有关,通过提高渗透调节物质脯氨酸的含量维持相对正常的细胞渗透压去适应高温胁迫,膜脂过氧化产物MDA含量的上升,表明高温对细胞膜产生了严重损伤;外源Spm和Spd能有效降低高温胁迫下MDA的升高,表明外源多胺显著减轻高温胁迫对细胞膜的损伤作用。高温胁迫导致2个品种旗叶POD和CAT活性与ck相比显著降低,这与陈庆等[15]和张仁和等[25]的研究结果一致。高温处理下,2个品种旗叶可溶性糖含量与ck相比显著下降。郭洪雪等[26]认为,2叶期小麦在高温胁迫下可溶性糖含量一直呈上升趋势;这可能是由于研究的生育时期不同,在灌浆期小麦在应对高温逆境加速籽粒灌浆有关。本研究观察到,在灌浆初期喷施外源Spm和Spd可以显著提高高温胁迫下小麦旗叶的POD、CAT活性、可溶性糖和脯氨酸含量,这说明外源2种多胺可以有效缓解高温胁迫对小麦叶片造成的伤害,使旗叶维持相对正常的生理功能,从而提高高温胁迫下小麦籽粒灌浆。高温处理后,外源Spd对高温胁迫下小麦旗叶的POD、CAT活性的提高以及MDA含量的降低效果优于Spm,外源Spm对高温胁迫下小麦旗叶可溶性糖的降低以及脯氨酸含量的升高优于Spd,这可能与外源多胺被植物吸收后在植物体内的代谢途径有关,本研究计划下一步测定小麦籽粒和旗叶内源Spm和Spd含量动态变化,进一步分析2种多胺缓解高温胁迫下小麦灌浆机制。
4 结 论
在高温胁迫下小麦籽粒灌浆被显著抑制,外源喷施Spm和Spd能显著促进小麦籽粒灌浆,不同类型多胺对高温胁迫下小麦籽粒灌浆的调控效果存在时间上差异,外源Spd在喷施前期(花后13 d)对籽粒灌浆的调节效果优于外源Spm,此后外源Spm的缓解效果始终优于Spd;外源多胺可能通过提高旗叶POD、CAT活性、可溶性糖和脯氨酸含量以及抑制MDA含量升高调控高温胁迫下小麦籽粒灌浆。
