泉州中华蜜蜂遗传多样性分析
2020-10-09张以宏
张以宏
(泉州市畜牧站,福建 泉州 362000)
蜜蜂是保护生态系统良性循环的重要环节,在维持生物多样性方面有重要的价值和意义,能有效促进农牧业增产增值,并且还提供人类丰富、健康的蜜蜂产品[1-4].中华蜜蜂(Apiscerana)是我国蜜蜂属最重要的种之一,是我国宝贵的本土遗传资源,长期与我国当地的环境适应,形成了善于利用零星蜜粉源、低温条件下采集、抗螨等优良性状[5].由于人类现代工业、农业的活动和农村环境的变化,蜜蜂生存环境破碎化.西方蜜蜂的引进和大量饲养,加剧了我国珍贵的本土中华蜜蜂蜂种资源面临的严重危机.
福建省位于中国东南沿海,山地丘陵面积约占全省土地总面积的90%,森林覆盖率居全国首位(62.96%)[6].福建省在自然条件下蕴涵了丰富的中华蜜蜂资源,存在大量的野生蜂群,是中华蜜蜂模式标本的采集地.同时,中华蜜蜂还是福建最主要的饲养蜂种,大约2/3的饲养蜂群为中华蜜蜂[7].对福建省的中华蜜蜂种群已从形态和分子角度分别进行了研究.在形态遗传标记分析中,3个团队分别用3、5、30个形态标记研究福建的中华蜜蜂遗传分化.20世纪80年代,许少玉和杨冠煌根据吻长、翅长和肘脉指数研究了福州、永泰和南靖的中华蜜蜂[8].国家资源委员会通根据吻长、前翅长、前翅宽、肘脉指数、3+4腹节背板总长的5个指标,及其它生物学特征将福建的中华蜜蜂归为华南中蜂[9].周冰峰教授团队根据西方蜜蜂的形态测量标记,测定了福建省除了泉州外的6个市的中华蜜蜂,发现各样点间有明显的形态差异[10].随后,又通过5个微卫星标记和线粒体非编码区研究福建省的中华蜜蜂,发现微卫星多样性水平处于中度多样性,线粒体遗传多样性水平较低[11-12].但是文献中未见对泉州中华蜜蜂遗传资源的研究.
泉州位于福建省东南沿海,是福建省经济发达且自然条件优越的地级市.境内山峦起伏,丘陵、河谷、盆地错落其间.地跨中南两个亚热带,有短期干旱的亚热带雨林带,常年雨量充沛,水资源相当丰富.日照时间长,光热资源丰富,造就了泉州丰富的蜜粉源植物资源.泉州主要蜜粉源植物有荔枝、龙眼、乌桕、枇杷、柃木、八叶五加等,这些丰富的蜜粉源植物非常适合中华蜜蜂生产.全市中华蜜蜂饲养量达52 784群,泉州所辖区市县均有饲养.据2019年的统计,鲤城、丰泽、洛江、泉港四个区4 650群,晋江市1 318群,南安市23 620群,惠安县3 875群,安溪县4 475群,永春县12 783群,德化县8 700群,蜂群数量占泉州饲养蜂群总数的88.8%.在中华蜜蜂遗传资源研究中,未见对泉州中华蜜蜂遗传资源的报道.本研究采用形态、微卫星和线粒体3种标记,对福建泉州的7个县市的样点进行全面的遗传分化、遗传特征和遗传多样性分析,探究泉州中华蜜蜂资源的特点,为保护和利用泉州本土的中华蜜蜂遗传资源提供依据.
1 材料与方法
1.1 样本采集
中华蜜蜂样本采自泉州市7个样点,共487群,其中安溪(FJAX)63 群,德化(FJDH)88群,晋江(FJJJ)68群,永春(FJYC)72群,泉港(FJQG)62群,惠安(FJHA)63群,南安(FJNA)71群.为减少形态分析受样本发育的影响,在天气温和、蜜粉源丰富的4月下旬有利于中华蜜蜂良好发育的环境下,样本采集自正常蜂群.采集后样本用无水乙醇处理,并放置于-80 ℃的超低温冰箱保存备用.以辽宁省本溪市桓仁县(BXHR)的中华蜜蜂作为外群对照.
1.2 试验方法
1.2.1 形态标记测定 依据Ruttner[13]和杨冠煌[5]使用的蜜蜂形态遗传标记方法,共测定33个适合中华蜜蜂的形态遗传标记[14-15].包括与个体大小相关的吻长、第三背板长、第四背板长、第五背板长、第四腹板长、第四腹板蜡镜长、蜡镜斜长、蜡镜间距、第七腹板长、第七腹板宽、股节长、胫节长、基跗节长、基跗节宽,与翅相关的右前翅翅长、右前翅翅宽、肘脉指数、肘脉a、肘脉b、后翅钩数和11个翅脉角A4、B4、D7、E9、G18、J10、J16、K19、L13、N23、O26,与毛相关的第五背板绒毛带长、第六背板毛长.
将带JVC图像采集器(TK-C921EC)的变倍体视显微镜(GL-99T1)与电脑形态测量系统(Image-Pro Express)联用,对每个样点的60只蜜蜂样本进行拍照,并对每个样本的33个形态标记进行测量,获得形态数据.
1.2.2 基因组DNA提取与扩增 每群蜜蜂样本取1只工蜂提取全基因组,并分别进行微卫星标记和线粒体标记的扩增.
微卫星标记利用ExTaq Hot Start Version扩增试剂盒(宝生生物工程有限公司,大连)进行38个微卫星标记扩增试验,引物序列、PCR的扩增体系和扩增程序参考文献[16-17]. 成功扩增出目的条带的样品送至北京金唯智公司(GENEWIZ)进行基因分型.
线粒体标记采用蜜蜂属特有的tRNAleu~COII序列进行扩增,引物序列、PCR扩增体系和扩增程序[18].PCR产物为352 bp序列,测序由上海英骏(Invitrogen)生物技术有限公司完成,测序仪为ABI PRISM 3730xl.本试验得到的序列用Clustal X软件进行序列比对,并与测序图核对校准. 有变异的个体,进行重复测序,验证其准确性.
1.3 数据分析与统计
形态数据使用SPSS 20.0软件和STATISTICA 10软件进行分析. 采用SPSS 20.0软件进行逐步判别分析、聚类分析和ANOVA分析.采用STATISTICA 10软件,进行主成分分析,将33个标记通过线性变换,提炼出少数几个能充分反应差异信息的标记,并利用SPSS 20.0软件构建主成分散点图和聚类树.
微卫星数据分析用Genepop在线分析样点间的遗传分化系数[19].采用Poptree 2构建系统发育树,Structure软件进行遗传结构分析[20-22].Excel Micro-Satellite Toolkit 3.1[23]计算期望杂合度(He)、观察杂合度(Ho)、平均多态信息含量(PIC).对线粒体数据采用DnaSP 5.0计算各样点的平均核苷酸差异数(K),核苷酸多样度(Pi)和单倍型多样度(Hd)[24].
2 结果与分析
2.1 泉州中华蜜蜂遗传分化
根据各样点中华蜜蜂的形态分化分析、微卫星遗传分化分析和线粒体分化分析的结果,未发现泉州中华蜜蜂发生种群遗传分化.
泉州样点的形态标记主成分分析中的前2个主成分贡献率占65.9%.其中主成分1贡献率为47.31%,贡献率高的形态标记包括吻长、肘脉指数、第三背板长、第四背板长、第五背板长、第五背板绒毛带长、第六背板绒毛长、第四腹板长、蜡镜长、蜡镜斜长、蜡镜间距离、第四腹板长、蜡镜长、蜡镜间距离、第七腹板宽、翅脉角J10、肘脉a、肘脉b.主成分2贡献率为18.62%,其中贡献率高的形态标记包括第五背板绒毛带长、第七腹板长、基跗节长、翅脉角B4、D7、L3.在主成分1和2的主成分散点图中,主成分1可明显将泉州样点和外群分开(图1A).前4个主成分对变异解释的贡献率占87.1%,以此4个主成分进行聚类分析,泉州7个样点聚为一支(图1B).形态数据的判别散点分析结果与主成分分析结果相似,同样显示泉州所有样点远离外群聚为一组(图1C).将解释变异率达86.7%的前3个判别函数的重心函数进行聚类,泉州7个样点聚为一支(图1D).
微卫星标记分析表明,泉州各中华蜜蜂样点之间的遗传分化系数(Fst)在0.03~0.10之间,但与外群BXHR样点的Fst值在0.17~0.25之间.泉州各样点的基因流Nm值在4.5~18.7之间.以遗传分化系数(Fst)构建的UPGMA聚类树(图2A)和N-J聚类树(图2B)中,所有泉州样点在聚类树的内层聚为一支.遗传结构Structure分析中,根据形态分化结果预先设置分组K=2,结构图显示泉州中华蜜蜂遗传结构相似,与外群的遗传结构有显著差异(图3).
2.2 泉州中华蜜蜂的特征
泉州7个样点的中华蜜蜂的主要形态标记特征相似.在测定的标记中,有27个标记无显著差异,或差异较小.其中翅宽、肘脉指数、后翅钩数、第七腹板宽这4个标记无显著差异.吻长、第五背板长、第五背板绒毛带长和胫节长在样点间的差异较大(P<0.01),但未发现与样点分布相关(表1).
泉州中华蜜蜂的线粒体tRNAleu~COII片段共检测到28种单倍型,其中9种为新发现单倍型(表2).泉州7个样点均以Acmt01001为主要单倍型,该单倍型在各样点总样本量的比例为50%~88%.单倍型Acmt01016在3个样点检测到,在晋江样点和南安样点占比较大,分别占样本量的24%和15%.单倍型Acmt01002为4个样点共有,在德化样点检测到较多样本,占比18%.单倍型Acmt01030为4个样点共有,在安溪样点检测到较多样本,占比17%. 其余25种单倍型的检测频率较小,其中15种仅在1个样点检测到(表2).
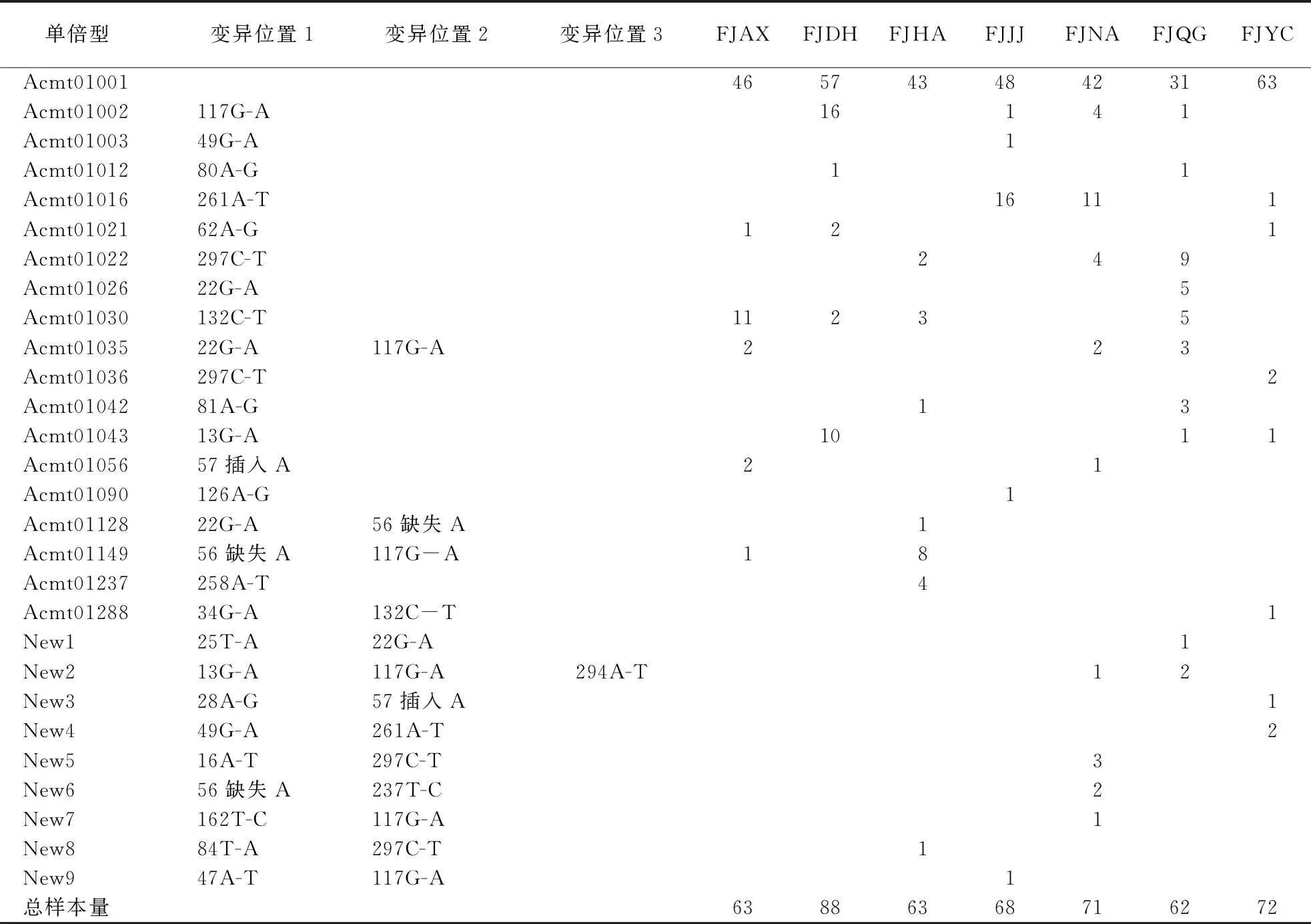
表2 泉州中华蜜蜂单倍型分布1)
2.3 泉州中华蜜蜂的遗传多样性
泉州各样点的中华蜜蜂微卫星遗传多样性水平较为一致.期望杂合度(He)在0.440 7~0.513 1之间,观察杂合度(Ho)在0.406 2~0.512 4之间,平均多态信息含量(PIC)在0.409 1~0.476 5之间(表3).根据微卫星数据计算泉州7个中华蜜蜂样点间的近交系数(Fis)范围在-0.001 2~0.062 1之间.

表3 泉州7个样点的微卫星和线粒体tRNAleu~COII多样性参数
泉州7个样点的单倍型共发现29种,其中泉港、南安的单倍型数量最多,分别为11种和10种.变异位点数最多的样点是南安,有11个变异和插入缺失位点.单倍型多样性(Hd)的范围在0.241~0.739,平均核苷酸差异数(K)为0.339~0.926,核苷酸多样度(Pi)为0.000 96~0.003 34(表3).
3 讨论
本研究对泉州各县市的中华蜜蜂进行了全面的样本采集,从分子水平和形态水平了解泉州中华蜜蜂的种群遗传现状,明确了泉州中华蜜蜂的遗传多样性和遗传结构.33个形态标记和微卫星标记的遗传分化分析表明,虽然泉州市沿海和山区环境略有不同,其样点间中华蜜蜂均未发生遗传分化,仍属于同一种群.通过基因流分析,泉州各样点的中华蜜蜂基因流水平较高,也说明不具备遗传分化的条件.在泉州中华蜜蜂遗传资源保护和养蜂生产应用中,全市区域可作为一个整体进行规划.
本研究中检测的单倍型数量比预期多.建立在大样本量487个蜂群的基础上,在泉州共检测出29种单倍型,其中有17种未在福建省中华蜜蜂中检测到,有9种是从未报道的单倍型[12].泉州中华蜜蜂的单倍型结构与福建省其它地市的中华蜜蜂相似,都是以单倍型Acmt01001为主,占总样本量的68%[12].泉州这些单倍型信息,特别是新单倍型,为中华蜜蜂种群遗传学研究、亚种分类、系统发育、起源、进化、生物地理学的研究提供了依据.
泉州中华蜜蜂的线粒体遗传多样性和微卫星遗传多样性参数,均在福建省中华蜜蜂的遗传多样性参数范围内[11-12].与全国其它地区中华蜜蜂相比,泉州中华蜜蜂处于中度多样性水平[25-37].但是,泉州中华蜜蜂的微卫星多样性参数在7个样点间差异较小,而线粒体多样性参数在不同样点间的差异较大.并且,各样点除Acmt01001为主要单倍型外,占样本量第2的单倍型差异较大,安溪为Acmt01030,德化为Acmt01002,惠安为Acmt01149,晋江为Acmt01016,南安为Acmt01016,泉港为Acmt01022.线粒体是由母系遗传的,所以这样的结果极有可能是由于在少数蜂群中移虫育王或远距离引种带来的影响.从保护地方中华蜜蜂遗传资源的角度考虑,要避免在少数蜂群中移虫育王和远距离引种.
