高级扩散加权成像比单指数DWI在鉴别移行带前列腺癌与前列腺增生的优势
2020-09-30任慧鹏范晴王晓虎任转琴
任慧鹏,范晴,王晓虎,任转琴
前列腺癌(prostate cancer,PCa)发病率逐年上升,已成为我国70岁以上男性第一高发泌尿系肿瘤[1]。约20%的PCa发生在位置较深的移行带(transition zone,TZ)[2],前列腺增生(benign prostatic hyperplasia,BPH)更是好发于移行带,两者临床表现相似,故早期诊断TZ-PCa有重要的临床意义。
MRI已成为前列腺检查的首选方法,扩散加权成像(diffusion-weighted imaging,DWI)在前列腺癌临床诊断中受到越来越多的应用[3],但是TZ-PCa与BPH的ADC值仍存在一定重叠[4-5]。高级扩散加权成像包含了体素内不相干运动DWI (introvoxel incoherent movement DWI,IVIM-DWI)、拉伸指数DWI模型(stretched exponential DWI model,SEM)、扩散峰度成像(diffusion kurtosis imaging,DKI)等非高斯扩散后处理模型[6],这些模型通过多b值、高b值多维度分析,能更加真实和精确地反映组织扩散特性。本研究探讨IVIM-DWI的慢速扩散系数(ADC slow )、SEM的扩散分布系数(distributed diffusion coefficient,DDC)及DKI的平均峰度(mean kurtosis,MK)等在TZ-PCa与BPH的鉴别诊断是否优于单指数DWI的ADC值。
1 材料与方法
1.1 一般资料
收集2017年10月至2018年11月在我院接受前列腺MRI检查的病例104例,纳入标准:(1)配合良好,图像清晰,扫描序列完整;(2) MRI检查前未进行穿刺活检或治疗;(3)病变位于前列腺移行带;(4) MRI检查后2周内在我院行经直肠超声引导下穿刺活检或前列腺根治性手术取得病理结果。排除标准:(1)扫描序列不全,图像质量差;(2)检查前接受穿刺或治疗;(3)移行带及外周带均受累。所有患者检查前均签署了知情同意书。根据病理结果分为TZ-Ca组48例,26例行超声引导下穿刺活检,22例行根治性手术,Gleason评分为6~10分,其中3例为6分,8例为3+4=7分,10例为4+3=7分,15例为8分,7例为9分,5例为10分,平均年龄(76.4±5.7)岁,平均前列腺特异性抗原(prostate specific antigen,PSA)为(25.5±7.6) ng/ml;BPH组56例,49例行超声引导下穿刺活检,7例行根治性手术,其中间质为主型12例,腺体为主型9例,混合型35例,平均年龄(67.3±3.8)岁,平均PSA为(8.2±4.6) ng/ml。本研究为回顾性研究,已通过宝鸡市中心医院伦理委员会审核批准。
1.2 MRI检查方法
采用GE 3.0 T 750w MR扫描仪,体部相控阵线圈。患者检查前禁食、禁水4 h,适量储尿。对所有患者进行常规MRI序列、单指数DWI、多b值DWI (multiple b-value diffusion weighted imaging,Mb-DWI)及DKI序列扫描。单指数DWI扫描参数:TR 5000 ms,TE 100ms,矩阵128×128,FOV 370 mm×370 mm,b值0、1500 s/mm2,NEX为6。Mb-DWI扫描参数:TR 4000 ms,TE 92.5 ms,矩阵128×52,FOV 340 mm×136 mm,b值0、20、50、80、100、150、200、400、800、1000、1500、2000、2500 s/mm2,NEX为2、2、2、2、2、2、2、2、6、8、8、10、10。DKI扫描参数:TR 5000 ms,TE 92.5 ms,矩阵128×128,FOV 420 mm×420 mm,b值0、1000、2000 s/mm2,NEX为1。
1.3图像分析与处理
应用GE AW 4.6工作站进行图像重建及参数值测量。测量参数包括ADC、ADCslow、DDC及MK。由2名具有5年以上前列腺MRI诊断经验的主治医师采用双盲法对上述参数进行测量,意见不同时经协商达成一致。应用DWI软件处理单指数DWI序列获得ADC图;应用MADC软件处理MB-DWI序列(其中IVIMDWI的b值选取0~1000 s/mm2,SEM的b值选取0~2500 s/mm2);应用DKI软件处理DKI序列;通过将后处理图像与穿刺或手术部位病理对照确定病灶部位及范围,于病变最大层面勾画多个(≥3个)感兴趣区(region of interested,ROI),ROI面积≥30 mm2,并尽量避开出血、钙化及坏死区,计算平均值。
1.4 统计学分析
采用SPSS 25.0进行数据分析。对所有参数值进行正态性检验及方差齐性检验,符合正态分布后,计量资料以±s表示;采用组内相关系数(intraclass correlation coefficient,ICC)评价两名观察者测量结果的一致性,若一致性良好(ICC>0.75),采用标准差小的结果进行统计分析;采用两个独立样本t检验比较两组间参数值差异。绘制ROC曲线,分析各参数的诊断效能及计算阈值。采用Z检验比较诸参数曲线下面积(area under the curve,AUC)的差异性。以P<0.05为差异具有统计学意义。
2 结果
2.1 各参数的测量结果
2名观察者对两组各参数的测量结果一致性良好,ICC均>0.75(表1)
2.2 两组间单指数DWI及高级扩散加权成像参数值比较
TZ-PCa组ADC、ADCslow、DDC值明显低于BPH组,MK值明显高于BPH组(P均<0.001);见图1~3、表2。
2.3 单指数DWI、高级扩散加权成像(IVIM-DWI、SEM、DKI)参数值诊断效能比较
AUC由高到低依次为:ADCslow+DDC+MK、MK、DCC、ADCslow、ADC,其中ADCslow+DDC+MK、MK、DCC与ADC的AUC存在统计学差异(P均<0.05),ADCslow+DDC+MK、MK、DCC及ADCslow间的AUC无统计学差异,ADCslow+DDC+MK的敏感度和特异度均为100%(图4,表3)。

表1 2名观察者对两组各参数测量的ICC结果Tab. 1 ICC measured by two observers for each parameter of two groups
表2 两组间ADC、ADCslow、DDC及MK值比较(±s)Tab. 2 Comparison of ADC,ADCslow,DDC and MK values between the two groups (±s)
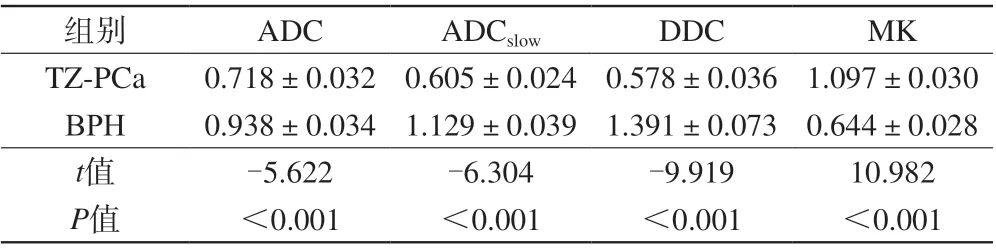
表2 两组间ADC、ADCslow、DDC及MK值比较(±s)Tab. 2 Comparison of ADC,ADCslow,DDC and MK values between the two groups (±s)
注:ADC、ADCslow及DDC的单位为×10-3 mm2/s
组别ADCADCslowDDCMK TZ-PCa0.718±0.032 0.605±0.024 0.578±0.036 1.097±0.030 BPH0.938±0.034 1.129±0.039 1.391±0.073 0.644±0.028 t值-5.622-6.304-9.91910.982 P值<0.001<0.001<0.001<0.001

表3 ADC、ADCslow、DDC、MK值及ADCslow+DDC+MK鉴别诊断TZ-PCa与BPH效能比较Tab.3 Comparison of ADC, ADCslow, DDC, MK and ADCslow+DDC+MK in differential diagnosis of TZ-PCa and BPH
3 讨论
PCa起源于前列腺腺泡或导管上皮,约80%的PCa发生在外周带,约20%发生在移行带。BPH则发生在包绕尿道周围的移行带。以往有学者研究发现T2WI难以将富含纤维基质的间质增生结节和TZ-PCa相鉴别[7]。PI-RADS V2的普及率也不是很高,其评分为主观评分,准确性受人为因素影响较大[8],因此难以做到同质化诊断。所以TZ-PCa和BPH的鉴别经常给临床诊断工作带来挑战。随着DWI多种数学模型的不断发展,诸多可量化的参数被用于鉴别两者的研究中。
单指数模型DWI可以检测活体内水分子扩散运动速率,其ADC值可定量评估肿瘤组织细胞密集度及核浆比等病理特征。以往研究显示TZ-PCa的ADC值明显低于BPH[9],但Gupta等[10]研究结果显示ADC值在TZPCa与BPH间存在较多重叠,包括BPH与高级别PCa;Oto等[11]及Liu等[7]发现间质增生结节与TZ-PCa间的ADC值存在较大重叠,这是因为致密的纤维基质排列和腺体的减少导致了间质增生结节内水分子扩散运动受限[12];除此之外,Nagel等[13]还发现了TZ-PCa与前列腺炎之间的ADC值也存在重叠现象。本研究结果显示TZ-PCa的ADC值明显低于BPH (P<0.001),但两组间的ADC值依然存在部分重叠,与上述研究结果相似,因为单指数模型DWI忽视了组织结构的复杂性,其ADC值包含了组织内血流灌注信息,导致描述扩散信息不够精确。
高级扩散加权成像包括了IVIM-DWI、SEM、DKI等多b值多维度分析、基于非高斯扩散的模型,其多种参数能够反映病变组织更加复杂的扩散特性。
IVIM-DWI是用多b值扫描来拟合双指数模型,从而提取出了高b值的扩散特性和低b值的灌注特性,ADCslow值免受了低b值状态下灌注对扩散的影响,能更准确地反映扩散特性。SEM的分布扩散系数DDC代表多指数衰减中一个平均化的ADC值。既往研究发现ADCslow及DDC在TZ-PCa与BPH鉴别诊断中表现优异,在与ADC值的比较研究中,Feng等[14]在不同b值范围的DWI对比研究中发现在各个b值范围内(0~1000 s/mm2、0~2000 s/mm2、0~3200 s/mm2、0~4500 s/mm2) ADCslow的AUC均小于ADC值,但DDC值在低b值范围(0~1000 s/mm2)的诊断能力高于ADC值(P=0.014),Li等[15]及陈雨菲等[16]在采用0~2000 s/mm2的较高b值范围时发现DDC值较ADC值依然无明显诊断优势,Li等[15]的研究结果还显示ADCslow的AUC小于ADC值(0.835与0.856)。上述结果可能和b值数量及高低有关,低b值反映血流灌注效应,高b值反映水分子扩散效应,随着b值增多,ADCslow值的准确度会增加,高b值范围计算出的DDC值诊断能力要优于低b值范围。本研究中IVIM-DWI采用10个b值(0~1000 s/mm2),SEM采用13个b值(0~2500 s/mm2),结果显示TZ-PCa的ADCslow、DDC值明显低于BPH组(P均<0.001),因为PCa细胞排列紧密,核浆比高,腺体破坏,限制了水分子自由运动,ADC、ADCslow、DDC值均降低,其中ADCslow去除了灌注因素的影响,DDC值则是多b值多区间的ADC值按体积分数加权比的总和,从而能更加精确地反映组织内水分子单纯扩散受限特性,两者鉴别Ca和BPH的能力增大。本研究结果显示ADCslow的AUC大于ADC值(0.989与0.927),两者无明显统计学差异(Z=1.944,P=0.052),但是ADCslow诊断的敏感度和特异度高于ADC值,DDC的诊断效能则优于ADC值(Z=1.994,P=0.046)。总之,IVIM-DWI及SEM较单指数DWI在TZ-PCa与BPH的鉴别中体现出更多优势。
由于人体组织微观结构复杂,水分子运动表现为更加复杂的非高斯扩散方式,DKI用峰度的概念量化了水分子在复杂环境中扩散位移与水分子高斯分布扩散位移间的偏离程度[17],更加真实地反映了水分子扩散受限程度及扩散的不均质性,从而进一步揭示了组织结构的复杂程度。MK值为各个方向上的平均峰度,其值越大表明扩散受限越严重,组织结构越复杂。Yi等[18]在一项关于DKI与单指数DWI对前列腺癌诊断效能比较的Mete分析研究中发现MK值与ADC值的诊断效能无明显差异。Tamura等[19]和Rosenkrantz等[20]的研究均显示MK值在鉴别PCa和BPH的AUC大于ADC值,虽然无统计学差异,但是敏感度高于ADC值。Feng等[14]及Mazzoni等[21]的研究则发现MK值鉴别TZ-PCa和BPH的诊断效能高于ADC值。本研究显示TZ-PCa组的MK值明显高于BPH组(P均<0.001),且MK值的诊断效能高于ADC值(Z=2.081,P=0.037),与Feng等[14]及Mazzoni等[21]的研究结果一致。笔者认为前列腺癌组织较增生组织内部排列更加紧密、紊乱,结构更加复杂,其内水分子扩散偏离高斯分布的程度远大于BPH组织,所以TZ-PCa组的MK值明显高于BPH组,MK值较ADC值更能反映组织内水分子扩散的不均质性及受限的程度,其鉴别TZ-PCa与BPH的能力优于单指数DWI的ADC值。
本研究中笔者还发现ADCslow+DDC+MK联合诊断的效能亦明显优于ADC值(Z=2.374,P=0.018),AUC高达1,虽然和ADCslow、DDC、MK之间的诊断效能无统计学差异(P均>0.05),但敏感度及特异度高于后三个参数,均高达100%,说明三个参数在体现水分子扩散及微观结构方面存在互补性,联合参数可进一步提高诊断的敏感度和特异度。本研究样本量较小,可能存在统计偏倚,其稳定性有待大样本量进一步研究验证。
综上所述,高级扩散加权成像较单指数DWI能够更加精确地探测前列腺组织水分子扩散特性及微观结构复杂程度,其在TZ-PCa和BPH的鉴别诊断中效能优于单指数DWI,可以为前列腺癌的临床诊断提供更加精确可靠的量化参数。
利益冲突:无
