基于多序列MRI影像组学模型预测宫颈鳞癌病理组织分型
2020-09-30李笑然郭妍徐臣亢野孙洪赞
李笑然,郭妍,徐臣,亢野,孙洪赞*
子宫颈癌每年新发病例数在女性肿瘤中位于第二位,由于HPV的预防和治疗条件不同,在发展中国家其发病数量呈现逐年增多及年轻化的趋势[1]。临床资料证明,子宫颈癌病理类型中约80%为子宫颈鳞状细胞癌(cervical squamous cell carcinoma)[2]。鳞状上皮细胞分化的终末细胞是角化细胞,正常角化与凋亡诸多机制相似皆被认为是细胞的一种死亡形式。角化型宫颈鳞癌临床分期更偏向于FIGO Ⅲ期和Ⅳ期,有研究发现角化型子宫颈鳞癌5年生存率为63.4%,而非角化型子宫颈鳞癌则为65.3% (P=0.04),未接受治疗和放疗后的亚组中角化型宫颈鳞癌中位生存期要低于非角化型鳞癌[2]。因此治疗前精确预测宫颈鳞癌细胞的角化程度,对于患者的预后评估及治疗方案的精准制订有着一定指导意义。
目前,传统MRI广泛应用于宫颈癌的诊断、分期、治疗后反映的评估,然而传统MR的解剖成像仅仅能反映病变的形态特征,缺乏对于肿瘤病理类型、分化程度的判断和评估。而随着大数据和人工智能技术的发展,近年来热门的影像组学可以通过高通量的提取图像特征并利用机器学习建模等方法来评估病变异质性从而对病理类型进行分类预测。国外有研究PET图像影像组学特征对宫颈癌病理类型及分化程度进行聚类分析,Liu等[3]和Tsujikawa等[4]也通过ADC图像特征对宫颈癌分化程度进行鉴别等。国内研究多参数MR影像组学可以预测宫颈鳞癌的淋巴结转移和淋巴血管周围侵犯[5]。然而MR影像组学预测宫颈鳞癌病理分型还处于空白,因此我们想通过MR影像组学来对宫颈鳞癌角化型与非角化型预测的价值进行进一步探索。
1 材料与方法
1.1 一般资料
本回顾性研究收集2017年1月至2019年6月我院收治的140例宫颈癌患者为研究对象。纳入标准:(1)18岁以上经病理活检证实宫颈鳞癌的女性患者;(2)活检病理证实后1周内进行常规盆腔MR平扫检查,期间未进行任何治疗;(3)无MRI检查禁忌证;(4)患者均知情同意;(5)患者无其他恶性肿瘤疾病史。排除标准:(1)检查所得图像质量不理想;(2)活检组织过少无法确认角化情况;(3)病理类型非鳞癌患者;(4)病灶小于5 mm3以至于无法准确勾画病灶感兴趣区。最终入组患者数量为103例,中位年龄为57岁(25~77岁),角化型48例,非角化型55例;国际妇产联盟(the International Federation of Gynecology and Obstetrics,FIGO)分期:ⅠB期7例,ⅡA期25例,ⅡB期41例,ⅢA期9例,ⅢB期20例,Ⅳ期1例。将入组患者按照3︰1随机分成训练集和测试集,详见表1。
1.2 病理分析
入组103例肿瘤活检或术后冰冻切片均由我院病理科医生进行分析,根据HE染色后光镜下癌巢形态学特点及细胞质角化程度分为角化型和非角化型鳞癌。其中低分化38例,中分化34例,高分化31例。
1.3 图像采集
采用Philips Ingenia 3.0 T MR扫描仪,通用体表相控阵列线圈包绕整个盆腔。行常规T2W-TSE轴位、T1W-TSE矢状位及T2W-SPAIR (T2R)轴位扫描。扫描参数及图像参数详见表2。
1.4 图像预处理及病灶分割
基于Artificial intelligence kit,AK (GE医疗,中国)软件对图像进行预处理,首先采用模板匹配算法(block matching algorithm)以T2W-TSE序列为参考进行各个序列图像配准。然后采用线性插值法对图像进行重采样,以保证体素大小均一和各向同性。
由我院放射科2名具有10年以上腹盆部影像诊断经验的医师采用AK软件对各序列癌灶进行手动逐层勾画分割出三维感兴趣区(voxel of interest,VOI),各序列最大范围勾画实体肿瘤区域,如遇宫颈管内存在气体或积血等异常信号,在勾画时应该避开该区域,遇到争议时两者协商后勾画。图1为人工勾画肿瘤原发灶感兴趣区病例。
1.5 提取影像组学特征
采用GE healthcare研发的AK软件对T2、T1及T2R序列图像分割的VOI分别进行高通量提取影像组学特征396个,其中包括统计直方图特征(histogram) 42个,形态特征(formfactor) 9个,移动方向为0、45、90、135度,移动步长为1、4、7的灰度共生矩阵特征144个(glcm)和灰度游程矩阵特征180个(glrlm),灰度区域大小矩阵特征(glszm) 11个及基于灰度共生矩阵的哈拉利克特征(haralick) 10个。
1.6 建立机器学习模型及评价
采用基于python语言的orange[6]数据挖掘组件进行模型的建立及评价。详细步骤可见流程图2。
1.6.1 数据预处理
对103例患者影像组学特征异常值替换为平均值,再将其各个特征数据按照μ=0,δ2=1进行标准化。
1.6.2 划分数据集
按照之前入组103例患者3︰1随机分组后的训练集和测试集归纳影像组学特征分集。
1.6.3 筛选特征

表1 患者一般信息及分布情况Tab. 1 General information of patients and Person Chi-square test
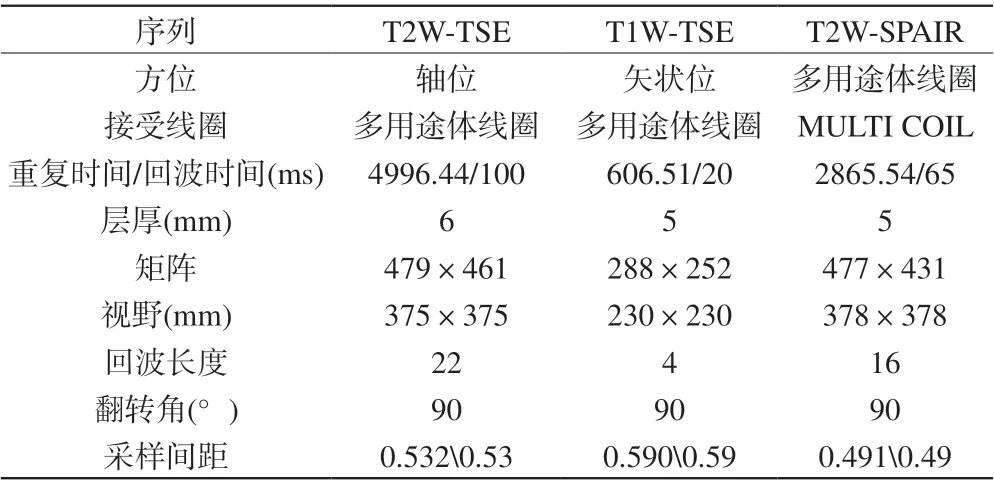
表2 扫描序列及相关参数Tab. 2 Scanning sequence and related parameters
对T1、T2及T2R的特征信息增益率、gini系数、reliefF算法值进行评分并排序,综合筛选评分前五个特征;联合预测模型采用各序列前5个特征进行回归分析,去除冗余特征后为建模所用特征。筛选后的具体特征及评分见表3。
1.6.4 建立预测模型并对其测试
采用朴素贝叶斯算法(naïve bayes)分别对T1、T2、T2R及联合模型的78例数据进行20折交叉验证建模。将25例测试集数据分别代入各个预测模型中,获得预测分类概率值。
1.6.5 模型预测结果评价
采用ROC曲线对训练集和测试集预测效果进行评价。
1.7 统计分析
采用SPSS 25.0统计分析及R语言软件对训练集和测试集的临床特征进行统计检验,由于不满足正态性分布而对两组年龄进行非参数两独立样本M-U秩和检验;对两组病理组织学分类及临床分期的分级数据进行Person卡方检验。对验证集和测试集各个预测模型的ROC曲线进行两两比较的Delong test检验。P<0.05为差异具有统计学意义。
2 结果
2.1 分组患者的临床特征分布统计
训练集和验证集患者的临床特征情况显示于表1中,两组之间的年龄分布的非参数M-U检验结果显示检验统计量为1207.5,P=0.073;两组之间病理分型和临床分期的构成比Person卡方检验的卡方值分别为2.381、5.935;P值均大于0.05,训练集和测试集临床特征分布无显著统计学差异
2.2 各个模型预测结果ROC曲线两两比较
图3和图4显示各个预测模型在训练集和测试集中ROC曲线。预测模型在训练集中的ROC曲线两两配对的delong test统计分析(表4),结果显示联合模型的ROC曲线与T2、T1模型的ROC曲线差异存在统计学差异,P值分别为0.004和0.018。预测模型在测试集中的ROC曲线进行两两配对的delong test统计分析(表5),结果显示只有联合模型与T1模型ROC曲线差异具有统计学意义,P=0.027。
2.3 基于T1、T2、T2脂肪抑制序列及联合以上多序列影像组学模型的预测效能
T1、T2、T2抑脂及联合模型在训练集交叉验证中均表现良好(表6),其中联合模型预测结果ROC曲线的AUC值最高,为0.863 (P<0.001),准确率为0.756.四种模型在测试集中的预测效能见表6,其中T1模型预测效能最低,AUC值为0.673 (P=0.149);联合模型预测结果AUC值最高,为0.860 (P=0.003),准确率为0.720,召回率为0.900,精确率为0.600,F1-score为0.720。

表3 筛选特征及评分Tab. 3 Features selected and scores

表4 训练集中各模型ROC曲线的Delong test检验Tab. 4 Delong test of ROC curve of models in the training dataset

表5 测试集中各模型ROC曲线的Delong test检验Tab. 5 Delong test of ROC curve of models in the testing dataset

表6 各模型在训练集和测试集中的评价结果Tab. 6 Evaluation results of each model on the training and testing sets
3 讨论
通过影像方法来评估及预测宫颈癌病理组织分型对临床决策有着积极意义,国内外已经有很多研究MR动态增强[7]及功能成像[8-10]在鉴别宫颈癌组织分型中的作用。基于高通量的影像特征的影像组学模型近些年引起了广泛关注,从机器学习和人工智能方面为医学影像提供了新的视角。自1975年起WHO将子宫颈肿瘤病理分型为角化型大细胞癌、非角化型大细胞癌及小细胞癌,国外对于宫颈鳞癌预后研究的多元分析中发现临床分期、角化分型为独立预测因素(P<0.05),而病理组织分化程度并不是独立预测因素[2],因此本研究集中于通过传统多序列MR图像的影像组学模型预测子宫颈鳞癌是否为角化型。
对训练集和验证集的其他可能存在干扰的临床特征我们进行统计分析,其年龄、病理组织分型及临床分期P值均>0.05,说明两组之间临床特征分布没有明显的统计学差异,排除其他混杂因素干扰模型建立。
国内外之前有研究MR功能成像与子宫颈鳞癌组织类型及分化程度的关系,叶晓华等[8]利用体素不相干成像研究宫颈癌组织类型和分化程度,发现IVIM中ADC值、D*、D值和f值在宫颈鳞癌和腺癌之间存在明显统计学差异(P<0.05);并发现鳞癌组织分化程度减低,D值随之下降,但其没有统计学差异(P>0.05).而也有国内研究者采用DWI双b值单指数模型的ADC值在不同分化组之间存在明显统计学差异[9](P<0.001). 有研究进一步[3]对DWI的b=0、800、1000的图像提取图像影像组学特征,并用LASSO模型进行交叉验证发现b=1000时模型在错误分类率(0.3642±0.0162)比b=800时的错误分类率(0.3758±0.0118)明显减低,P=0.0076。但其没有测试数据集进行验证,缺乏客观的模型评价。证实了MR的弥散功能成像可以鉴别鳞癌组织分化程度,猜想可能是因为随着肿瘤分化减低,癌巢的角化程度减低,细胞质内角蛋白和细胞间桥减少,导致细胞变形,细胞密度增高,整体癌巢空间的水分子弥散作用减低,所以研究发现标准化ADC值与D值减低。Meng等[10]采用MR酰胺质子转移(amide proton transfer,APT)对宫颈癌组织分化程度差异进行探索,发现低分化组鳞癌的MTRasym (3.5 ppm)明显高于高分化组和中分化组(P=0.02/0.01),同样是因为低分化组细胞密度增高导致MTRasym (3.5 ppm)增高。
而本研究基于传统多序列MR图像的影像组学预测子宫颈鳞癌病理分型在训练集交叉验证中,各个模型的预测结果均表现良好,其中联合预测模型及T2抑制模型的AUC值较高,分别为0.863、0.819,P值均小于0.001,说明其在训练集中的预测效能较高。在测试集中联合模型ROC曲线的AUC值为0.860,P=0.003;T2抑脂模型ROC曲线的AUC值为0.780,P=0.02;T2模型ROC曲线的AUC值为0.830,P=0.006。联合模型在训练集和测试集中均拟合良好,而T2抑脂模型的准确率减低;T2模型在测试集中AUC值得到明显提升,可能存在拟合过度表现,但仍具有统计学意义。同时笔者研究筛选后的模型中发现如GLCM的correlation、differenceEntropy及ClusterShade等反映了病灶体素之间的相关性,混杂程度及集群形态的特征对分类角化型和非角化型鳞癌有着明显作用,猜想是因为随着癌巢角化程度减低,细胞排列混杂有关,这还需要高分辨病理图像的VOI特征分析进行进一步证实。也有类似研究利用MR的T2加权、T2脂肪抑制加权及动态增强图像的影像组学预测56例子宫颈鳞癌的淋巴血管周围侵犯、淋巴结转移及分化程度[5],其研究也发现结合多序列MR图像的影像组学模型可以区分中分化和低分化的子宫颈鳞癌,AUC值为0.802,灵敏度和特异度分别为76.5%和73.3%,由于其病例数量的局限,入组病例中未能包含高分化的子宫颈鳞癌,同时也未能进行机器学习模型的构建和组外测试。
我们将传统MR平扫图像的影像组学特征与机器学习等数据挖掘技术相结合,建立预测模型,用测试数据集进行组外客观的评价,联合T1、T2及T2抑脂模型对于预测宫颈癌非角化型准确性良好。在对模型的两两配对检验中也可以看出联合模型较T1模型ROC曲线的提升存在明显统计学差异(P=0.027),可能因为T1图像无法准确反映肿瘤边界,并且体素灰度基本一致,纹理特征在角化型和非角化型之间无明显差异;而加入T2脂肪抑制序列,使脂肪信号减少了对图像特征的影响。
国内外学者也有采用PET影像组学研究对角化型和非角化型鳞癌进行分类鉴别[4],其研究仅发现子宫颈鳞癌原发灶PET图像NGLCM的二阶相关性特征(0.70±0.07)高于非角化型鳞癌(0.64±0.07,P=0.0030),可能是因为PET图像受限于本身分辨率和体素大小所导致。类似PET影像组学研究中亦发现灰度区域大小矩阵(gray-level size zone matrix,GLSZM)的短区域因子(short-zone emphasis,SZE)可以区分子宫颈鳞癌和非鳞癌,P=0.025[11]。而MR图像本身软组织的高分辨率更能反映肿瘤异质性和体素分布情况,才使得提取出的纹理特征在朴素贝叶斯分类器中表现良好,希望以后可以联合MR平扫和功能图像特征预测病理组织分型。
总之,基于MR平扫的影像组学特征可以预测子宫颈鳞癌角化型和非角化型,并且联合多序列图像特征的模型预测效果更好。本研究局限性在于病例数量稍少,未能进一步加入弥散及增强等序列图像,但常规传统MR影像组学在鉴别子宫颈鳞癌组织分型上仍是可行的。医工结合的影像学和机器学习模型相结合在预测宫颈癌病理组织分型提供了一个新方法,对临床决策及预后评估有一定的参考价值,更为未来的人工智能医疗奠定研究基础。
利益冲突:无。
