COL6A2基因在胃癌中的表达及临床意义
2020-09-29郑多安郑漫漫孟翔凌孙登群孙艳军陈晓玲
郑多安,郑漫漫,孟翔凌,孙登群,孙艳军,陈晓玲
胃癌是我国最常见的胃肠道恶性肿瘤之一,位居癌症死亡率第三位[1]。近年来,尽管胃癌的发病率和死亡率有所下降,但早期诊断和治疗仍然至关重要[2]。胃癌发病主要与幽门螺杆菌感染、吸烟、环境和遗传等多种因素有关[3]。由于早期症状不明显,大多数胃癌患者确诊时已处于中晚期,预后较差。因此,亟需发现新的灵敏度高、特异性强的胃癌预后标志物,为胃癌的诊断和治疗提供理论依据。Ⅵ型胶原蛋白α2链(collagen type Ⅵ α2 chain,COL6A2)是胶原蛋白家族中的一员,具有Gly-X-Y三联体重复序列构成的三螺旋结构域,在细胞外基质的合成过程中发挥重要作用[4]。多项生物信息学研究结果显示,COL6A2在多种肿瘤的发生发展中有重要作用[5-7]。然而,在胃癌方面国内尚缺乏相关验证性实验及临床病理资料分析。本研究旨在通过基因探针富集分析(gene set enrichment analysis,GSEA),探索COL6A2在胃癌中的具体表达情况及作用机制,为判断胃癌患者预后生物标志物提供借鉴。
1 对象与方法
1.1 对象 选取2011-01至2012-12收治于武警安徽总队医院普外科的62例胃癌患者作为研究对象。其中男38例,女24例;年龄24~82岁,平均66.2岁。术后随访时间为5~65个月,平均21.5个月。收集患者手术胃癌组织及相对应的癌旁正常黏膜组织病理切片。病理分期参照美国癌症联合委员会(AJCC)及国际抗癌联盟(UICC)第七版TNM分期标准。纳入标准:(1)行胃癌根治术或姑息术,术后病理确诊为胃癌;(2)术前未行任何放化疗及免疫治疗;(3)临床病理资料及术后随访资料完整。排除标准:(1)胃癌复发或残胃癌;(2)合并有多脏器功能不全或其他部位肿瘤者;(3)随访时间少于5个月。所有患者均签署知情同意书,本研究经武警安徽总队医院伦理委员会批准通过。
1.2 试剂 兔抗人COL6A2多克隆抗体(型号DF6434)购自Affinity公司,免疫组化通用SP试剂盒(型号SP-9000)及DAB显色试剂盒(型号ZLI-9018)购自北京中杉金桥生物技术有限公司。
1.3 方法
1.3.1 免疫组化 按照试剂盒说明书将石蜡包埋的4 μm厚切片在新鲜二甲苯中脱蜡,梯度乙醇水化。采用柠檬酸盐缓冲液(pH6.0)在微波炉中抗原修复,3%H2O2阻断内源性过氧化物酶后滴加血清封闭。然后将切片与一抗(工作浓度1∶100)在4 ℃环境下孵育过夜。复温后滴加二抗室温下孵育15 min,DAB显色5 min。苏木精复染,脱水透明后中性树胶封片。
1.3.2 染色结果判定 由两位病理科医师进行独立阅片,随机选取5个高倍镜视野, 按照镜下阳性细胞百分比和染色强度进行半定量评分[8]。评分标准:(1)阳性细胞百分比,无染色为0分,0~25%1分,26%~50%为2分,51%~ 75%为3分,76%~100%为4分;(2)染色强度,阴性0分,弱阳性1分,阳性2分,强阳性3分。最终得分由阳性细胞百分比与染色强度的分数乘积产生。评分≥8定义为高表达组,评分0~8定义为低表达组。
1.3.3 基因富集分析 为探究COL6A2在胃癌中的潜在作用机制,研究组从癌症基因组图谱(TCGA)数据库下载胃癌基因表达矩阵,按照COL6A2表达值的中位数将样本分为高表达组和低表达组。使用GSEA 3.0软件进行分析,参考基因集为c2.cp.kegg.v6.2.symbols.gmt,并计算标准化富集分数(NES)。
1.4 统计学处理 采用SPSS 21.0软件进行数据分析,使用GraphPad Prism 7.0软件进行制图。分类变量的组间比较采用χ2检验;使用Kaplan-Meier法绘制生存曲线, 并进行Log-rank检验;Cox比例风险模型进行单因素和多因素分析;相关性分析采用Pearson相关分析。GSEA分析中, 将错误发现率(FDR)<0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 COL6A2在胃癌组织及癌旁正常组织中的表达 胃癌组织中COL6A2蛋白阳性表达呈棕黄色或棕褐色(图1),主要位于细胞浆中,部分平滑肌细胞也可见表达,其阳性表达率为43.5%(27/62),而在配对的癌旁正常组织中阳性表达率仅为25.8%(16/62),差异有统计学意义(χ2=4.308;P=0.038)。

图1 COL6A2在胃癌及癌旁正常组织中免疫组化(×200)
2.2 COL6A2蛋白表达与胃癌临床病理参数关系 COL6A2蛋白表达水平与胃癌患者有无淋巴结转移、远处转移及TNM分期密切相关,差异有统计学意义(P<0.05,表1),而与性别、年龄、肿瘤大小及分化程度无关。

表1 COL6A2的表达与胃癌患者临床病理特征的关系 (n;%)
2.3 COL6A2蛋白表达与胃癌患者预后 Kaplan-Meier生存分析及生存曲线显示,COL6A2高表达患者的预后明显差于低表达者(Log-rankP=0.003,图2A)。采用Kaplan-Meier Plotter在线数据库进行生存分析验证,结果表明COL6A2在胃癌中的异常高表达与预后不良有关(图2B)。COX单因素分析结果显示,分化程度、淋巴结转移、远处转移、TNM分期及高表达COL6A2是影响胃癌患者预后的重要因素。进一步将单因素分析有意义的变量纳入COX多因素分析模型发现,远处转移及高表达COL6A2是胃癌患者的独立预后因素(表2)。

图2 COL6A2的表达水平与胃癌患者预后的关系
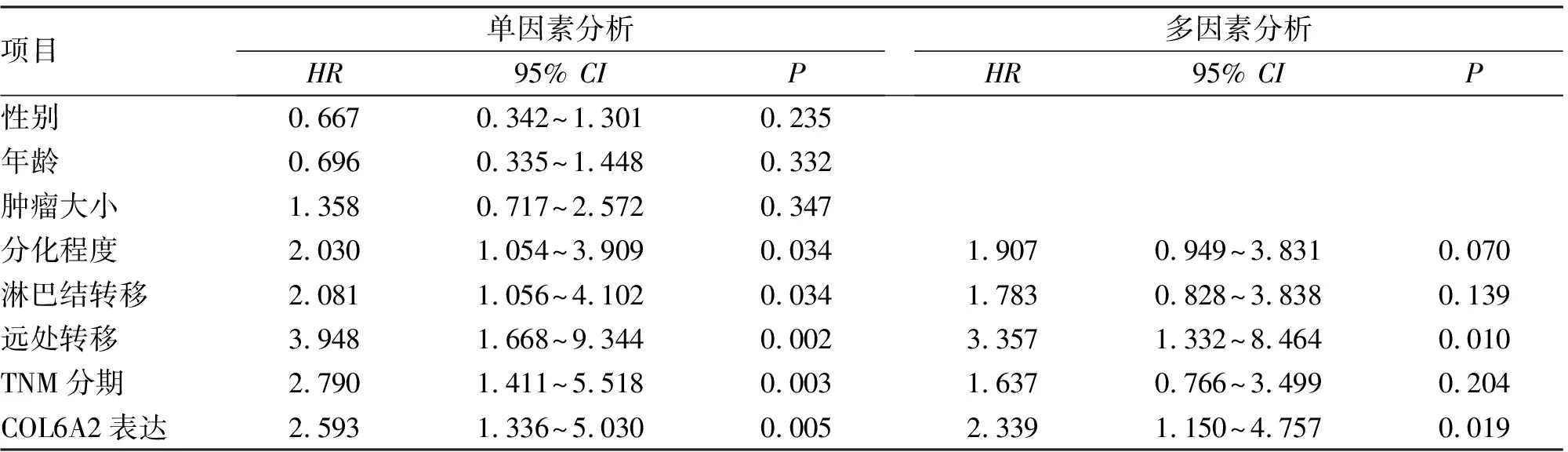
表2 胃癌患者总体生存的COX单因素和多因素分析
2.4 COL6A2在胃癌中的可能作用机制 通过TCGA胃癌表达数据来明确COL6A2与EMT相关基因之间表达的相关性。COL6A2与上皮标志蛋白(E-cadherin)的表达显著负相关,而与间充质标志蛋白(N-cadherin和Vimentin)的表达为正相关(图3),还与EMT相关转录因子(Snail、Slug和Twist)的表达呈正相关。因此,COL6A2可能参与了胃癌中EMT的进程。GSEA结果显示,高表达COL6A2样本主要富集到细胞黏着斑、细胞外基质-受体相互作用、肌动蛋白细胞骨架调控、肿瘤通路等基因集(图4)。同时也包括TGF-beta信号通路(FDR=0.002)及MAPK信号通路(FDR=0.001,图5)等经典肿瘤信号通路。

图3 COL6A2与EMT相关基因表达的相关性

图4 高表达COL6A2胃癌患者GSEA分析(排名前20位基因集)
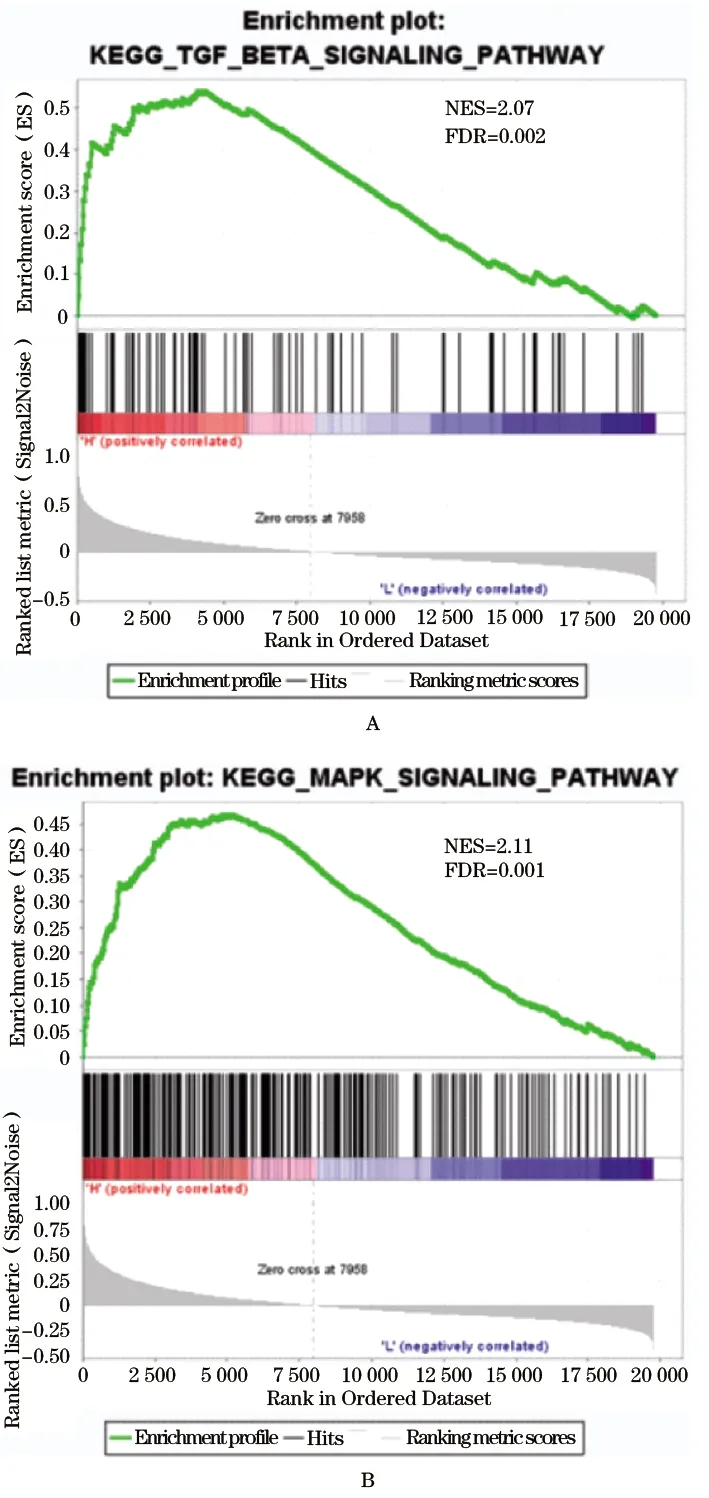
图5 GSEA分析富集结果
3 讨 论
目前,外科手术切除仍然是胃癌最有效的治疗方式,然而,局部浸润和远处转移往往导致预后不良[9]。因此,迫切需要找到新的具有良好预后价值的标志物,从而能够识别生存率低或具有高转移风险的胃癌患者。COL6A2是Ⅵ型胶原蛋白的一种亚型,编码基因位于染色体21q22.3,以往的研究大多侧重于肌肉相关疾病[10]。近年来,随着基因芯片技术和生物信息学的发展,已有多项研究发现,COL6A2在膀胱癌、脑肿瘤、卵巢癌等多种恶性肿瘤中异常高表达[7,11,12],COL6A2基因的甲基化水平在宫颈癌和儿童急性淋巴细胞白血病中也明显升高[13,14]。最近的一项研究指出,COL6A2基因的单核苷酸多态性可能与胰腺癌的发病有关[15]。但国内外关于COL6A2蛋白在胃癌中的具体表达情况及其临床意义的文献报道还相对较少。本研究通过免疫组化实验初步明确了COL6A2蛋白在胃癌组织中的表达量明显高于癌旁组织,且其异常高表达与有无淋巴结转移、远处转移及TNM分期显著相关。COL6A2表达水平也是影响胃癌患者的独立预后因素,低表达胃癌患者的生存获益要明显优于高表达患者。
越来越多的研究发现,EMT的激活可增强肿瘤的转移表型,如迁移,侵袭和转移[16-18]。鉴于高表达的COL6A2与胃癌转移表型有密切关联,本研究评估了COL6A2与EMT相关基因的表达相关性。结果发现COL6A2表达与EMT的进程显著正相关。此外,为进一步探索COL6A2在胃癌中作用的具体机制,本研究还进行了GSEA分析并发现高表达COL6A2样本显著富集到多条肿瘤相关通路,如TGF-beta信号通路和MAPK信号通路。TGF-beta类配体可以与Ⅱ型受体结合并招募磷酸化Ⅰ型受体,最后激活Smad蛋白进入细胞核进行转录调控[19]。TGF-beta信号通路在肿瘤生物过程中的多个环节发挥关键作用,并可通过调节EMT相关转录因子来诱导肿瘤细胞发生EMT[20,21]。最新的一项研究结果发现,肝癌间充质干细胞可通过激活MAPK信号通路促进肿瘤生长,并通过激活EMT来促进转移[22]。目前,COL6A2在这两条经典肿瘤信号通路中的具体作用机制仍有待进一步研究。
现有的研究结果指出Ⅵ型胶原蛋白可能通过其裂解产物ETP肽来介导促瘤效应,ETP肽能增强TGF-beta信号转导促进乳腺癌的恶性进展[23]。值得注意的是,整联蛋白是Ⅵ型胶原蛋白的受体之一,Ⅵ型胶原蛋白能够通过聚类整联蛋白激活黏着斑激酶,并进一步激活其下游的MAPK信号通路促进非小细胞肺癌的发展[24]。然而,COL6A2在胃癌中的具体作用机制是否通过介导这两条经典肿瘤信号通路仍需更多的基础实验证据来进行验证。当然,本研究仍有一些不足之处:(1)为保证随访资料的完整性,本研究剔除了失访病例最终纳入62例患者,可能会导致样本量相对偏小;(2)仅从组织蛋白水平检测胃癌中COL6A2的表达,缺乏细胞、动物层面及mRNA表达水平的检测;(3)没有对COL6A2与EMT之间的关系进行实验验证。
综上所述,本研究发现与癌旁正常组织相比,COL6A2在胃癌中明显高表达,是影响胃癌预后的独立因素,其在胃癌中的具体作用机制可能涉及通过调控EMT及TGF-beta信号通路和MAPK信号通路。COL6A2有望成为预测胃癌预后的生物标志物,具体的通路研究仍需要进一步的实验探索。
